
Równowagi jonowe w roztworach
Dysocjacja elektrolityczna – rola wody
O
H
H
• Kąt między wiązaniami = 104.5
o
• Moment dipolowy = 1.83 D (0.61*10
-29
C*m)
• Przenikalność dielektryczna próżni (powietrza) = 81
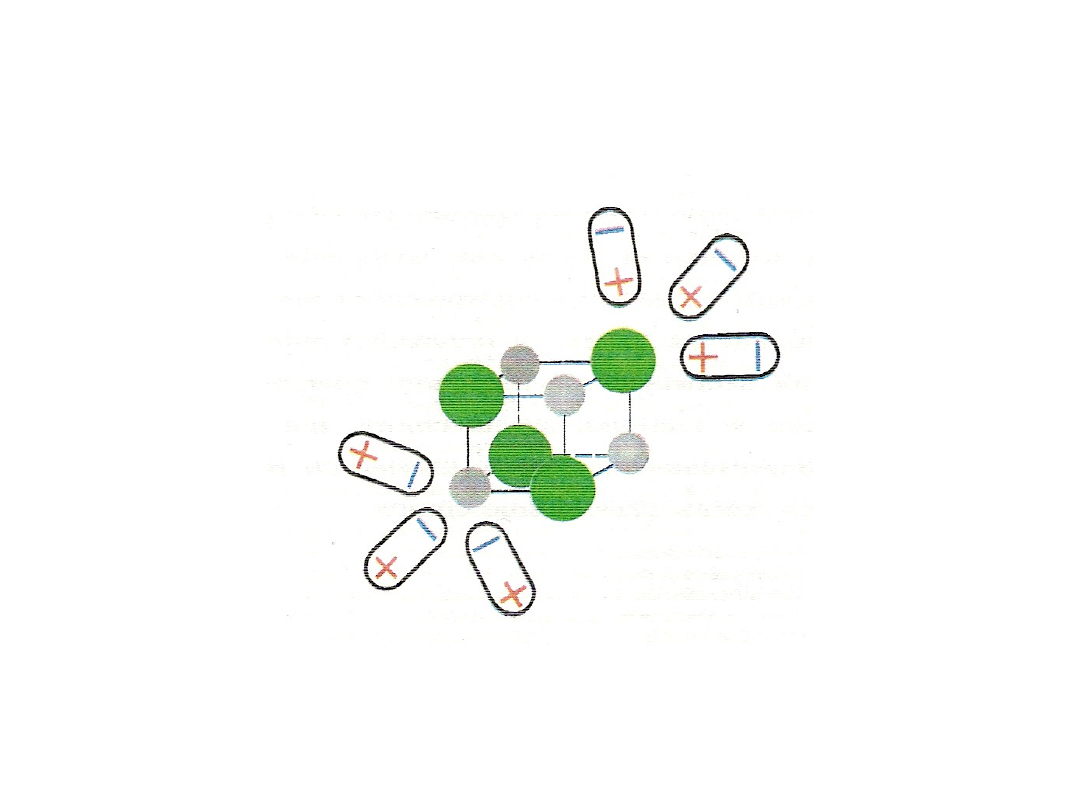
Mechanizm zjawiska w przypadku związków o wiązaniu
jonowym
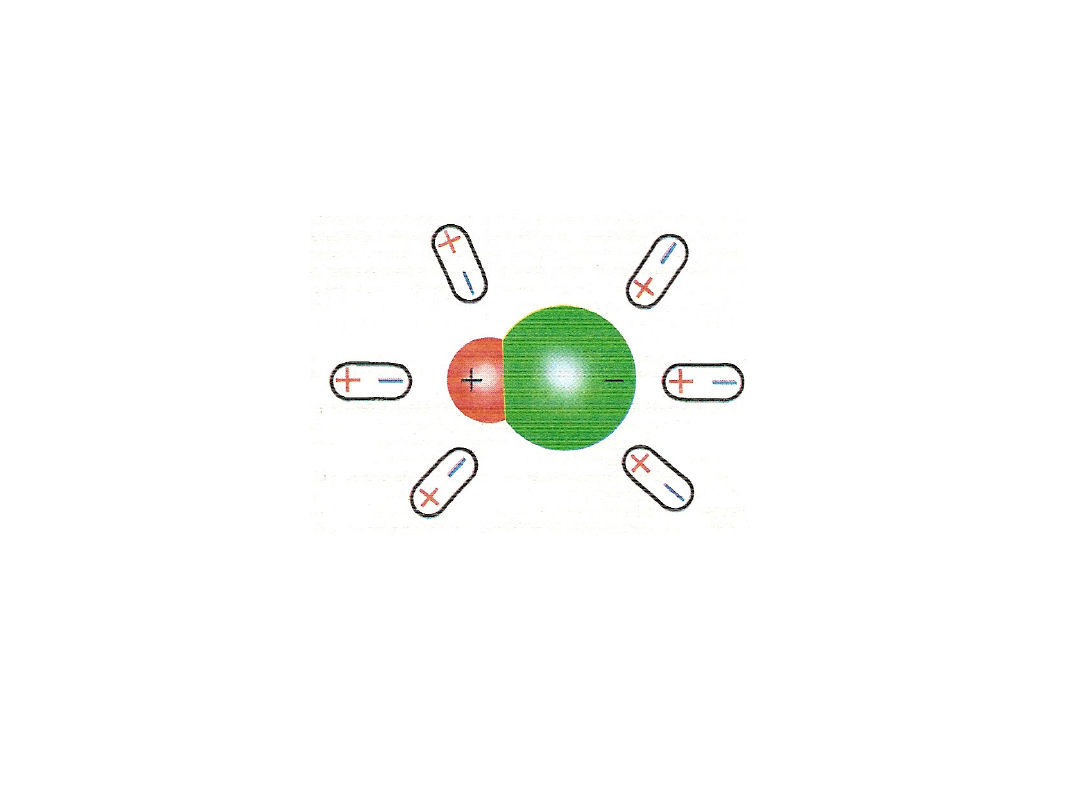
Mechanizm zjawiska w przypadku związków o wiązaniu
atomowym spolaryzowanym
Energetyka procesu rozpuszczania substancji jonowej
U
H
+
(hydratacji)
H
-
(hydratacji)
H
(rozp)
=
+
+
NaCl
(S)
Na
+
(aq)
+ Cl
-
(aq)
Na
+
(g)
+ Cl
-
(g)
U
H
+
(hydratacji)
H
-
(hydratacji)
H
(rozp)

Elektrolity słabe
0
0
2
0
2
0
0
0
0
0
0
0
0
0
0
1
1
)
1
(
)
1
(
]
[
]
[
]
[
]
[
]
[
]
[
c
K
c
K
c
c
c
c
K
c
c
c
AB
c
B
A
AB
B
A
K
B
A
AB
c
c
n
n
N
N
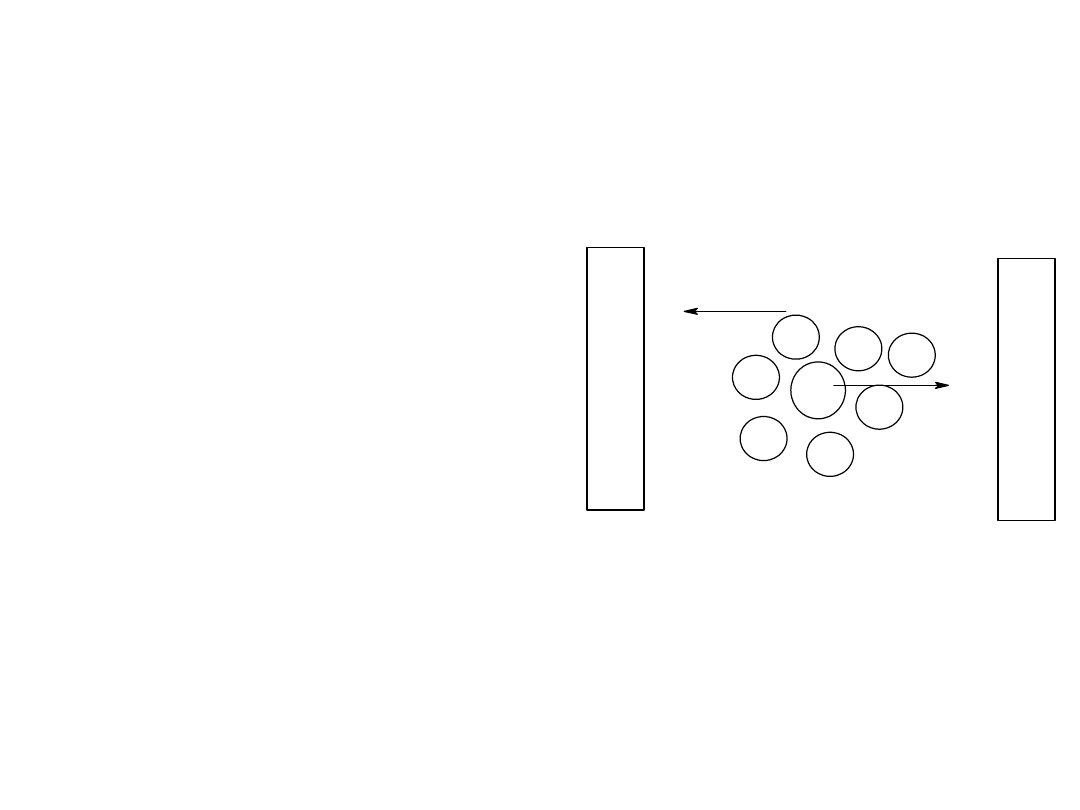
Elektrolity mocne
• Elektrolity mocne – całkowicie
dysocjują na jony ( = 1 lub
100%)
• Wskutek wzajemnego
oddziaływania jonów elektrolity
mocne (szczególnie w stężonych
roztworach) zachowują się tak
jakby nie były całkowicie
zdysocjowane.
• Wydaje się że stężenie
elektrolitu jest mniejsze niż w
rzeczywistości
• To zmniejszone stężenie
odpowiadające zachowaniu się
roztworu nazywamy aktywnością
• a = f*c
• 0 < f ≤ 1
+
-
-
-
-
-
-
-
+
_
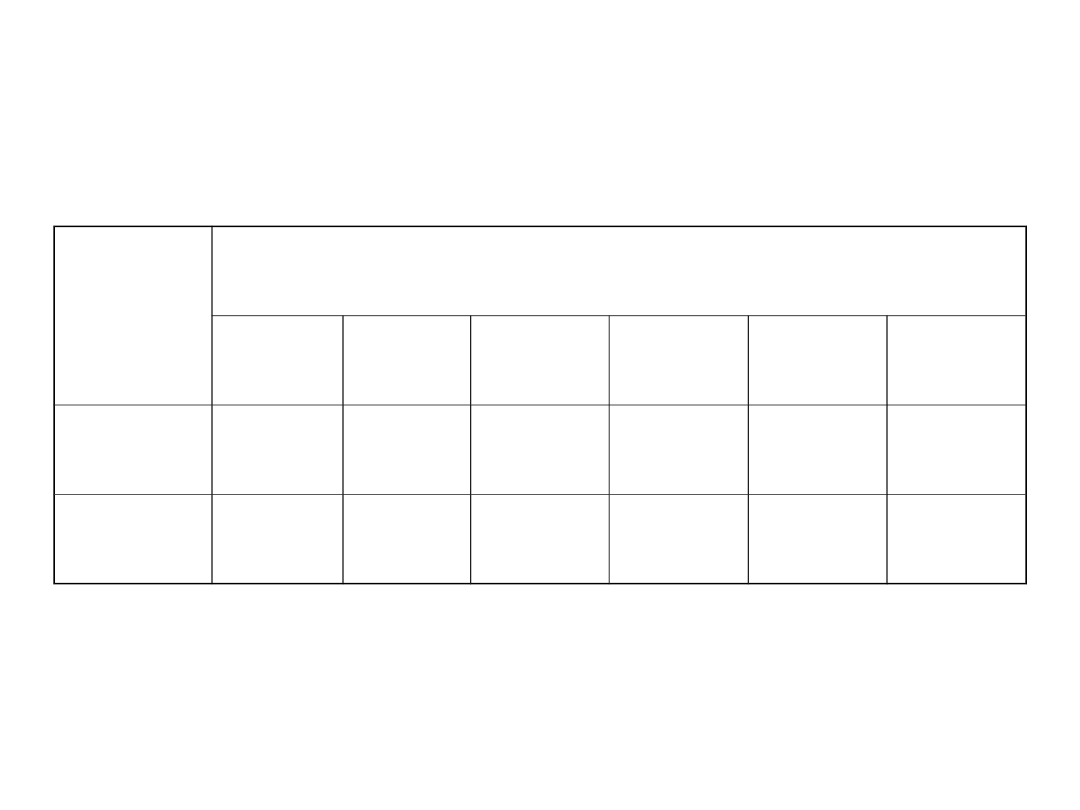
Współczynniki aktywności
Elektrolit
Stężenie
0.000
0.001
0.010
0.100
0.500
1.000
NaCl
1.000
0.966
0.903
0.778
0.680
0.656
Na
2
SO
4
1.000
0.887
0.721
0.435
0.267
0.206
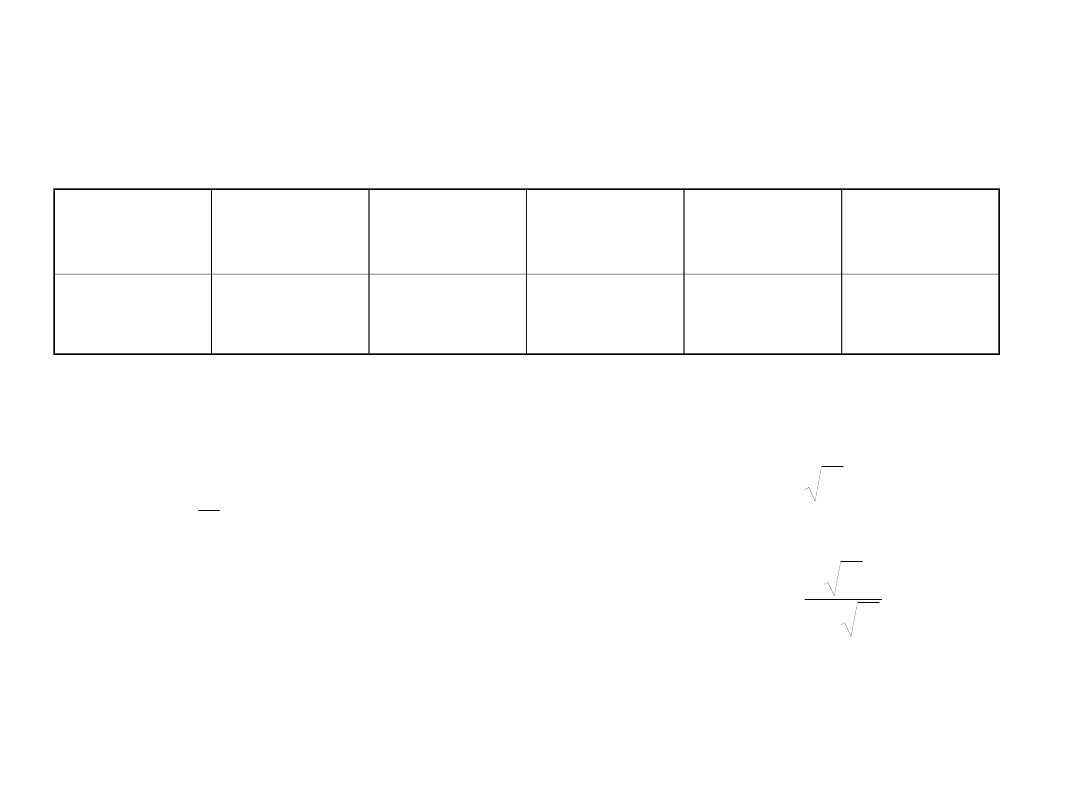
Współczynniki aktywności
Stężenie
NaClO
4
0.014
0.04
0.1
0.21
0.46
f
HCl [c=0.05]
0.82
0.80
0.77
0.75
0.73
z
c
i
i
2
2
1
1
509
0
509
0
2
2
z
z
f
f
.
log
.
log

Współczynniki aktywności
Elektrolit
Stężenie
1 M
2M
3M
HClO
4
0.823
1.055
1.448
HCl
0.809
1.009
1.316
MgCl
2
0.570
1.053
2.32

Mocny kwas jednoprotonowy
0
w
K
H
C
2
H
8
10
5
C
6
10
5
3)
w
K
log
2
1
pH
w
K
H
OH
H
8
10
5
C
2)
C
log
pH
H
C
OH
H
6
10
5
C
1)
H
w
K
H
OH
H
C
OH
H
O
2
H
A
H
HA
Słaby kwas jednoprotonowy
0
K
C
K
H
2
H
H
K
H
C
H
w
K
H
C
A
K
A
H
A
HA
C
K
A
H
H
w
K
H
HA
OH
H
C
OH
H
w
K
OH
H
O
2
H
HA
A
H
K
A
H
HA
Kwas wieloprotonowy
n
1
i
i
i
1
n
K
i
H
1
n
1
i
i
i
1
n
K
i
H
i
1
K
....
1
n
K
n
K
n
H
....
1
n
K
n
K
2
H
n
K
H
1
1
K
....
1
n
K
n
K
n
H
n
....
1
n
K
n
K
2
H
2
n
K
H
C
OH
H
C
n
A
n
H
....
2)
(n
A
2
H
1)
(n
HA
n
A
A
n
H
n
....
2)
(n
A
2
H
2
1)
(n
HA
C
OH
H
C
n
A
n
H
....
2)
(n
A
2
H
1)
(n
HA
n
A
C
A
n
H
n
....
2)
(n
A
2
H
2
1)
(n
HA
OH
H
C
n
1)
(n
HA
n
A
H
2
K
n
A
H
1)
(n
HA
..
..........
..........
..........
..........
..........
..........
..........
..........
A
1
n
H
2
A
2
n
H
H
2
K
2
A
2
n
H
H
A
1
n
H
A
n
H
A
1
n
H
H
1
K
A
1
n
H
H
A
n
H
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
3 Równowagi jonowe w roztworach
Równowagi jonowe w roztworach
3 Równowagi jonowe w roztworach
38 Równowagi jonowe w roztworach wodnych (dysocjacja, iloczyn jonowy wody, pH, indykatory pH, roztwo
Cwiczenia 5 - Równowagi jonowe - pH roztworow, Wykładnik stężenia jonów wodorowych (pH) -- zadania
, chemia fizyczna, Równowagi pH w roztworach buforowych
1 12 2010 Równowagi jonowe w układach heterogenicznych
8 równowagi jonowe
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
13 Równowagi w roztworach elektrolitów słabych
1 Równowagi w roztworach elektrolitów Kwasy i zasady
6 pHelek ul, Temat: Równowaga w roztworach elektrolitów
chemia roztwory i reakcje jonowe
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
więcej podobnych podstron