
Budowa atomu i Układu
okresowego
- Liczby kwantowe

Czym są liczby kwantowe?
W mechanice kwantowej liczby te
określają stan w jakim aktualnie znajduje
się elektron.
KWANTOWANIE!
Czyli określanie
dozwolonych wartości jakie ta wielkość
może osiągać.

Główna liczba kwantowa „n”
Określa energie elektronu w atomie,
wielkość powierzchni granicznej orbitalu
oraz numer powłoki. Definiuje
maksymalną liczbę elektronów znajdującą
się na powłoce wzorem 2n
2
.
n = 1 2 3
Mg

Poboczna liczba kwantowa „l”
Charakteryzuje moment pędu elektronu,
kształt orbitalu oraz numer i symbol
podpowłoki.
l = 0, 1, 2…∞ (n-1)
np.:
n = 1 więc l = 0
gdy l = 0 to podpowłoka ma
symbol s
H

Magnetyczna liczba kwantowa „m”
Określa rzut orbitalnego momentu pędu na
wyróżniony kierunek w przestrzeni.
m = -l…0…l (jeśli l = 2 to m = -2, -1, 0, 1,
2)
m =-2 -1 0 1 2
Podpowłoka d jest pięciokrotnie
zdegenerowana czyli posiada 5 orbitali o tej
samej energii orbitalnej lecz innej orientacji
przestrzennej.
↑ ↑ ↑
↑ ↑

Magnetyczna spinowa liczba
kwantowa „m
s
”
Podaje dwa położenia elektronu w
zewnętrznym polu magnetycznym.
↑m
s
=
1
∕
2
gdy e‾ wykonuje ruchy rotacyjne w prawo
↓m
s
= -
1
∕
2
gdy e‾ wykonuje ruchy rotacyjne w lewo
Spin to dodatkowy moment pędu elektronu
nie związany z ruchem po okręgu.
Konsekwencją jego występowania są
właściwości magnetyczne elektronu.
↑↓ ↑↓
↑
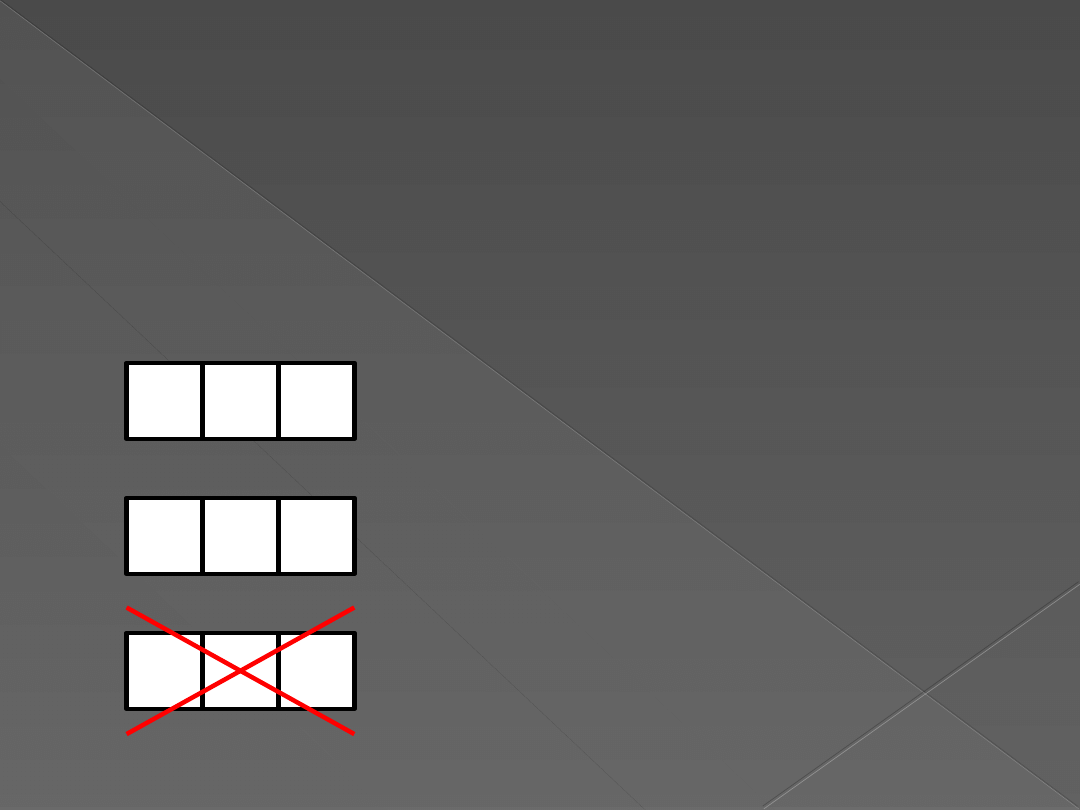
Reguła Hunda
„Najkorzystniejsze dla atomu jest takie
rozmieszczenie e
‾
by jak najwięcej
e‾
miało zgodnie skierowane spiny.”
dobrze!
dobrze!
źle!
↑↓ ↑↓
↑↓
↑↓ ↑
↑
↑↑ ↑
↓↓
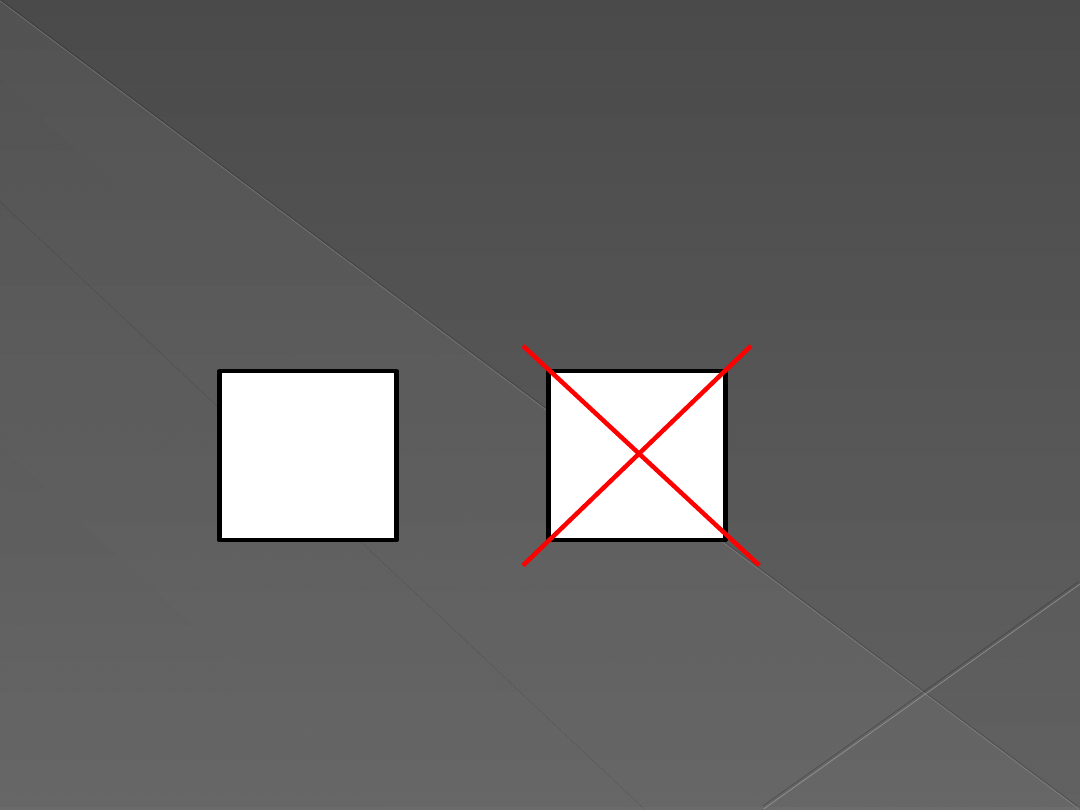
Zakaz Pauliego
„W atomie nie może być dwóch elektronów
z takimi samymi wszystkimi liczbami
kwantowymi.”
Układ jest trwały gdyż siły magnetyczne
przewyższają odpychanie elektrostatyczne.
↑
↓
↑
↑

Konfiguracja oraz kwantowanie
atomu Boru:
5
B 1s
2
2s
2
2p
1
n = 2
l = 1
m = -1
m =
1
∕
2
↑
↓
↑
↓
↑

Dziękuje za uwagę!
Prezentacje przygotowała Klaudia Siuda z
klasy 2b
Document Outline
- Slide 1
- Czym są liczby kwantowe?
- Główna liczba kwantowa „n”
- Poboczna liczba kwantowa „l”
- Magnetyczna liczba kwantowa „m”
- Magnetyczna spinowa liczba kwantowa „ms”
- Reguła Hunda
- Zakaz Pauliego
- Slide 9
- Dziękuje za uwagę!
Wyszukiwarka
Podobne podstrony:
SPRAWDZIAN Z DZIAŁU BUDOWA ATOMU I UKŁAD OKRESOWY, sprawdziany z chemi
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
Budowa atomu a układ okresowy pierwiastków chemicznych
pods. - budowa atomu a układ okresowy 2, chemia, podsumowanie wiadomości
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
pods. - budowa atomu a układ okresowy 1, Budowa atomu, a układ okresowy - powtórzenie
CHEMIA - ZBIÓR I TESTY , BUDOWA ATOMU, UKŁAD OKRESOWY
Budowa Atomu a Uklad Okresowy
Budowa atomu a układ okresowy pierwiastków chemicznych
Budowa Układu Okresowego Pierwiastków
Uklad okresowy pierwiastkow a budowa atomu
Budowa układu okresowego, chemia kosmetyków
Budowa Układu Okresowego Pierwiastków
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
otrzymywanie tlenu i siarki, charakterystyka poszczególnych grup układu okresowego
BUDOWA I FUNKCJA UKŁADU NERWOWEGO, weterynaria, Anatomia
więcej podobnych podstron