3.1. Podstawowe pojęcia chemiczne.
Budowa atomu. Układ okresowy.
1. Znając liczbę atomową izotopu można w nim określić:
liczbę neutronów
liczbę protonów i neutronów
liczbę protonów
liczbę nukleonów
2. Liczba masowa jest to:
liczba neutronów w jądrze atomowym
liczba protonów w jądrze atomowym
liczba nukleonów w jądrze atomowym
masa atomu wyrażona w u (jednostkach masy atomowej)
3. Nukleony to:
protony i elektrony
neutrony i elektrony
protony i neutrony
wszystkie wymienione cząstki elementarne
4. Wybierz właściwe zakończenie zdania: Liczba porządkowa nie jest …
sumą protonów w jądrze atomowym
liczbą atomową
liczbą masową
sumą elektronów w atomie
5. Liczba atomowa jest to:
liczba neutronów w jądrze atomowym
liczba protonów w jądrze atomowym
liczba nukleonów w jądrze atomowym
masa atomu wyrażona w u (jednostkach masy atomowej)
6. Izotopy danego pierwiastka różnią się między sobą:
liczbą elektronów
liczbą atomową
liczbą protonów
liczbą neutronów
7. Jądra atomów glinu ![]()
zbudowane są z:
14 protonów i 13 neutronów
13 protonów i 14 elektronów
14 neutronów i 13 protonów
13 protonów i 27 neutronów
8. W którym z poniższych punktów wymieniono izotopy ?
9. Jon składa się z następujących cząstek elementarnych:
17 protonów, 18 neutronów, 17 elektronów
17 protonów, 18 neutronów, 18 elektronów
17 protonów, 35 neutronów, 18 elektronów
35 protonów, 17 neutronów, 18 elektronów
10. Ze wzrostem liczb atomowych, promienie atomowe:
maleją w poszczególnych okresach
rosną w poszczególnych okresach
maleją w poszczególnych grupach
nie zmieniają się
11. Elektroujemność w układzie okresowym, ze wzrostem liczb atomowych pierwiastków, zmienia się następująco:
maleje w okresach, a rośnie w grupach
rośnie w okresach i rośnie w grupach
rośnie w okresach, a maleje w grupach
maleje w okresach i maleje w grupach
12. Największą elektroujemnością charakteryzują się:
gazy szlachetne
litowce
metale ciężkie
fluor i tlen
13. Konfiguracja elektronowa atomu pierwiastka 3 okresu, V grupy głównej układu okresowego jest następująca:
1s2 2s2 2p6 3s2 3p5
1s2 2s2 2p6 3s2 3p6 4s2 4p6 5s2 5p3
1s2 2p6 3s2 3p5
1s2 2s2 2p6 3s2 3p3
14. Pierwiastek, którego atomy mają następującą konfigurację elektronową
1s2 2s2 2p6 3s2 3p6 4s2 3d3, znajduje się w:
3 okresie, 3 grupie pobocznej
4 okresie, 3 grupie pobocznej
4 okresie, 5 grupie pobocznej
3 okresie, 5 grupie pobocznej
15. Konfiguracja elektronowa atomu arsenu (33As) jest następująca:
K2 L8 M13 N10
K2 L8 M8 N8 O7
K2 L8 M18 N5
K2 L18 M13
16. Atomy pierwiastka, którego liczba atomowa wynosi 8 a masowa 16, mają następującą konfigurację elektronową:
1s2 2s2 2p6 3s2 3p6
1s2 2s2 2p4
1s2 2s2 2p6 2d2
1s2 2s2 2p6 3s2 3p4
17. Atomy pierwiastka położonego w 4 okresie, 6 grupie głównej mają następującą konfigurację elektronową:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
1s2 2s2 2p6 3s2 3p6 4s2 3d4
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
1s2 2s2 2p6 3s2 3p6 4s2 3d6
18. Który z poniższych zapisów ilustruje stan elektronów w jonie 11Na+ ?
1s2 2s2 2p6 3s1
1s2 2s2 2p6 3s2
1s2 2s2 2p6
1s2 2s2 2p5 3s2
19. Która z podanych konfiguracji elektronowych dotyczy stanu wzbudzonego atomu ?
1s2 2s2 2p6 3s2
1s2 2s2 2p6 3s1 3p2
1s2 2s2 2p6 3s2 3p3
1s2 2s2 2p6 3s1
20. Konfiguracja elektronowa: 1s2 2s2 2p6 3s2 3p6, występuje w poniższych jonach, z wyjątkiem:
19K+
20Ca2+
12Mg2+
17Cl−
21. Konfiguracja elektronowa atomu pierwiastka występującego na stopniach utlenienia i jest następująca:
K2 L8 M3
K2 L4
K2 L8 M8 N2
K2 L8 M6
22. Pierwiastek, którego liczba porządkowa wynosi 15, może występować tylko na następujących stopniach utlenienia:
3, 3
3, 3, 5
3, 3, 5
5, 5
23. Atomy pierwiastka o konfiguracji elektronowej 1s2 2s2 2p6 3s2 3p6 4s2 3d3, w związkach chemicznych mogą występować na stopniu utlenienia:
od 3 do 5
od 2 do 5
2
od 2 do 6
24. Wskaż błędne stwierdzenie:
liczba masowa pierwiastka jest większa od liczby atomowej lub jej równa
liczba atomowa jest zazwyczaj większa od liczby masowej
izotopy tego samego pierwiastka mają tę samą liczbę atomową
znając liczbę atomową pierwiastka można podać do którego okresu on należy
25. Piąta grupa główna układu okresowego to:
berylowce
azotowce
węglowce
fluorowce
26. Pierwiastkowi leżącemu w V grupie głównej i III okresie odpowiadają wzory jego połączeń z tlenem i wodorem:
X2O5, XH3
X2O7, HX
XO2, XH4
XO3, H2X
27. Różnica między liczbą masową i atomową pierwiastka jest to:
liczba nukleonów w jądrze atomowym
liczba elektronów w atomie
liczba neutronów w jądrze atomowym
stopień utlenienia tego atomu
28. Jednostką masy atomowej (u) jest:
masa jednego atomu wodoru (1H)
masa jednego atomu węgla (12C)
1/12 masy jednego atomu wodoru (1H)
1/12 masy jednego atomu węgla (12C)
29. W poniższym schemacie, obrazującym grupy główne układu okresowego, strzałka opisuje:
I II III IV V VI VII
wzrost wymiarów atomów
zmniejszanie się elektroujemności pierwiastków
wzrost elektroujemności pierwiastków
wzrost charakteru metalicznego pierwiastków
30. Jaka (maksymalna) liczba elektronów może znajdować się w powłoce elektronowej o głównej liczbie kwantowej n = 3 ?
8
18
10
14
31. Które z następujących jonów i atomów: 19K+, 20Ca2+, 18Ar, 16S2, posiadają konfigurację elektronową K2 L8 M8 ?
wszystkie
tylko atom argonu i jony K+, Ca2+
tylko atom argonu i jon S2
tylko atom argonu
32. Z położenia azotu (7N) w układzie okresowym możesz wywnioskować, że atomy tego pierwiastka nie występują na:
+ 5 stopniu utlenienia
+ 7 stopniu utlenienia
+ 3 stopniu utlenienia
3 stopniu utlenienia
33. Jądro deuteru zbudowane jest z:
jednego protonu i dwóch neutronów
dwóch protonów i jednego neutronu
jednego protonu i jednego neutronu
jednego protonu i trzech neutronów
34. Decydujący wpływ na masę atomu mają:
tylko neutrony
tylko protony
tylko elektrony
tylko nukleony
35. Liczba 2 w zapisie 3p2 oznacza:
wartość głównej liczby kwantowej
liczbę orbitali typu p w atomie
liczbę elektronów na danej podpowłoce
wartość pobocznej liczby kwantowej
36. Wskaż błędne stwierdzenie dotyczące budowy atomów:
liczba elektronów i protonów w atomie jest taka sama
liczba nukleonów jest większa lub równa liczbie elektronów
liczba neutronów jest zawsze większa niż liczba nukleonów
różnica między liczbą masową i atomową jest liczbą neutronów w jądrze atomu
37. Liczba protonów w jądrze atomowym to nie jest:
liczba atomowa pierwiastka
liczba porządkowa pierwiastka
ładunek dodatni jądra
liczba masowa pierwiastka
38. Liczba elektronów w jonie ![]()
wynosi:
26
54
28
24
39. Atomy o identycznej liczbie atomowej i różnej liczbie masowej nazywa się:
izotonami
izobarami
izotopami
nuklidami
40. Pierwiastek, którego atomy mają konfigurację elektronową K2 L8 M11 N2 należy do:
czwartego okresu, piątej grupy głównej
piątego okresu, drugiej grupy głównej
czwartego okresu, drugiej grupy pobocznej
czwartego okresu, piątej grupy pobocznej
41. Poboczna liczba kwantowa elektronów walencyjnych pierwiastków I i II grupy głównej wynosi:
0
1
1 lub 2
na podstawie tych danych nie można jej jednoznacznie określić
42. Elektron walencyjny atomu 11Na opisany jest następującymi liczbami kwantowymi:
n = 3, l = 0, m = 0, s = +1/2
n = 2, l = 0, m = 0, s = +1/2
n = 3, l = 1, m = 0, s = −1/2
n = 3, l = 0, m = 1, s = −1/2
43. Suma mas atomowych atomów wchodzących w skład cząsteczki nazywa się:
liczbą masową
masą molową
molem
masą cząsteczkową
44. Prawidłową kolejność zapełniania powłok elektronami przedstawia zapis:
3p 4s 3d 4p
3p 3d 4s 4p
3p 4d 4s 4p
3p 4s 3d 4f
45. Elektrony podpowłoki d mogą charakteryzować się następującymi wartościami magnetycznej liczby kwantowej:
−3, −2, −1, 0, 1, 2, 3
−2, −1, 0, 1, 2
−1, 0, 1
wyłącznie +2
46. Jaka jest liczba atomowa dwudodatniego jonu, jeśli jego liczba masowa wynosi 63, zaś w jądrze występują 34 neutrony ?
27
31
29
61
47. Wskaż, w którym wierszu podano poprawną liczbę cząstek elementarnych w jonie
:
protony neutrony elektrony
24 28 24
24 52 21
24 28 21
28 24 24
48. Atom o konfiguracji elektronowej: K2 L8 M18 N9 O2 należy do:
piątego okresu, drugiej grupy głównej
piątego okresu, drugiej grupy pobocznej
drugiego okresu, piątej grupy pobocznej
piątego okresu, trzeciej grupy pobocznej
49. Aktywność chemiczna metali należących do danej grupy głównej rośnie ze wzrostem ich liczby atomowej. Wytłumaczysz to:
wzrostem odległości elektronów walencyjnych od jądra
wzrostem liczby elektronów walencyjnych
wzrostem liczby wszystkich cząstek elementarnych w atomie
wzrostem liczby nukleonów w jądrze atomowym
50. Ile gramów azotu zawiera tyle samo atomów co 64 g siarki ?
14 g
28 g
42 g
56 g
51. W jakiej masie czystego sodu znajduje się tyle samo atomów, co w 1 dm3 tlenu
w warunkach normalnych ?
2,05 g
1,05 g
0,5⋅1023
3,08 g
52. W ilu gramach siarki znajduje się tyle samo atomów, co w 11,2 g żelaza ?
3,2 g
6,4 g
12,8 g
5,4 g
53. Masa jednego atomu siarki wynosi:
32 g
32
5,3⋅10−26 kg
5,3⋅1023 kg
54. Ile procent cyny powinno znajdować się w jej stopie z miedzią, aby na każdy atom cyny przypadało pięć atomów miedzi ?
27,2 %
16,7 %
20,0 %
32,2 %
55. W ilu molach P2O3 zawarta jest taka sama liczba atomów tlenu, jak w 6 molach P2O5 ?
3
6
10
18
56. Liczba cząsteczek tlenu powstających podczas termicznego rozkładu jednego mola KMnO4 w reakcji: 2KMnO4 →K2MnO4 + MnO2 + O2 wynosi:
3,01⋅1023
12,04⋅1023
16,06⋅1023
24,08⋅1023
57. W reakcji magnezu z kwasem solnym otrzymano 1,204⋅1023 cząsteczek wodoru. Oblicz masę magnezu użytego w reakcji:
1,2 g
2,4 g
4,8 g
0,2 g
58. Jaką masę wyrażoną w gramach ma zbiór 3,01⋅1023 cząsteczek wody ?
0,5
9,0
18,0
27,0
59. 6,02⋅1023 cząsteczek chlorowodoru rozpuszczono w wodzie otrzymując 10 dm3 roztworu. Stężenie otrzymanego roztworu wyrażone w molach/dm3 wynosi:
0,05
0,01
1,00
0,10
60. Masa jednej cząsteczki HNO3 wynosi:
1,05⋅10−25 kg
1,05⋅1025 kg
0,063 kg
63 g
61. Oblicz, ile atomów węgla znajduje się w diamencie o masie 60 karatów
(1 karat = 0,2g):
1,2⋅1023
3,0⋅1023
6,0⋅1023
1,2⋅1024
62. Tlenek jednowartościowego pierwiastka o masie cząsteczkowej 94 u reaguje
z wodą dając związek, którego wodny roztwór barwi fenoloftaleinę na malinowo. Związkiem tym jest:
NaOH
KOH
LiOH
CuOH
63. Jaki wzór ma tlenek żelaza, jeśli jego 8 g zawiera 5,6 g żelaza ?
FeO
Fe3O4
Fe2O3
nie ma takiego tlenku
64. W pewnym związku azotu z tlenem stosunek masowy tlenu do azotu wynosi 4:7. Związek ten ma wzór:
N2O
NO
N2O3
NO2
65. W pewnym związku chloru z tlenem stosunek masowy chloru do tlenu wynosi 35,5:8. Związek ten ma wzór:
Cl2O
ClO2
ClO3
Cl2O7
66. Jaki jest procentowy udział cięższego izotopu w naturalnej miedzi o masie atomowej 63,54, składającej się z izotopów o liczbach masowych 63 i 65 ?
73%
51%
48%
27%
67. 23 g pewnego tlenku azotu zawiera 16 g tlenu. Tlenkiem tym jest:
N2O
NO
NO2
N2O3
68. Z 8 gramów siarki otrzymano 20 g tlenku. Stopień utlenienia siarki w tym tlenku wynosi:
+2
+4
+6
−4
69. Hemoglobina zawiera 0,33% żelaza. Oblicz jej masę molową, zakładając,
że jedna cząsteczka hemoglobiny zawiera 1 atom żelaza.
1,7 kg
17 kg
170 kg
170 g
70. Jaką objętość w warunkach normalnych zajmuje 10 kg chloru ?
3,15 m3
3,15 dm3
6,3 m3
6,3 dm3
71. Jaką objętość zajął CO2 wydzielony podczas termicznego rozkładu 10g CaCO3 ?
2,24 dm3
2,24 cm3
44,8 dm3
44,8 cm3
72. Jaką objętość zajmują w warunkach normalnych gazy potrzebne do syntezy
36 g wody ?
11,2 dm3
22,4 dm3
44,8 dm3
67,2 dm3
73. Masa wody otrzymanej w wyniku spalenia 224 cm3 wodoru
(odmierzonego w warunkach normalnych) wynosi:
180 g
36 g
0,18 g
0,02 g
74. Objętość wodoru wydzielonego w reakcji 34,5 g sodu z wodą, przeliczona
na warunki normalne, wynosi:
16,8 dm3
11,2 dm3
44,8 dm3
33,6 dm3
75. Na 200 g zanieczyszczonego cynku podziałano kwasem solnym. Wydzieliło się 66 dm3 gazowego wodoru. Jaki procent zanieczyszczeń zawierał cynk ?
5,75 %
42,5 %
4,25 %
0,425 %
76. Podczas spalania 5,0 g drutu stalowego w tlenie wytworzyło się 0,12 g dwutlenku węgla. Ile procent węgla zawierała ta stal ?
0,65 %
2,40 %
0,24 %
1,68 %
77. 0,6 grama stopu żelaza z węglem spalono w strumieniu tlenu, w wyniku czego powstało 33,6 cm3 dwutlenku węgla (warunki normalne). Próbka stopu zawierała:
1,8 % węgla
3,0 % węgla
11,0 % węgla
1,1 % węgla
78. Gęstość wodoru w warunkach normalnych wynosi około:
0,0893 g/dm3
0,0446 g/dm3
1,00 g/dm3
2,00 g/dm3
79. 1,0 kg tlenu zajmuje w warunkach normalnych objętość:
1,400 m3
0,140 m3
0,700 m3
0,070 m3
80. Jaką objętość amoniaku można maksymalnie otrzymać z 5 dm3 wodoru i 5 dm3 azotu mierzonych w tych samych warunkach ciśnienia i temperatury ?
3,33 dm3
5,00 dm3
10,00 dm3
6,66 dm3
81. W wyniku reakcji Ca z wodą otrzymano 100 dm3 wodoru (warunki normalne). Ile gramów Ca(OH)2 powstało w tej reakcji ?
100 g
74 g
330 g
33 g
82. Jaka objętość azotu może przereagować z 15 dm3 wodoru i jaką objętość w tych warunkach zajmie wytworzony amoniak ?
Vazotu Vamoniaku
5 dm3 5 dm3
10 dm3 10 dm3
5 dm3 10 dm3
10 dm3 20 dm3
83. Spalono 22,5 cm3 mieszaniny wodoru i tlenu. Po reakcji pozostało 5,7 cm3 tlenu. Jaki był skład początkowy mieszaniny ?
objętość wodoru objętość tlenu
11,25 cm3 11,25 cm3
16,8 cm3 5,7 cm3
11,2 cm3 11,3 cm3
11,3 cm3 11,2 cm3
84. Spalono 4 g siarki otrzymując dwutlenek siarki, którego objętość w warunkach normalnych wyniosła:
1,0 dm3
2,8 dm3
4,0 dm3
22,4 dm3
85. Przez płuczkę z wodnym roztworem Ca(OH)2 przepuszczono CO2. W płuczce wytrąciło się 25 g CaCO3. Jaką objętość w warunkach normalnych zajmował CO2 przed reakcją ?
22,4 dm3
5,6 dm3
1,0 dm3
25 dm3
3.2. Wiązania chemiczne
1. Wskaż grupę, w której wymieniono wyłącznie substancje zawierające wiązania kowalencyjne niespolaryzowane:
CS2, N2, Br2
H2, O2, H2O
KCl, LiF, NaBr
CH4, C2H6, C3H8
2. W cząsteczce kwasu ortofosforowego między atomami tlenu i fosforu występują:
trzy wiązania kowalencyjne i jedno jonowe
trzy wiązania kowalencyjne i jedno koordynacyjne
trzy wiązania koordynacyjne i jedno kowalencyjne
cztery wiązania jonowe
3. Wybierz grupę związków, w których występują wyłącznie wiązania jonowe:
NaCl, PbO, CO
KF, SO2, H2O
CaCl2, KBr, NaF
MgCl2, K2O, H2O
4. Wiązania koordynacyjne występują w:
NH4+
NH3
H3O+
jonach wymienionych w pkt. a i c
5. W K2CO3 występują wiązania:
wyłącznie kowalencyjne niespolaryzowane
wyłącznie kowalencyjne spolaryzowane
wyłącznie jonowe
kowalencyjne spolaryzowane oraz jonowe
6. W cząsteczce HNO3 liczba wiązań określanych jako koordynacyjne wynosi:
1
2
3
w tej cząsteczce nie występują wiązania koordynacyjne
7. Moment dipolowy cząsteczki N2 równy jest zero, ponieważ atomy azotu:
ulegają hybrydacji sp2
tworzą ze sobą jedno wiązanie typu σ (sigma) i dwa wiązania π (pi)
są mało aktywne chemicznie
mają jednakową elektroujemność
8. Wiązanie jonowe powstaje pomiędzy pierwiastkami:
o dużej różnicy elektroujemności
o małej różnicy elektroujemności
o identycznej elektroujemności
różnica elektroujemności nie ma wpływu na typ tworzonego wiązania chemicznego
9. Moment dipolowy różny od zera mają cząsteczki:
wody i amoniaku
wody i dwutlenku węgla
amoniaku i dwutlenku węgla
wszystkie odpowiedzi są poprawne
10. W cząsteczce wody występują wiązania:
kowalencyjne spolaryzowane w kierunku atomu tlenu
kowalencyjne spolaryzowane w kierunku atomu wodoru
jonowe
tylko wodorowe
11. Atomy tlenu, mogą tworzyć wiązania:
atomowe i jonowe
atomowe i atomowe spolaryzowane
atomowe spolaryzowane i koordynacyjne
wszystkie wymienione powyżej
12. Wiązania jonowe występują w następujących cząsteczkach:
NaCl, NH3, NaBr
KBr, MgCl2, H2O
CaCl2, KI, Na2O
NO2, CH4, KCl
13. Atomy wodoru tworzą wiązania:
atomowe
atomowe spolaryzowane
jonowe
wymienione w punktach a, b i c
14. Pierwiastki V grupy głównej układu okresowego mogą tworzyć wiązania:
jonowe
atomowe
atomowe spolaryzowane
wymienione w punktach b i c
15. W której z poniższych grup związków chemicznych występują jedynie wiązania atomowe spolaryzowane ?
BaCl2, HCl, Mg(OH)2
H2O, H2S, NH3
Na2S, HBr, K2O
AlCl3, MgO, CH4
16. Spośród związków oznaczonych cyframi od I do V
I: H2O II: CO2 III: CS2 IV: CCl4 V: NH3
moment dipolowy równy zero wykazują jedynie cząsteczki:
III i IV
II, III i IV
I i V
III, IV i V
17. Jeśli substancja po rozpuszczeniu w wodzie przewodzi prąd elektryczny,
to znaczy, że posiada:
wiązania jonowe
wiązania kowalencyjne niespolaryzowane
wiązania kowalencyjne spolaryzowane
wymienione w punkcie a i c
18. Cząsteczka CO2 ma moment dipolowy równy zero, ponieważ:
ma symetryczną strukturę liniową
atomy C i O połączone są wiązaniem atomowym
węgiel i tlen są niemetalami
słuszne są odpowiedzi b i c
19. W cząsteczce HNO3 nie występuje wiązanie:
koordynacyjne
jonowe
wodorowe
wymienione w punktach b i c
20. Ile elektronów bierze udział w wiązaniu atomów w cząsteczce X2, jeżeli atomy X mają konfigurację elektronową 1s2 2s2 2p3 ?
2
3
4
6
21. W której z poniższych grup, związki uszeregowano według rosnącej polarności wiązań chemicznych ?
Cl2, CCl4, NaCl, HCl
NaCl, HCl, CCl4, Cl2
HCl, Cl2, CCl4, NaCl
Cl2, CCl4, HCl, NaCl
22. W którym zestawie uszeregowano cząsteczki według wzrastającej krotności wiązań ?
N2, Cl2, O2
O2, I2, Br2
Br2, O2, N2
Cl2, N2, I2
23. Błędnie narysowany jest tylko wzór: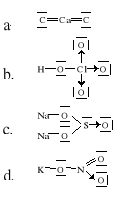
24. We wzorze: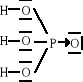
atom fosforu występuje na stopniu utlenienia:
+5
−5
+4
+3
25. W cząsteczce kwasu ![]()
liczba wolnych par elektronowych atomu azotu wynosi:
4
5
3
1
3.3. Roztwory i ich stężenia
1. Wymiary cząsteczek substancji rozpuszczonej w roztworze rzeczywistym są rzędu:
10−5÷10−4cm
10−7÷10−5cm
10−8÷10−7cm
10−8÷10−4cm
2. Roztwór o rozdrobnieniu koloidalnym, w którym zarówno faza rozpraszająca,
jak też rozproszona jest cieczą, nazywa się:
zolem
żelem
koloidem hydrofilowym
emulsją
3. Cząstki koloidalne mają wymiar większy od cząsteczek rozpuszczalnika około:
2÷3 razy
5÷10 razy
10÷1000 razy
1000÷100000 razy
4. Roztwór jest mieszaniną jednorodną występującą w stanie skupienia:
stałym
ciekłym
gazowym
wszystkich wymienionych uprzednio
5. Wodny roztwór skrobi jest układem koloidalnym, w którym fazą rozproszoną i ośrodkiem dyspersyjnym są:
faza rozproszona ośrodek dyspersyjny
ciecz ciecz
ciało stałe gaz
gaz ciecz
ciało stałe ciecz
6. Jeśli ogrzejemy wodny roztwór NaCl, to jego:
stężenie molowe wzrośnie, a procentowe zmaleje
stężenie molowe zmaleje, a procentowe nie zmieni się
stężenie procentowe wzrośnie, a molowe zmaleje
ogrzewanie nie wpływa na zmianę stężeń
7. Ile kg NaCl należy wsypać do 10 kg wody, aby otrzymany roztwór miał
stężenie 10 % ?
1 kg
10 kg
0,11 kg
1,11 kg
8. Ile gramów wody należy odparować ze 150 g 20 % roztworu soli, aby otrzymać roztwór o stężeniu 30 % ?
10 g
30 g
50 g
100 g
9. Do 120 g 15% roztworu NaOH dodano 30 g wody. Stężenie procentowe otrzymanego roztworu wynosi:
18 %
10 %
12 %
8 %
10. Ile gramów wody należy dodać do 750 g 10% roztworu kwasu octowego, aby otrzymać roztwór 6 % ?
250 g
500 g
750 g
1000 g
11. Przez odparowanie 100 g rozpuszczalnika z 300 g 20 % roztworu otrzymano roztwór:
10 %
30 %
40 %
50 %
12. Ile cm3 wody (d = 1,0 g/cm3) należy dodać do 200 g 20 % roztworu,
aby uzyskać roztwór o stężeniu 8 % ?
500 cm3
20 cm3
100 cm3
300 cm3
13. Ile gramów wody należy dodać do 80 cm3 kwasu solnego o gęstości 1,049 g/cm3 i stężeniu procentowym 10 %, aby otrzymać kwas o stężeniu 3 % ?
200 g
280 g
84 g
196 g
14. W ilu gramach 12 % roztworu KNO3 znajduje się 72 g tej soli ?
300 g
450 g
600 g
750 g
15. Ile gramów wody należy dodać do 120 g cukru, aby otrzymać roztwór 6 % ?
1880 g
2000 g
180 g
200 g
16. Ile kg soli trzeba wsypać do 20 dm3 wody, by otrzymać roztwór
o stężeniu 20 % ?
4,0 kg
5,0 kg
2,5 kg
2,0 kg
17. Jaką objętość chlorowodoru (warunki normalne) należy rozpuścić w 100 g wody, aby otrzymać 5 % kwas solny ?
3,07 dm3
3,23 dm3
3,32 dm3
5,00 dm3
18. Stężenie procentowe roztworu wodorotlenku sodu, który otrzymano w reakcji 23 g sodu z 200 cm3 wody, wynosi w przybliżeniu:
15 %
25 %
18 %
10 %
19. W jakim stosunku masowym należy zmieszać 30 % roztwór kwasu siarkowego z 5 % roztworem, aby uzyskany roztwór miał stężenie 20 % ?
3:2
2:3
1:2
1:4
20. Zmieszano 100 g 3 % roztworu fruktozy z 50 g 12 % roztworu tego cukru. Otrzymano roztwór o stężeniu:
4 %
5 %
6 %
7 %
21. 1 dm3 wody nasycono trójtlenkiem siarki. Masa otrzymanego roztworu wynosiła 1180 g. Oblicz stężenie procentowe roztworu kwasu siarkowego.
15,25 %
1,53 %
18,69 %
1,87 %
22. Ile gramów wody należy dodać do 240 g roztworu NaCl o stężeniu 10 %,
aby otrzymać roztwór 6 % ?
60 g
160 g
400 g
144 g
23. Rozpuszczono 4 g trójtlenku siarki w 46 g wody. Stężenie procentowe otrzymanego roztworu kwasu siarkowego wynosi około:
8 %
10 %
12 %
15 %
24. W jakim stosunku wagowym należy zmieszać 50 % roztwór NaOH z roztworem 10 %, aby otrzymany roztwór miał stężenie 25 % ?
3:2
2:3
5:3
3:5
25. Ile gramów wody należy odparować z 250 g 20 % roztworu soli, aby otrzymać roztwór o stężeniu 25 % ?
5 g
200 g
50 g
100 g
26. Stężenie procentowe roztworu kwasu ortofosforowego, który otrzymano
w wyniku reakcji 28,4 g pięciotlenku fosforu z 171,6 g H2O wynosi około:
10 %
14 %
20 %
25 %
27. Do jakiej objętości wody należy dodać 150 g 30 % roztworu glukozy,
aby otrzymać roztwór o stężeniu 4 % ?
795 cm3
97,5 cm3
975 cm3
9,75 cm3
28. Stężenie nasyconego roztworu pewnej soli wynosi 20 %. Rozpuszczalność tej soli wynosi:
20 g/ 100 g H2O
25 g/ 100 g H2O
16,6 g/ 100 g H2O
22,5 g/ 100 g H2O
29. Zmieszano 150 g 18 % roztworu wodorotlenku sodu i 350 g wody. Otrzymany roztwór ma stężenie:
2,6%
27%
2,7%
5,4%
30. Ile gramów 45% roztworu kwasu azotowego należy dodać do 150 g 20% roztworu tego kwasu, aby otrzymać roztwór o stężeniu 30% ?
150 g
100 g
200 g
175 g
31. Wskaż, w jakim stosunku masowym zmieszano 60% roztwór pewnej substancji z wodą, jeśli uzyskano roztwór o stężeniu 7,5%.
15 : 120
7 : 1
1 : 7
7,5 : 60
32. Do 250 g 18% wodnego roztworu azotanu cynku dodano 110 g wody. Stężenie otrzymanego roztworu wynosi:
18%
12,5%
15%
11,5%
33. Ile gramów MgCl2 należy zużyć w celu przygotowania 200 cm3 roztworu
o stężeniu 0,1 mol/dm3 ?
1,9 g
9,5 g
3,2 g
0,19 g
34. Ile gramów Na2CO3 należy odważyć w celu przygotowania 250 cm3
0,2 molowego roztworu ?
5,30 g
21,25 g
13,80 g
10,70 g
35. 20 g KCl rozpuszczono w 80 gramach wody uzyskując roztwór o gęstości
1,02 g/cm3. Jakie jest jego stężenie molowe ?
3,60 mol/dm3
2,73 mol/dm3
0,36 mol/dm3
0,27 mol/dm3
36. Do 200 cm3 0,5 molowego roztworu HCl dodano 300 cm3 wody. Oblicz stężenie molowe powstałego roztworu:
1,0 mol/dm3
0,1 mol/dm3
0,2 mol/dm3
2,0 mol/dm3
37. 1,7 g AgNO3 rozpuszczono w wodzie, uzyskując 200 cm3 roztworu, którego stężenie molowe wynosi:
0,05 mol/dm3
0,1 mol/dm3
0,25 mol/dm3
1 mol/dm3
38. Stężenie procentowe 2,0 molowego roztworu kwasu siarkowego o gęstości
1,12 g/cm3 wynosi:
17,5%
18,5%
11,2%
20,0%
39. Stężenie molowe 20% roztworu K2S o gęstości 1,10 g/cm3 wynosi:
1,0 mol/dm3
2,0 mol/dm3
3,0 mol/dm3
4,0 mol/dm3
40. Jakie jest stężenie molowe 40% zasady sodowej, jeśli jej gęstość wynosi 1,40 g/cm3 ?
14 mol/dm3
1,4 mol/dm3
10 mol/dm3
1,0 mol/dm3
41. Ile cm3 40% roztworu KOH o gęstości 1,4 g/cm3 trzeba rozcieńczyć wodą
w celu przygotowania 3 dm3 zasady potasowej o stężeniu 0,2 mol/dm3 ?
8,48 cm3
84,0 cm3
6,0 cm3
60,0 cm3
42. Stężenie molowe roztworu otrzymanego przez zmieszanie 100 cm3 96% roztworu H2SO4 (d = 1,84 g/cm3) i 900 cm3 wody wynosi około:
1,80 mol/dm3
0,18 mol/dm3
3,60 mol/dm3
0,36 mol/dm3
43. Ile cm3 roztworu KOH o gęstości 1,40 g/cm3 i stężeniu 40% należy rozcieńczyć wodą, celem przygotowania 8 dm3 zasady o stężeniu 0,50 mol/dm3 ?
400
40
4
4000
44. 20 cm3 roztworu NaOH o stężeniu 45% i gęstości 1,48 g/cm3 rozcieńczono wodą do objętości 250 cm3. Stężenie molowe otrzymanego roztworu wynosi:
1,50 mol/dm3
1,80 mol/dm3
1,35 mol/dm3
2,40 mol/dm3
45. Stężenie molowe roztworu kwasu azotowego o gęstości 1,18 g/cm3, zawierającego 30% masowych czystego składnika, wynosi około:
11,2 mol/dm3
5,6 mol/dm3
2,8 mol/dm3
1,12 mol/dm3
46. Gęstość 10% roztworu kwasu siarkowego o stężeniu 1,2 mol/dm3 wynosi:
1,00 kg/dm3
1,12 kg/dm3
1,18 kg/dm3
1,06 kg/dm3
47. Do trzech kolbek zawierających po 100 cm3 roztworu HCl o stężeniu 2,0 mol/dm3 wrzucono po 1 gramie magnezu, żelaza i miedzi. Najwięcej wodoru otrzymano z roztworu do którego wrzucono:
magnez
żelazo
miedź
we wszystkich przypadkach otrzymano te same ilości wodoru
48. Z 300 cm3 0,2 molowego roztworu NaCl odparowano 100 g wody. Stężenie molowe otrzymanego roztworu wynosi:
0,1 mol/dm3
0,4 mol/dm3
0,2 mol/dm3
0,3 mol/dm3
49. Zmieszano 20 cm3 0,1 molowego roztworu HNO3 z 30 cm3 0,1 molowej zasady sodowej. Stężenie molowe roztworu NaOH wynosi:
0,02 mol/dm3
0,10 mol/dm3
0,15 mol/dm3
0,20 mol/dm3
50. Jaką objętość 0,2 molowego kwasu solnego należy zużyć na przygotowanie 400 cm3 0,05 molowego roztworu ?
300 cm3
200 cm3
100 cm3
50 cm3
3.4. Reakcje w roztworach elektrolitów
1. Dysocjacja elektrolityczna to:
rozpad cząsteczek na jony pod wpływem prądu elektrycznego
rozpad cząsteczek na jony pod wpływem rozpuszczalnika
reakcja jonów elektrolitu z wodą
reakcja cząsteczek elektrolitu z wodą
2. Stopień dysocjacji jest bliski 100% w wodnych, rozcieńczonych roztworach:
NaOH i Na2SO4
NH4OH i KCl
BaCl2 i Mg(OH)2
HCl i H3PO4
3. W roztworze kwasu siarkawego znajdują się praktycznie tylko następujące jony:
H+, HSO3−, SO32−
H+, SO32−,
H+, SO32−, SO42−
H+, HSO3−
4. W którym z poniższych punktów zamieszczono jedynie mocne kwasy ?
HCl, H2SO4, HClO4
H2SO3, HNO3, HClO4
HNO2, H2SO4, HCl
H2S, HNO3, H2CO3
5. W 0,1 molowym roztworze wodnym H3PO4 oprócz jonów wodorowych najwięcej jest wolnych jonów:
H2PO4−
HPO42−
PO43−
HPO42− i PO43−
6. W wyniku reakcji dysocjacji elektrolitycznej pewnej substancji powstały jony: NH4+ i NO2−. Substancją tą był:
azotan amonu
azotyn amonu
azotek amonu
amoniak
7. Zgodnie z teorią Br*nsteda:
zasady są donorami grup hydroksylowych
zasady są akceptorami protonów
kwasy są donorami grup hydroksylowych
kwasy są akceptorami protonów
8. Które z poniższych cząsteczek i jonów, zgodnie z teorią Br*nsteda, mogą być kwasami ?
H2SO4, HSO4−, SO42−
H2O, HCl, NH4+
H2CO3, Cl−, H2S
H2SO4, HSO4−, OH−
9. W którym z poniższych zestawów oba związki chemiczne mogą być zasadami zgodnie z teorią Br*nsteda, a nie spełniają teorii Arrheniusa ?
NaOH, Ba(OH)2
NH3, CO32−
Al(OH)3, HCO3−
H2O, NaOH
10. Woda destylowana powoduje dysocjację elektrolitów na jony ponieważ:
jest dobrym elektrolitem
jest zbudowana z cząsteczek liniowo symetrycznych
posiada jednakowe stężenie jonów H+ i OH−
jej cząsteczki mają duży moment dipolowy
11. Które z wymienionych poniżej związków chemicznych, w swych
0,02 molowych roztworach wodnych, mają zbliżone stopnie dysocjacji ?
HNO3, HNO2
HCl, NaOH
NH4OH, KOH
HClO4, NH4OH
12. W wyniku reakcji dysocjacji azotynu wapnia powstają:
kwas azotawy i wodorotlenek wapnia
aniony wapnia i kationy azotynowe
kationy wapnia i aniony azotanowe
kationy wapnia i aniony azotynowe
13. W roztworze wodnym siarczanu potasu zachodzą następujące procesy:
dysocjacji elektrolitycznej
hydrolizy
hydratacji jonów
wymienione w punktach a i c
14. Po wsypaniu azotanu amonu do wody przebiegają następujące procesy:
rozpuszczanie soli i hydratacja dipolami wody
obojętnych cząsteczek solidysocjacja elektrolityczna
elektroliza
dysocjacja, hydroliza i hydratacja powstałych jonów
15. Cyjanek potasu po rozpuszczeniu w wodzie ulega procesom:
dysocjacji elektrolitycznej
solwatacji
hydrolizy
wszystkim wyżej wymienionym
16. Wskaż grupę elektrolitów, w której uszeregowano je według rosnącej mocy:
CH3COOH, H3PO4, HCl
HCl, H2SO4, HNO2
HCOOH, CH3COOH, C2H5COOH
HCl, HNO2, HNO3
17. W wyniku reakcji dysocjacji elektrolitycznej siarczku amonu powstają:
aniony amonowe i kationy siarczkowe
kationy amonowe i aniony siarczanowe
amoniak i siarkowodór
kationy amonowe i aniony siarczkowe
18. W której grupie elektrolity ustawiono zgodnie z malejącą wartością stopnia dysocjacji (zakładając, że ich stężenia molowe są jednakowe) ?
NH3, Ca(OH)2, KOH
CH3COOH, HCOOH, C15H31COOH
LiOH, NaOH, KOH
HClO4, H2SO3, H2S
19. Do wodnego roztworu słabego elektrolitu dodano wodę. Stwierdzono:
brak jakichkolwiek zmian
obniżenie stopnia dysocjacji
wzrost stopnia dysocjacji
wzrost gęstości roztworu
20. Kwasem, w myśl teorii Br*nsteda nazywamy substancję, która:
może przyłączać protony
może oddawać protony
może przyłączać elektrony
może oddawać elektrony
21. Zasadą, według teorii Br*nsteda, nazywamy substancję, która:
w procesie dysocjacji tworzy jony OH−
przyjmuje protony
oddaje pary elektronowe
ma odczyn zasadowy
22. W roztworze wodnym H2S znajduje się:
dwa razy więcej jonów H+ niż jonów S2−
tyle samo jonów H+ co łącznie jonów HS− i S2−
tyle samo jonów H+ co jonów S2−
więcej jonów H+ niż łącznie jonów HS− i S2−
23. Sprzężoną parę kwas-zasada (według teorii Br*nsteda) przedstawiają:
H2S i HS−
NH4+ i NH3
HPO42− i PO43−
wszystkie pary
24. Teoria Arrheniusa ma ograniczoną przydatność dla wyjaśnienia właściwości zasadowych:
NaOH
Zn(OH)2
Fe(OH)3
CH3NH2
25. Które z poniżej podanych równań reakcji ilustruje donorowo-akceptorową
teorię Br*nsteda ?
H2SO4 ↔ 2H+ + SO42−
KOH → K+ + OH−
HS− + OH− ↔ H2O + S2−
AgCl + 2NH3 → [Ag(NH3)2]Cl
26. Która z wymienionych substancji, wg teorii Br*nsteda,
jest kwasem anionowym ?
HClO4
ClO4−
HSO4−
SO42−
27. Która z wymienionych substancji może występować zarówno jako kwas i jako zasada Br*nsteda ?
SO42−
H3O+
NH4+
HPO42−
28. Opierając się na teorii Br*nsteda wybierz odpowiedź fałszywą:
kation H3O+ jest kwasem
cząsteczka NH3 jest zasadą
kation NH4+ jest zasadą
cząsteczka H2O może być kwasem i zasadą
29. Która z wymienionych substancji jest wg teorii Br*nsteda kwasem
kationowym ?
H2PO4−
H+
NH4+
substancje wymienione w punkcie b i c
30. Wskaż, w których z podanych reakcji woda zachowuje się jak kwas, a w których jak zasada:
I H2O + HS− ↔ H3O+ + S2−
II H2O + NH3 ↔ NH4+ + OH−
III CO32− + H2O ↔ HCO3− + OH−
kwas zasada
I, II III
III I, II
II, III I
I II, III
31. Wodny roztwór CO2 oraz wodny roztwór NH3 słabo przewodzą prąd elektryczny. Jak zmieni się przewodnictwo po zmieszaniu tych roztworów ?
zmaleje
wzrośnie
nie zmieni się
bardzo zmaleje
32. W roztworze o objętości 1 dm3 znajduje się 1,5 mola cząsteczek HNO2, 0,5 mola jonów azotynowych i 0,5 mola jonów wodorowych. Jaki jest stopień dysocjacji kwasu azotawego w tym roztworze ?
25%
33%
67%
50%
33. Roztwór kwasu o wzorze HR zawiera 0,20 mola jonów R− i 2,0 mola niezdysocjowanych cząsteczek HR. Stopień dysocjacji elektrolitycznej tego kwasu wynosi:
0,091
0,1
0,182
0,2
34. Stopień dysocjacji 1,00 molowego wodnego roztworu kwasu typu HR,
którego pH = 3,00 wynosi:
0,1%
0,3%
1,0%
3,0%
35. pH 0,02 molowego roztworu HNO2, zdysocjowanego w 5% (α = 0,05) wynosi:
2,0
3,0
0,02
2,5
36. Jakie jest pH 0,05 molowego roztworu Ca(OH)2, jeśli α = 1 ?
13
1
−lg(0,05)
14 − lg(0,05)
37. 2,24 dm3 gazowego HCl (warunki normalne) rozpuszczono w wodzie uzyskując 1 dm3 roztworu. Jego pH wynosi:
1,00
2,24
2,00
1,12
38. Jakie jest pH roztworu NaOH o stężeniu 0,001 mol/dm3 ?
3
1
14
11
39. Wskaż, który z elektrolitów posiada największą wartość stopnia dysocjacji elektrolitycznej α:
1% roztwór wodny CH3COOH
10% roztwór wodny CH3COOH
1% roztwór wodny HNO3
10% roztwór wodny HNO3
40. W jakiej objętości 2 molowego roztworu NaCl znajduje się tyle samo jonów chlorkowych, co w 100 cm3 0,5 molowego roztworu BaCl2 ?
400 cm3
100 cm3
50 cm3
25 cm3
41. Jakie jest pH roztworu wodnego NH3 o stężeniu 1⋅10−3 mol/dm3, jeśli stopień dysocjacji elektrolitycznej α wynosi 10% ?
8
10
11
12
42. Produktem reakcji dwóch moli HCl z jednym molem Al(OH)3 jest:
chlorek glinu
glinian chloru
wodorochlorek glinu
chlorek hydroksoglinu
43. Zmieszano jednakowe objętości 0,1 molowego roztworu H2SO4 i 0,1 molowego roztworu KOH. Otrzymano roztwór:
wodorosiarczanu potasu
siarczanu potasu
hydroksosiarczanu potasu
mieszaninę wyżej wymienionych soli
44. Zmieszano jednakowe objętości 0,01 molowego roztworu zasady wapniowej
i 0,01 molowego roztworu kwasu azotowego. Jaki odczyn wykazuje otrzymany roztwór ?
obojętny, ponieważ zmieszano jednakowe objętości mocnego kwasu
i mocnej zasadykwaśny, ponieważ kwas azotowy jest mocniejszy od zasady wapniowej
obojętny, ponieważ azotan wapnia nie ulega hydrolizie
zasadowy, ponieważ część jonów wodorotlenowych nie ulega reakcji
45. Zmieszano 20 cm3 roztworu zasady sodowej o stężeniu 1,0 mol/dm3 z 20 cm3 roztworu kwasu siarkowego o takim samym stężeniu. Jaki będzie odczyn powstałego roztworu ?
obojętny
zasadowy
kwaśny
wyżej wymienione substancje nie przereagują
46. Do roztworu zawierającego 1 mol H3PO4 wprowadzono 22,4 dm3 amoniaku
w warunkach normalnych. W wyniku reakcji powstała sól o wzorze:
NH4H2PO4
(NH4)2HPO4
(NH4)3PO4
(NH3)2HPO4
47. Aby zobojętnić roztwór, którego pH = 10 należy do niego dodać roztworu:
zasady
kwasu
chlorku sodu
węglanu sodu
48. Zmieszano roztwory zawierające po 0,1 mola
I NaOH i HCl II NaOH i CH3COOH
III KOH i HNO3 IV Ba(OH)2 i H2SO4
Roztwór o odczynie obojętnym otrzymano:
we wszystkich przypadkach
w przypadku I, III i IV
tylko w przypadku II
w żadnym przypadku nie otrzymano roztworu o odczynie obojętnym
49. Do roztworu zawierającego 1 mol HCl wprowadzono:
I: roztwór zawierający 1 mol AgNO3
II: roztwór zawierający 1 mol NaOH
III: 22,4 dm3 gazowego NH3 (warunki normalne)
Roztwór o pH = 7 otrzymano:
w przypadku III
w przypadku II
w przypadku I i II
we wszystkich przypadkach
50. Ile gramów KOH zawiera 200 cm3 jego roztworu, jeśli na zobojętnienie 20 cm3 tego roztworu zużyto 15 cm3 0,01 molowego roztworu H2SO4 ?
0,168 g
0,0168 g
0,084 g
0,840 g
51. Ile gramów NaOH, zawierała próbka technicznego wodorotlenku sodu, jeśli po jej rozpuszczeniu w wodzie, do zobojętnienia powstałego roztworu zużyto 18,0 cm3 1 molowego roztworu HNO3 ?
0,72 g
0,072 g
1,44 g
0,144 g
52. W jakim stosunku objętościowym należy zmieszać 2,0 molowy roztwór HCl
z 1,5 molowym roztworem wodorotlenku wapnia, aby otrzymać roztwór obojętny ?
2 : 3
1 : 2
2 : 1
3 : 2
53. Jaką objętość 0,1 molowego roztworu kwasu siarkowego należy zużyć
na zobojętnienie roztworu zawierającego 0,2 g NaOH ?
25,0 cm3
12,5 cm3
50,0 cm3
2,5 cm3
54. Ile cm3 0,30 molowego roztworu KOH potrzeba do zobojętnienia 100 cm3 0,15 molowego roztworu H3PO4 ?
150 cm3
45 cm3
200 cm3
50 cm3
55. Na zobojętnienie 25 cm3 roztworu kwasu ortofosforowego zużyto 30 cm3
0,05 molowego roztworu zasady sodowej. Jakie było stężenie molowe kwasu ?
0,01 mol/dm3
0,02 mol/dm3
0,06 mol/dm3
0,03 mol/dm3
56. Na zobojętnienie 25 cm3 roztworu NaOH o stężeniu 0,132 mol/dm3 zużyto
27 cm3 roztworu kwasu solnego. Jego stężenie wynosiło:
0,0122 mol/dm3
0,244 mol/dm3
0,132 mol/dm3
0,122 mol/dm3
57. Ile dm3 wodoru (warunki normalne) otrzymano w reakcji potasu z wodą, jeżeli na zobojętnienie powstałego wodorotlenku potasu zużyto 0,49 g czystego H2SO4 ?
0,112 dm3
1,12 dm3
0,0122 dm3
11,2 dm3
58. Na zobojętnienie 20 cm3 dwuprotonowego kwasu nieorganicznego o stężeniu 0,20 mol/dm3 zużyto 10 cm3 roztworu NaOH. Ile gramów NaOH zawiera
50 cm3 roztworu zasady ?
1,60 g
3,20 g
0,16 g
0,32 g
59. W jakim stosunku objętościowym należy zmieszać 2 molowy roztwór kwasu siarkowego z 1,5 molowym roztworem KOH aby otrzymać roztwór obojętny ?
2 : 3
3 : 8
2 : 1,5
1,5 : 2
60. Na zobojętnienie 25 cm3 roztworu KOH zużyto 50 cm3 0,10 molowego roztworu H2SO4. W 1 dm3 tego roztworu rozpuszczone jest:
11,2 g KOH
22,4 g KOH
5,6 g KOH
16,8 g KOH
61. Ile cm3 wodnego roztworu HNO3 o pH = 2,00 zobojętnia całkowicie
1 cm3 roztworu NaOH o pH = 13,00 ?
1 cm3
10 cm3
100 cm3
50 cm3
62. Jaką objętość chlorowodoru (warunki normalne) należy wprowadzić do 500 cm3 roztworu KOH o pH = 13, aby końcowy roztwór miał pH = 7 ?
11,2 dm3
1,12 dm3
2,24 dm3
22,4 dm3
63. W wyniku reakcji potasu z wodą otrzymano, w warunkach normalnych,
2,24 dm3 wodoru. Oblicz masę kwasu siarkowego potrzebnego
do zobojętnienia powstałej zasady.
0,49 g
9,80 g
19,60 g
0,98 g
64. Ile gramów 10% roztworu KOH zobojętnia 100 cm3 roztworu H2SO4 o stężeniu 0,25 mol/dm3 ?
0,28 g
1,4 g
14 g
28 g
65. Hydroliza to:
rozpad cząsteczek na jony pod wpływem prądu elektrycznego
rozpad cząsteczek na jony pod wpływem rozpuszczalnika
reakcja jonów soli z wodą
reakcja cząsteczek soli z wodą
66. Wskaż zestaw, w którym wszystkie wymienione sole ulegają reakcji hydrolizy:
NaNO2, CH3COOK, KCl
K2S, FeCl2, NH4Cl
NaCl, KCl, CaCl2
Zn(NO3)2, K2SO4, FeCl3
67. W którym zestawie wszystkie sole ulegają hydrolizie ?
siarczan sodu, nadchloran amonu, octan potasu
azotan miedzi II, chlorek sodu, siarczek potasu
siarczan żelaza III, węglan sodu, octan potasu
octan amonu, azotan baru, nadchloran wapnia
68. Jedną z poniższych soli rozpuszczono w wodzie z dodatkiem fenoloftaleiny. Fenoloftaleina zabarwiała się na malinowo. Wskaż sól, którą rozpuszczono:
KCl
Na2CO3
NH4Cl
Zn(NO2)2
69. Reakcji hydrolizy będą ulegały następujące sole:
Na2CO3, NaNO3
K2SO4, Ag2S
NH4Cl, K2CO3
AlCl3, KCl
70. Która z reakcji nie przebiegnie ?
K2SO3 + H2O →
NaNO3 + H2O →
NH4Cl + H2O →
Mg(NO2)2 + H2O →
71. W czterech probówkach znajdowały się wodne roztwory: I - NH3, II - Na2CO3, III - NaCl, IV - (NH4)2SO4. W których roztworach pH było powyżej 7 ?
II i III
I i II
II i IV
III i IV
72. Jedna z grup niżej podanych soli po rozpuszczeniu w wodzie ulega reakcji hydrolizy tworząc roztwory o odczynie zasadowym. Wskaż tę grupę:
siarczan sodu, chlorek wapnia
siarczan sodu, azotan potasu
siarczek potasu, octan sodu
siarczyn amonu, siarczan amonu
73. Wybierz grupę soli, których roztwory wodne wykazują odczyn kwaśny:
KCl, FeCl3
NH4NO3, (NH4)2S
(NH4)2SO4, Zn(NO3)2
K2CO3, CH3COONa
74. Odczyn wodnego roztworu azotanu potasu jest:
obojętny
kwaśny
zasadowy
amfoteryczny
75. W roztworze wodnym siarczynu sodu mogą zachodzić procesy:
hydrolizy
dysocjacji elektrolitycznej
hydratacji
wymienione w punktach a, b i c
76. Zmieszano roztwory zawierające po jednym molu:
I - NaOH i HNO3
II - NaOH i CH3COOH
III - NaOH i H2SO4
IV - Ca(OH)2 i HCl
Roztwór o odczynie zasadowym otrzymano w wariancie:
II i III
III i IV
II i IV
I i III
77. W wodnym roztworze pewnej soli stwierdzono obecność kationów potasu
i anionów azotynowych. Roztwór ten miał odczyn słabo zasadowy. Solą tą był:
zasadowy azotyn potasu
azotyn potasu
azotyn hydroksopotasu
wszystkie wyżej wymienione odpowiedzi są poprawne
78. Wskaż grupę, w której wszystkie sole ulegają reakcji hydrolizy:
siarczek amonu, azotan potasu, siarczyn sodu
azotyn potasu, siarczan sodu, siarczek potasu
azotan amonu, azotyn wapnia, siarczyn potasu
siarczek amonu, azotyn sodu, siarczan potasu
79. Odczyn kwaśny mają wodne roztwory:
wodorowęglanu potasu
wodorosiarczynu sodu
siarczanu amonu
wszystkie wyżej wymienione
80. Odczyn wodnego roztworu siarczynu sodu jest:
obojętny
zasadowy
kwaśny
amfoteryczny
81. Najwyższą wartość pH wykazuje wodny roztwór:
Na2CO3
Cu(OH)Cl
K2SO4
KNO3
82. Badano doświadczalnie reakcję hydrolizy czterech soli. Wyniki obserwacji zapisano w tabelce. Wskaż, w którym przypadku popełniono błąd:
|
sól |
rodzaj hydrolizy |
odczyn roztworu |
a. |
Na2CO3 |
anionowa |
zasadowy |
b. |
Na2S |
anionowa |
zasadowy |
c. |
Al2(SO4)3 |
kationowa |
zasadowy |
d. |
NH4Cl |
kationowa |
kwaśny |
83. W czterech probówkach znajdują się roztwory następujących soli: I - Ca(NO3)2,
II - NaCl, III - BaCl2, IV - K2CO3. Trudno rozpuszczalny związek powstaje
po zmieszaniu roztworów:
I z II
II z III
I z IV
II z IV
84. Trudno rozpuszczalny siarczek można otrzymać w wyniku reakcji kwasu siarkowodorowego z:
NaOH
KCl
(NH4)2SO4
Pb(NO3)2
85. W kolejnych probówkach znajdują się roztwory następujących soli: I - AgNO3, II - CuSO4, III - Na2S, IV - CaCl2. Do każdej z nich dodano po kilka kropli siarczanu potasu. Trudno rozpuszczalny związek powstał w probówce:
I i III
I i IV
III i IV
II i III
86. Który z poniższych związków utworzy trudno rozpuszczalne sole zarówno
w roztworze zawierającym Pb(NO3)2 jak i Na2S ?
MgCl2
K2SO4
FeCl2
(NH4)2CO3
87. Do czterech probówek zawierających roztwory: I - Ba(NO3)2, II - AgNO3,
III - CuCl2, IV - AlCl3 dodano nadmiar H2SO4. Trudno rozpuszczalne osady powstały w probówkach:
I i III
II i IV
I i II
I i IV
88. W którym z poniższych zestawów, wszystkie wymienione kationy tworzą trudno rozpuszczalne wodorotlenki ?
Mg2+, Ca2+, Cu2+
NH4+, Fe3+, Fe2+
Mn2+, K+, Al3+
Ag+, Zn2+, Na+
89. Trudno rozpuszczalny związek można otrzymać w wyniku reakcji niektórych:
kwasów z zasadami
soli z solami
kwasów lub zasad z solami
wszystkie odpowiedzi są poprawne
90. Najwięcej trudno rozpuszczalnych związków można otrzymać mając
do dyspozycji wodne roztwory:
Pb(NO3)2, AgNO3, KCl
AgNO3, CaCl2, Na2CO3
Na2S, Ba(NO3)2, K2CO3
Mg(NO3)2, NaCl, ZnCl2
91. Ile (maksymalnie) trudno rozpuszczalnych związków można otrzymać mając
do dyspozycji wodne roztwory BaCl2, (NH4)2SO4, AgNO3 i K2CO3 ?
3
4
5
6
92. Do czterech probówek zawierających jednakowe objętości równomolowych roztworów dodano nadmiar roztworu NaOH. Osad o największej masie otrzymano w probówce zawierającej:
CuSO4
MgCl2
FeCl3
Al2(SO4)3
93. Trudno rozpuszczalny osad można uzyskać w wyniku reakcji:
BaCl2 + HNO3 →
Ca(NO3)2 + NaCl →
AgNO3 + K2S →
Al2(SO4)3 + NaOHnadmiar →
94. Zmieszano równomolowe roztwory różnych soli. Trudno rozpuszczalny osad powstał w wyniku reakcji:
NaCl z Mg(NO3)2
CaCl2 z Na2SO4
Al2(SO4)3 z KCl
(NH4)2SO3 z Zn(NO3)2
95. Do 50 cm3 roztworu kwasu szczawiowego dodawano, do momentu zakończenia wytrącania się osadu, roztwór CaCl2. Osad przemyto i wysuszono. Masa otrzymanego osadu wynosiła 5,12 g. Stężenie roztworu kwasu szczawiowego wynosiło:
4 mol/dm3
0,4 mol/dm3
0,8 mol/dm3
8 mol/dm3
96. Zmieszano 20 cm3 0,1 molowego roztworu BaCl2 z nadmiarem kwasu siarkowego. Oblicz masę powstałego BaSO4.
0,466 g
0,932 g
2,330 g
0,233 g
97. Do roztworu zawierającego 0,1 mola AgNO3 dodano 25 cm3 10% roztworu HCl o gęstości 1,05 g/cm3. Jaka jest masa powstałego osadu ?
2,16 g
12,6 g
14,4 g
10,3 g
98. Zmieszano 30 cm3 0,05 molowego roztworu Na2S z 20 cm3 0,2 molowego roztworu Pb(NO3)2. Oblicz masę wytrąconego osadu:
0,36 g
0,96 g
1,31 g
0,72 g
99. Do roztworu zawierającego 0,03 mola MgCl2 dodano roztwór zawierający
0,05 mola NaOH. Oblicz masę powstałego osadu:
1,45 g
2,90 g
4,64 g
0,58 g
100. Jakie było stężenie roztworu chlorku wapnia, jeśli w wyniku reakcji 50 cm3 tego roztworu z nadmiarem H2SO4 powstało 2,72 g osadu ?
0,02 mol/dm3
0,40 mol/dm3
0,82 mol/dm3
0,10 mol/dm3
101. Do probówki zawierającej 10 cm3 0,1 molowego roztworu badanej soli dodano nadmiar 0,2 molowego roztworu siarczku potasu. Po odsączeniu
i wysuszeniu powstałego osadu, jego masa wynosiła 0,248 g. Badaną solą był:
CuSO4
AgNO3
ZnCl2
FeCl2
Do 20 cm3 roztworu chlorku magnezu dodano 50 cm3 1 molowego roztworu węglanu sodu. Oblicz stężenie roztworu chlorku magnezu, zakładając,
że wszystkie jony Mg2+ przereagowały z anionami węglanowymi.
5 mol/dm3
10 mol/dm3
0,5 mol/dm3
2,5 mol/dm3
103. Wybierz grupę zawierającą wyłącznie reduktory:
H+, CO, I2
Cl−, K, I−
Fe2+, F2, Cu
Cu2+, Fe2+, Fe3+
104. Które z wymienionych jonów mogą być zarówno utleniaczami,
jak i reduktorami ?
Fe3+, NO2−, SO42−
NO3−, S2−, Cr2O72−
SO32−, NO2−, ClO−
Cl−, I−, PO43−
105. Anion nadmanganianowy (MnO4−) ma właściwości:
amfoteryczne
redukujące
utleniające
kwasowe
106. W wyniku reakcji stężonego kwasu solnego z nadmanganianem potasu wydzieli się między innymi:
chlorowodór
chlor
nadchloran potasu
chloryn potasu
107. 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 8H2O + 5O2 + K2SO4
W powyższej reakcji:
nadmanganian potasu jest utleniaczem, a kwas siarkowy reduktorem
nadmanganian potasu jest utleniaczem, a nadtlenek wodoru reduktorem
nadmanganian potasu jest reduktorem, a nadtlenek wodoru utleniaczem
kwas siarkowy jest utleniaczem, a nadtlenek wodoru reduktorem
108. W wyniku reakcji miedzi z rozcieńczonym kwasem azotowym otrzymujemy azotan miedzi II, wodę oraz:
wodór
dwutlenek azotu
tlenek azotu
tlenek miedzi
109. W której z poniższych reakcji przebiega proces utleniania i redukcji ?
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
2Fe + 3Cl2 → 2FeCl3
FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
110. W reakcji rozcieńczonego roztworu kwasu siarkowego z cynkiem, utleniaczem jest:
gazowy wodór
cynk
kationy wodorowe
aniony siarczanowe
111. W reakcji: 16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
utleniaczem są aniony chlorkowe, reduktorem kationy potasu
zarówno utleniaczem, jak i reduktorem jest mangan
reduktorem są aniony chlorkowe, zaś utleniaczem aniony nadmanganianowe
reduktorem są aniony nadmanganianowe, zaś utleniaczem chlor
112. Które z poniższych kwasów można zastosować do utlenienia srebra ?
H2SO4(rozc.), HCl, HNO3(rozc.)
H3PO4, H2SO4(stęż.), HClO4
H2SO4(rozc.), HNO3(stęż.), H2S
H2SO4(stęż.), HNO3(stęż.), HNO3(rozc.)
113. Które z poniższych metali będą reagowały zarówno z rozcieńczonym kwasem solnym, jak i azotowym ?
Zn, Cu, Al
Fe, Pb, Ag
Zn, Fe, Pb
Sn, Cu, Zn
114. W reakcji rozcieńczonego kwasu siarkowego z magnezem, reduktorem jest:
gazowy wodór
magnez
kation wodorowy
anion siarczanowy
115. W wyniku reakcji miedzi ze stężonym kwasem azotowym otrzymuje się
azotan miedzi II, wodę oraz:
wodór
dwutlenek azotu
tlenek azotu
tlenek miedzi
116. Zaznacz właściwą wartość współczynników X i Y w poniższym równaniu:
Cr2O72− + XH+ +6I− → YCr3+ + 3I2 + 7H2O
X = 14, Y = 2
X = 7, Y = 2
X = 28, Y = 4
X = 2, Y = 14
117. W równaniu reakcji: xHCl + yKMnO4 → zCl2 + dMnCl2 + eKCl + fH2O
współczynniki stechiometryczne są następujące
|
x |
y |
z |
d |
e |
f |
a. |
10 |
2 |
5 |
2 |
2 |
5 |
b. |
5 |
2 |
5 |
2 |
2 |
5 |
c. |
16 |
2 |
5 |
2 |
2 |
8 |
d. |
16 |
2 |
5 |
2 |
2 |
5 |
118. Zaznacz właściwą wartość współczynników stechiometrycznych w poniższym równaniu reakcji:
xNa2SO3 + yNaMnO4 + zNaOH → wNa2SO4 + kNa2MnO4 + nH2O
|
x |
y |
z |
w |
k |
n |
a. |
1 |
2 |
2 |
1 |
2 |
1 |
b. |
2 |
1 |
1 |
2 |
2 |
2 |
c. |
1 |
2 |
2 |
2 |
2 |
1 |
d. |
2 |
2 |
1 |
2 |
1 |
2 |
119. Do zakwaszonego roztworu KMnO4 dodano wodnego roztworu pewnej substancji. Roztwór odbarwił się. Dodaną substancją był:
NaOH
FeCl3
FeSO4
I2
120. W reakcji nadmanganianu potasu z nadtlenkiem wodoru, w środowisku kwaśnym, wydziela się:
wodór
nadtlenek wodoru
tlen
mieszanina substancji wymienionych w punktach a, b i c
121. Anion siarczkowy w procesach redoks może spełniać funkcję:
wyłącznie reduktora
wyłącznie utleniacza
zarówno reduktora, jak i utleniacza
nie ma właściwości redoks
122. Wskaż, które z podanych równań reakcji nie przedstawia procesu redoks:
2H2O2 → 2H2O + O2
H2O + Cl2 → HCl + HClO
Cl2O7 + 2NaOH → 2NaClO4 + H2O
Hg + S → HgS
123. Prażenie pirytu (FeS2) w obecności tlenu prowadzi do wydzielenia:
siarkowodoru
dwutlenku siarki
trójtlenku siarki
siarki koloidalnej
124. W reakcji przedstawionej równaniem:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
rolę reduktora pełni anion azotanowy
rolę utleniacza pełni anion azotynowy
rolę reduktora pełni anion dwuchromianowy
rolę reduktora pełni anion azotynowy
125. Anion azotynowy (NO2−) w procesach redoks zachodzących w wodnych roztworach może pełnić rolę:
reduktora
utleniacza
zarówno utleniacza jak reduktora
anion ten nie ma właściwości redoks
126. Właściwości redukujących nie posiada:
anion azotynowy
anion jodkowy
anion siarczkowy
anion siarczanowy
127. Utleniaczem nazywamy:
substancję chemiczną, która w reakcji redoks oddaje elektrony
substancję chemiczną, która w reakcji redoks przyjmuje elektrony
pierwiastek mogący pełnić funkcję reduktora
substancję chemiczną mogącą odłączać protony
128. Produktami reakcji stężonego kwasu siarkowego z miedzią są:
siarczan miedzi II i wodór
siarczan miedzi II i woda
siarczan miedzi II, siarkowodór i woda
siarczan miedzi II, dwutlenek siarki i woda
129. W podanej poniżej reakcji chemicznej
8HNO3 + 3Cu → 2NO + 3Cu(NO3)2 + 4H2O
rolę utleniacza i reduktora pełnią:
utleniacz reduktor
kation wodorowy miedź
miedź anion azotanowy
anion azotanowy miedź
anion azotynowy kation miedzi II
130. W przedstawionym równaniu reakcji redoks:
xFeSO4 + yKMnO4 + zH2SO4 → dFe2(SO4)3 + eMnSO4 + fK2SO4 + gH2O.
Współczynniki stechiometryczne reakcji są następujące:
|
x |
y |
z |
d |
e |
f |
g |
a |
5 |
2 |
8 |
5 |
2 |
1 |
4 |
b |
5 |
1 |
8 |
5 |
3 |
2 |
1 |
c |
10 |
2 |
8 |
5 |
2 |
1 |
8 |
d |
10 |
2 |
4 |
5 |
2 |
1 |
8 |
131. Wskaż grupę substancji mogących w procesach utleniania i redukcji spełniać rolę utleniacza:
Cl−, F−
O3, F2
HNO3, NH3
wszystkie wyżej wymienione
132. W wyniku reakcji jonów MnO4− z NO2− uzyskano roztwór barwy zielonej. Reakcję tę prowadzono w środowisku:
kwaśnym
obojętnym
zasadowym
barwa roztworu nie zależy od środowiska reakcji
133. Reakcja Ag z rozcieńczonym roztworem HNO3 przebiega według równania:
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
Ag + 2HNO3 → AgNO3 + NO2 + H2O
2Ag + 2HNO3 → 2AgNO3 + H2
2Ag + 2HNO3 → Ag2O + 2NO2 + H2O
134. Który pierwiastek z grupy VII A (fluorowce) ma najsłabsze właściwości utleniające ?
fluor
brom
chlor
jod
135. W równaniu reakcji:
K2S + ..... + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
brakującym związkiem jest:
K2Cr2O7
CrSO4
CrO
żadna z wymienionych substancji
136. W równaniu reakcji:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + ..... + K2SO4 + H2O
brakującym związkiem jest:
MnO2
Mn(OH)2
MnSO4
K2MnO4
137. Które równanie przedstawia reakcję dysproporcjonowania ?
2NO + O2 → 2NO2
P + 5HNO3 → H3PO4 + 5NO2 + H2O
2H2 + O2 → H2O
3HNO2 → HNO3 + 2NO + H2O
138. Reakcja chemiczna przedstawiona równaniem:
BrO3− + 6I− + ..... → Br − + 3I2 + 3H2O
przebiega w środowisku:
obojętnym
kwaśnym
zasadowym
obojętnym lub zasadowym
139. W roztworze wodnym przeprowadzono reakcję przedstawioną równaniem:
6KI + K2Cr2O7 + 7H2SO4 → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
W reakcji wzięły udział:
wszystkie jony znajdujące się w roztworze
tylko jony I−, Cr2O72− i H+
tylko jony K+, Cr2O72− i SO42−
tylko jony K+, SO42− i H+
140. Współczynniki stechiometryczne w równaniu reakcji redoks
xNO3− + yS + zH+ → xNO2 + ySO42− + uH2O
są następujące:
|
x |
y |
z |
u |
a. |
6 |
1 |
2 |
1 |
b. |
6 |
1 |
4 |
2 |
c. |
4 |
2 |
6 |
3 |
d. |
3 |
3 |
4 |
2 |
141. W równaniu 2Fe3+ + 2I− → 2Fe2+ + I2 kation Fe3+ pełni rolę:
reduktora
utleniacza
kwasu
wskaźnika kwasowo-zasadowego
142. Która z podanych substancji nie może pełnić roli utleniacza
w procesie redoks ?
Cl2
ClO−
ClO2−
Cl−
143. Metale o dodatnich potencjałach elektrochemicznych reagują z kwasami:
beztlenowymi
rozcieńczonymi, nie posiadającymi właściwości utleniających
stężonymi, nie posiadającymi właściwości utleniających
stężonymi o silnych właściwościach utleniających
144. Jaką objętość zajmie w warunkach normalnych chlor powstały w reakcji
20 cm3 0,05 molowego roztworu KMnO4 z nadmiarem kwasu solnego?
0,056 dm3
0,0224 dm3
0,560 dm3
0,224 dm3
145. Ile gramów Fe2+ znajdowało się w roztworze, jeśli na ich utlenienie
w środowisku kwaśnym zużyto 20 cm3 0,1 molowego roztworu KMnO4 ?
0,224 g
0,280 g
0,112 g
0,560 g
146. Na zmiareczkowanie 20 cm3 roztworu zawierającego jony Fe2+ w środowisku kwaśnym, zużyto 30 cm3 0,01 molowego roztworu KMnO4. Ile g jonów Fe2+ zawiera 1 dm3 tego roztworu ?
0,075 g
0,015 g
4,185 g
0,042 g
147. W jakiej objętości 5% roztworu HNO3 o gęstości 1,03 g/cm3 rozpuści się
1,08 g srebra ?
16,31 cm3
12,23 cm3
16,80 cm3
12,60 cm3
148. Ile gramów K2Cr2O7 znajdowało się w roztworze, jeśli w wyniku reakcji
z nadmiarem KI w środowisku kwaśnym wydzieliło się 0,127 g jodu ?
0,10 g
0,05 g
2,94 g
0,29 g
149. Ile gramów jodu powstało w reakcji kwasu azotawego z roztworem jodku potasu, jeśli wydzielony tlenek azotu zajął (w warunkach normalnych) objętość 5,6 dm3 ?
15,88 g
31,75 g
63,50 g
82,30 g
150. Jaka objętość chloru w warunkach normalnych wzięła udział w reakcji
z roztworem jodku potasu, jeśli powstało 1,27 g jodu ?
112 cm3
11,2 cm3
112 dm3
1,12 dm3
3.5. Elektroliza i ogniwa
1. Podczas elektrolizy wodnego roztworu azotanu srebra na katodzie:
redukują się kationy wodorowe
redukują się kationy srebra
utleniają się aniony azotanowe
utleniają się kationy srebra
2. W czasie elektrolizy jeden z poniższych roztworów, zawierający dodatkowo fenoloftaleinę, zabarwił się na malinowo. Był to roztwór:
CuCl2
ZnSO4
KCl
AgNO3
3. W wyniku elektrolizy wodnego roztworu CuSO4 na anodzie wydziela się:
Cu
SO2
O2
SO3
4. W czasie elektrolizy wodnego roztworu siarczanu potasu ...
na katodzie wydziela się potas
na katodzie wydziela się wodór
na anodzie wydziela się wodór
na anodzie wydziela się siarka
5. W czasie elektrolizy wodnego roztworu chlorku potasu ...
na katodzie wydziela się potas
na katodzie wydziela się chlor
na anodzie wydziela się tlen
na anodzie wydziela się chlor
6. Reakcja elektrolitycznego utleniania wody przebiega na:
katodzie, podczas elektrolizy wodnego roztworu H2SO4
anodzie, podczas elektrolizy wodnego roztworu H2SO4
katodzie, podczas elektrolizy wodnego roztworu HCl
anodzie, podczas elektrolizy wodnego roztworu HCl
7. Reakcję elektrolitycznego utlenienia wody przedstawia równanie:
2H2O −4e → 4H+ + O20
2H2O + 2e → 2OH− + H20
2H2O + O2 → 2H2O2
2H2 + O2 → 2H2O
8. Podczas elektrolizy wodnego roztworu pewnego związku chemicznego na katodzie wydzielał się wodór a na anodzie tlen. Związkiem tym mógł być:
NaOH
H2SO4
NaNO3
wszystkie odpowiedzi są poprawne
9. Poddano elektrolizie wodne roztwory: KOH, Na2SO4 i NaCl. Na anodzie wydzielił się gazowy tlen ...
tylko podczas elektrolizy roztworu KOH
podczas elektrolizy roztworów KOH i Na2SO4
tylko podczas elektrolizy roztworu NaCl
podczas elektrolizy wszystkich wymienionych roztworów
10. Podczas elektrolizy wodnego roztworu H2SO4 na anodzie zachodzi następująca reakcja:
2H+ + 2e → H20
2H2O + 2e → 2OH− + H20
2H2O - 4e → 4H+ + O2
SO42− - 2e → SO3 +1/2O2
11. Podczas elektrolizy na elektrodach zachodzą procesy utleniania i redukcji,
przy czym:
na anodzie przebiegają procesy redukcji, a na katodzie utlenienie
na katodzie zachodzą procesy redukcji, a na anodzie utlenienie
zależnie od materiału elektrod procesy utleniania czy redukcji mogą przebiegać na anodzie lub katodzie
zależnie od jonów zawartych w elektrolizowanym roztworze procesy utleniania czy redukcji mogą przebiegać na katodzie lub anodzie
12. Reakcja elektrodowa 2H2O + 2e → 2OH− + H2 zachodzi w trakcie elektrolizy wodnego roztworu:
NaOH, na katodzie
NaOH, na anodzie
HNO3, na katodzie
HNO3, na anodzie
13. Wybierz poprawne zakończenie zdania: W czasie elektrolizy ...
katoda jest elektrodą dodatnią i przebiega na niej reakcja utleniania
katoda jest elektrodą dodatnią i przebiega na niej reakcja redukcji
anoda jest elektrodą ujemną i przebiega na niej proces redukcji
anoda jest elektrodą dodatnią i przebiega na niej proces utleniania
14. W czasie elektrolizy wodnego roztworu siarczynu potasu na katodzie przebiega reakcja:
K+ + e → K
S2− − 2e → S
2H2O + 2e → H2 + 2OH−
H2O − 2e → 2H+ + 1/2O2
15. pH elektrolizowanego wodnego roztworu NaCl w czasie elektrolizy:
rośnie, ponieważ powstają jony OH−
maleje, ponieważ powstają jony OH−
nie zmienia się, bo brak jest jonów OH− i H+
równe jest 7, bo NaCl jest solą obojętną
16. Jeśli w czasie elektrolizy na anodzie wydzielał się tlen, to oznacza,
że elektrolizowanym roztworem mógł być:
KOH
CuSO4
NH4NO2
wszystkie odpowiedzi są poprawne
17. Sód można otrzymać w czasie elektrolizy:
stopionego NaCl
wodnego roztworu NaCl
wodnego roztworu NaOH
poprawna jest odpowiedź b i c
18. Chlor można otrzymać w czasie elektrolizy:
stopionego NaCl
wodnego roztworu NaCl
stopionego KCl
wszystkie odpowiedzi są poprawne
19. Jeżeli podczas elektrolizy wodnego roztworu AgNO3 wydzieliło się 2,24 dm3 tlenu (warunki normalne) to na katodzie wydzieliło się równocześnie:
2,24 dm3 wodoru
2,16 g srebra
21,6 g srebra
43,2 g srebra
20. W czasie elektrolizy wodnego roztworu azotanu wapnia, wydzielające się gazy zajęły objętość 5,04 dm3. O ile zmniejszyła się masa elektrolizowanego roztworu ?
5,4 g
18,0 g
9,0 g
2,7 g
21. Podczas elektrolizy wodnego roztworu CuSO4 powstało 448 cm3 tlenu,
w warunkach normalnych. Ile gramów miedzi wydzieliło się na katodzie ?
2,54 g
6,40 g
5,12 g
1,28 g
22. Podczas elektrolizy wodnego roztworu KOH otrzymano 1,4 dm3 wodoru (warunki normalne). O ile gramów zmniejszyła się masa elektrolizowanego roztworu ?
0,1125 g
1,125 g
11,25 g
1400 g
23. Ile gramów srebra wydzieli się w czasie elektrolizy wodnego roztworu azotanu srebra, prądem o natężeniu 500 mA w czasie 1 godziny ?
2,0 g
3,0 g
4,0 g
5,0 g
24. W pracującym ogniwie Daniella przebiegają następujące reakcje chemiczne:
cynk redukuje się, a miedź utlenia
cynk utlenia się, a kationy miedzi redukują się
kationy cynku utleniają się, a kationy miedzi redukują się
kationy cynku redukują się, a miedź utlenia się
25. Roztwór zawierający równomolowe ilości SnCl4 i SnCl2 połączono zewnętrznie z roztworem zawierającym równomolowe ilości FeCl3 i FeCl2.
E0(Sn4+/Sn2+) = + 0,15 V, E0(Fe3+/Fe2+) = + 0,77 V.
Jakie reakcje będą przebiegały w obu roztworach ?
Fe2+ → Fe3+, Sn2+ → Sn4+
Fe3+ → Fe2+, Sn2+ → Sn4+
Sn4+ → Sn2+, Fe2+ → Fe3+
Sn4+ → Sn2+, Fe3+ → Fe2+
26. Do trzech roztworów wodnych zawierających azotany: I: Cu2+, II: Fe2+, III: Pb2+ włożono blaszkę cynkową. Wydzielanie się metalu na blaszce Zn zaobserwowano w roztworze:
tylko II
w II i III
we wszystkich
w żadnym
27. Po zanurzeniu płytki cynkowej i miedzianej w wodnym roztworze kwasu siarkowego oraz połączeniu ich przewodnikiem zachodzą następujące reakcję:
Anoda (-) Katoda (+)
Zn → Zn2+ + 2e 2H+ + 2e → H20
Cu0 → Cu2+ + 2e Cu2+ + SO42− → CuSO4
Zn → Zn2+ + 2e Zn2+ + SO42− → ZnSO4
Cu → Cu2+ + 2e Cu2+ + 2e → Cu
28. Który z poniższych zapisów przedstawia schemat ogniwa zbudowanego
z elektrody wodorowej i cynkowej ?
Pt, H2, H+ Zn2+, Zn
Pt, H2, H+ Zn2+, Zn, Pt
Zn, Zn2+ H+, H2, Pt
Pt, Zn, Zn 2+ H+, H2, Pt
29. Wskaż właściwy zapis ogniwa zbudowanego z elektrody wodorowej
i miedziowej:
Pt, H2, H+ Cu2+, Cu
Pt, H2, H+ Cu2+, Cu, Pt
Pt, Cu, Cu2+ H+, H2, Pt
Cu, Cu2+ H+, H2, Pt
30. Wskaż błędny wniosek, jaki wyciągnięto z szeregu napięciowego metali:
metale „przed” wodorem wypierają wodór z roztworów kwasów
metale o niższych potencjałach wypierają z roztworów wodnych metale o wyższych potencjałach
metale o niższych potencjałach są wypierane z roztworów wodnych przez metale o wyższych potencjałach
metale „za” wodorem nie wypierają wodoru z roztworów kwasów
31. Ile gramów miedzi wydzieliło się na blaszce żelaza zanurzonej w roztworze CuSO4, jeśli masa blaszki zwiększyła się o 1,0 gram ?
1,0 g
2,5 g
8,5 g
16,0 g
32. Blaszkę cynkową zanurzono do 200 cm3 roztworu CuSO4. Po zakończonej reakcji jej masa zmieniła się o 0,2 g. Jakie było stężenie molowe roztworu siarczanu miedzi ?
0,67 mol/dm3
1,00 mol/dm3
0,33 mol/dm3
2,00 mol/dm3
33. Do roztworu azotanu srebra zanurzono płytkę cynkową. Po pewnym czasie stwierdzono, że jej masa wzrosła o 3,02 g. Ile gramów srebra wydzieliło się
na płytce ?
7,59 g
5,25 g
3,02 g
4,32 g
34. Jakie było stężenie molowe roztworu AgNO3, jeśli blaszka cynkowa zanurzona do 200 cm3 tego roztworu zwiększyła swą masę o 1,0 g ?
0,05 mol/dm3
0,07 mol/dm3
0,10 mol/dm3
0,01 mol/dm3
35. Ile gramów CuSO4 znajdowało się w roztworze, jeśli 1 g cynku wyparł całkowicie jony Cu2+ ?
1,26 g
2,45 g
4,90 g
6,35 g
3.6. Związki nieorganiczne i ich właściwości chemiczne
1. Siarczki są solami kwasu:
siarkowego
siarkowodorowego
siarkawego
tiosiarkowego
2. Związek o wzorze sumarycznym Ca(H2PO4)2 to:
wodoroortofosforan wapnia
hydroksoortofosforan wapnia
dihydroksoortofosforan wapnia
diwodoroortofosforan wapnia
3. Azotan hydroksoglinu można otrzymać z kwasu azotowego i wodorotlenku glinu zmieszanych w stosunku molowym:
1 : 1
1 : 2
2 : 1
1 : 3
4. N2O5 może być jednym z substratów w reakcji otrzymywania:
kwasu azotawego
azotanu amonu
azotynu sodu
zasady amonowej
5. Nadchloran sodu można otrzymać w wyniku reakcji:
kwasu solnego i zasady sodowej
kwasu chlorowego i tlenku sodu
siedmiotlenku chloru i bezwodnika zasady sodowej
pięciotlenku chloru i zasady sodowej
6. Wodoroortofosforan wapnia można otrzymać w wyniku reakcji kwasu ortofosforowego z zasadą wapniową, zmieszanych w stosunku molowym:
1 : 2
2 : 1
1 : 1
3 : 2
7. Współczynnik x w poniższym równaniu reakcji chemicznej ma wartość:
zMg(OH)2 + wH3PO4 → yMg3(PO4)2 + xH2O
2
3
4
6
8. Azotynu magnezu nie można otrzymać w reakcji:
N2O3 + MgO →
N2O5 + MgO →
Mg(OH)NO2 + HNO2 →
Mg(OH)2 + HNO2 →
9. Produktem reakcji Cl2O7 z KOH jest woda oraz:
chlorek potasu
nadchloran potasu
podchloryn potasu
chloran potasu
10. Która z podanych reakcji nie jest możliwa do przeprowadzenia ?
2KBr + Cl2 → 2KCl + Br2
Cu + H2SO4 → CuSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
CrO3 + 2KOH → K2CrO4 + H2O
11. Związek o wzorze KHSO3 to:
wodorosiarczan potasu
wodorosiarczek potasu
wodorosiarczyn potasu
siarczyn hydroksopotasu
12. W którym z podanych przykładów powstanie wodorosiarczyn sodu ?
NaOH + H2SO4
2NaOH + H2SO4
NaOH + H2SO3
2NaOH + H2SO3
13. Produktami reakcji dwutlenku siarki z nadmiarem NaOH jest woda oraz:
siarczek sodu
siarczan sodu
siarczyn sodu
wodorosiarczan sodu
14. Z zasadą sodową reagują następujące wodorotlenki:
NaOH, Zn(OH)2, Pb(OH)2
Al(OH)3, Cu(OH)2, Ca(OH)2
Zn(OH)2, Al(OH)3, Pb(OH)2
Fe(OH)2, Cu(OH)2, Zn(OH)2
15. Która z poniższych reakcji nie przebiega ?
Cl2O7 +NaOH →
PbO + NaOH →
Na2O + Ca(OH)2 →
CO2 + H2O →
16. Z KOH reagują wszystkie substancje wymienione w zestawie:
CO2, CO, CaO
Na2O, MgO, BaO
Cl2O7, SO3, P2O5
N2O5, NO, SiO2
17. W którym z poniższych zestawów wymieniono jedynie bezwodniki kwasowe ?
SO3, CO, N2O5
P2O5, N2O3, SO2
CaO, N2O5, NO
PbO, Cl2O7, CO2
18. Która z poniższych reakcji nie przebiegnie ?
SO2 + K2O →
Mg(OH)2 + KOH →
NaOH + Pb(OH)2 →
P2O5 + CaO →
19. Stopień utlenienia atomu siarki w następujących cząsteczkach i jonach:
SO3, H2S, SO32− wynosi odpowiednio:
+6, +4, +4
−6, +2, −4
+3, −2, +2
+6, −2, +4
20. Która z poniższych reakcji nie przebiegnie ?
Zn + H2SO4 →
CrO3 + NaOH →
Cu + H2SO3 →
Mg(OH)2 + HNO3 →
21. Stopień utlenienia fosforu w: K3PO4, HPO2, H2PO4−, PCl3, H4P2O7, PO33− wynosi odpowiednio:
+5, +3, +5, +3, +5, +3
+3, +5, +5, +3, +5, +3
−5, −3, −5, +3, +5, +3
+5, +3, +5, −3, +5, +3
22. Metale: Ca, Zn, Cu traktowano, każdy osobno, rozcieńczonym HCl.
Wodór wyparły z kwasu:
Ca i Zn
Cu i Zn
Ca i Cu
wszystkie metale
23. W którym z poniższych zestawów wszystkie metale reagują z rozcieńczonym kwasem siarkowym ?
K, Ag, Ca
Mg, Zn, Cu
Al, Na, Ba
Li, Pb, Au
24. Która z poniższych reakcji nie przebiegnie ?
Cu + Mg2+ →
Hg2+ + Zn →
Ag+ + Al →
Cu2+ + Pb →
25. Osad nie wytrącił się, jeśli do roztworu zawierającego jony Pb2+ dodano nadmiar:
HCl
H2SO4
H2S
KOH
26. Z H2SO4 reagują wszystkie substancje wymienione w zestawie:
CO2, CO, CaO
Na2O, MgO, BaO
Cl2O7, SO3, P2O5
N2O5, NO, SiO2
27. Metale: Ca, Mg i Ag traktowano, każdy osobno, rozcieńczonym roztworem
HCl i HNO3. Wodór wyparły z kwasów:
Ca, Mg i Ag z HCl
Ca, Mg i Ag z HCl i HNO3
Ag i Mg z HCl i HNO3
Ca i Mg z HCl
28. Działając stężonym kwasem siarkowym na NaCl otrzymuje się między innymi:
chlorowodór
siarkowodór
chlor
trójtlenek siarki
29. Chrom jako metal VI grupy pobocznej tworzy tlenki:
zasadowy CrO i kwasowy CrO3
zasadowy CrO, amfoteryczny Cr2O3 i kwasowy CrO3
tylko zasadowy CrO
tylko amfoteryczny Cr2O3
30. Które z poniższych tlenków będą reagowały z zasadą potasową ?
Al2O3, SO3, Na2O
ZnO, CO, P2O5
ZnO, BaO, SO2
ZnO, N2O5, Cl2O7
31. Do 3 probówek zawierających wodne roztwory nieznanych związków chemicznych, dodano po kilka kropli zasady sodowej. W probówce nr 1 pojawił się niebieski opalizujący osad, z probówki nr 2 po ogrzaniu wydzielił się amoniak, który rozpoznano po zapachu, zaś w probówce nr 3 pojawił się osad, który zniknął po dodaniu kolejnej porcji zasady. Jakie roztwory znajdowały się w kolejnych probówkach ?
|
nr 1 |
nr 2 |
nr 3 |
|
|
|
|
a. |
CuSO4 |
NH4Cl |
Zn(NO3)2 |
b. |
Cu(NO3)2 |
Zn(NO3)2 |
Pb(NO3)2 |
c. |
Zn(NO3)2 |
NH4Cl |
Mg(OH)2 |
d. |
NH4Cl |
Zn(NO3)2 |
CuSO4 |
32. Stop glinu z magnezem rozpuszczono w kwasie solnym. Do otrzymanego roztworu dodano w nadmiarze NaOH. W jakiej postaci znajduje się glin
po zakończeniu reakcji ?
w roztworze jako AlCl3
w osadzie jako Al(OH)3
w roztworze jako NaAl(OH)4
stop glinu i magnezu nie rozpuszcza się w roztworze HCl
33. Który z poniższych związków będzie produktem reakcji tlenku glinu
z nadmiarem zasady sodowej ?
Al(OH)3
NaAl(OH)4
Na2AlO2
taka reakcja nie przebiega
34. Produktem reakcji N2O3 + Na2O jest:
azotan sodu
azotyn sodu
azotek sodu
wszystkie wyżej wymienione substancje
35. P2O5 jest typowym tlenkiem kwasowym. Po wprowadzeniu go do wody powstaje:
H3PO4
HPO2
H3PO3
mieszanina kwasów wymienionych w punktach b i c
36. Sole pewnego kwasu, w którym atomy chloru występują na +7 stopniu utlenienia noszą nazwę:
chlorany
nadchlorany
chlorki
wszystkie odpowiedzi są poprawne
37. Jednym z produktów reakcji ZnO + HClO3 jest:
chlorek cynku
cynkan chloru
chloran cynku
chloryn cynku
38. Siarczan miedzi II można otrzymać w reakcji:
miedzi z rozcieńczonym kwasem siarkowym
tlenku miedzi II z dwutlenkiem siarki
wodorotlenku miedzi II z rozcieńczonym kwasem siarkawym
tlenku miedzi II ze stężonym kwasem siarkowym
39. K2CO3 można otrzymać w reakcji:
wodorotlenku potasu z dwutlenkiem węgla
dwutlenku węgla z tlenkiem potasu
potasu z tlenkiem węgla
poprawne są odpowiedzi a i b
40. W wyniku reakcji Na2S z roztworem HCl powstaje:
gazowy chlor
siarkowodór
dwutlenek siarki
mieszanina substancji wymienionych w pkt. a, b i c
41. Produktem reakcji CO2 z wodnym roztworem NaOH może być:
węglik sodu
węglan sodu
wodorowęglan sodu
substancje wymienione w punktach b i c
42. Poprawną nazwą soli o wzorze Mg(H2PO4)2 jest:
ortofosforan magnezu
wodoroortofosforan magnezu II
diwodorometafosforyn magnezu
diwodoroortofosforan magnezu
43. Która z poniżej przedstawionych reakcji nie przebiegnie ?
CaCO3 + HCl →
AgNO3 + NaCl →
Na2SO4 + HCl →
AgNO3 + H2S →
44. Wodorosole mogą powstawać w reakcji:
dowolnej mocnej zasady z dużym nadmiarem mocnego kwasu
kwasu dwu- lub więcej protonowego z zasadą
każdego kwasu z nadmiarem tlenku zasadowego
kwasu jednoprotonowego z niedomiarem zasady
45. Chlorek miedzi II nie powstaje w reakcji:
kwasu solnego z tlenkiem miedzi
wodorotlenku miedzi z chlorowodorem
miedzi z kwasem solnym
w żadnej z powyżej wymienionych
46. Wskaż grupę, w której wszystkie tlenki mają charakter amfoteryczny:
CuO, Fe2O3, SiO2
B2O3, Al2O3, Mn2O3
PbO2, Cu2O, Na2O
ZnO, Al2O3, PbO
47. Zarówno z kwasem solnym, jak też zasadą sodową, reagują obydwie substancje wymienione w punkcie:
wodorotlenek wapnia i tlenek węgla
tlenek cynku i wodorotlenek baru
wodorotlenek glinu i trójtlenek siarki
tlenek cynku i wodorotlenek glinu
48. Wskaż prawidłowe dokończenie stwierdzenia. Do tlenków kwasowych zaliczamy ...
wyłącznie tlenki niemetali
tlenki większości niemetali
niektóre tlenki metali
większość tlenków niemetali oraz niektóre tlenki metali
49. W reakcji dwutlenku siarki z nadmiarem wodorotlenku sodu powstaje:
wodorosiarczek sodu
siarczyn sodu
wodorosiarczyn sodu
siarczan sodu
50. Substratami reakcji, w wyniku której otrzymano azotan magnezu i wodę były:
kwas azotowy i tlenek magnezu
wodorotlenek magnezu i kwas azotawy
magnez i kwas azotowy
tlenek magnezu i tlenek azotu V
51. Produktem reakcji tlenku chromu III z kwasem nadchlorowym jest woda oraz:
CrCl3
Cr(ClO3)2
CrClO4
Cr(ClO4)3
52. Do czterech probówek ze stężonym roztworem HCl oznaczonych literami A, B, C, D wprowadzono metale: do A - cynk, do B - miedź, do C - magnez,
do D - srebro. W których probówkach przebiegła reakcja?
A i B
C i D
A i C
B i D
53. W której z poniższych grup wymienione gazy występują jedynie w cząsteczkach dwuatomowych (warunki normalne) ?
tlen, wodór, hel
azot, argon, chlor
tlen, azot, wodór
neon, azot, wodór
54. Gazowy amoniak wprowadzony do wodnego roztworu kwasu azotowego tworzy:
azotyn amonu
azotan amonu
azot
nie zajdzie w tym roztworze żadna reakcja chemiczna
55. Produktem reakcji P2O3 z Mg(OH)2 jest:
metafosforan magnezu
ortofosforan magnezu
fosforyn magnezu
wodorofosforan magnezu
56. Która z podanych reakcji nie prowadzi do otrzymania azotynu wapnia ?
Ca + HNO2 →
Ca(OH)2 + N2O3 →
HNO2 + CaO →
N2O3 + Ca →
57. Stopnie utlenienia atomu azotu w podanych poniżej związkach:
NH3, N2O3, HNO3, NH4Cl wynoszą odpowiednio:
+3, −3, −5, +4
−3, +3, +5, −4
+3, +3, +5, +4
−3, +3, +5, −3
58. Po wprowadzeniu P2O3 do wody powstaje:
roztwór wodny trójtlenku fosforu
zasada fosforowa
kwas fosforowy
mieszanina kwasów meta- i ortofosforawego
59. Zarówno z kwasem siarkowym, jak też z zasadą sodową reagują:
wodorotlenek wapnia i magnezu
tlenek i wodorotlenek glinu
tlenek wapnia i trójtlenek siarki
trójtlenek chromu i dwutlenek azotu
60. Bromian glinu ma wzór:
BrAl3
AlBr3
AlBrO3
Al(BrO3)3
61. Zasadowy odczyn mają roztwory powstałe po wprowadzeniu do wody:
P2O5
NaH
Na2O
odpowiedzi b i c są poprawne
62. Wybierz grupę, w której wszystkie substancje reagują z KOH:
K2SiO3, Sn(OH)2, CO2
KHS, K2S, H2S
KHS, AlCl3, PbO
K2S, K2SO3, KHS
63. Nadchloran sodu można otrzymać w reakcji:
chloru z wodorotlenkiem sodu
sodu z kwasem chlorowym
tlenku sodu z kwasem solnym
wodorotlenku sodu z kwasem nadchlorowym
64. Siarczyn potasu powstaje w reakcji:
SO3 z KOH
SO2 z KOH
H2SO4 z K2O
SO2 z potasem
65. Głównym składnikiem nawozu mineralnego, superfosfatu jest:
Ca3(PO4)2
K3PO4
Ca(H2PO4)2
CaHPO4
66. Wybierz grupę substancji, w których stopnie utlenienia atomu siarki wynoszą odpowiednio: +4, −2, +6
Cu2S, H2S, SO3
SO2, Cu2S, CaSO4
NaHSO3, SOCl2, Na2S
Na2SO4, SO2, SCl6
67. Wskaż grupę substancji, w których fosfor występuje wyłącznie na stopniu utlenienia +3:
K3PO3, PH3, P2O3
KPO2, P2O3, K3PO3
PCl3, PF3, HPO3
P2O3, P2O5, HPO2
68. W azotynie amonu atomy azotu występują na stopniach utlenienia:
obydwa na +3
na −3 i +3
na −4 i +3
na −5 i +3
69. Siarczyn żelaza II może powstać w reakcji:
SO2 z FeO
SO3 z Fe(OH)2
SO3 z FeO
SO2 z Fe(OH)3
70. Tlenki zasadowe wymieniono wyłącznie w grupie:
ZnO, FeO, K2O
K2O, BaO, Na2O
PbO, Al2O3, SiO2
CuO, CrO, Cr2O3
71. Wybierz grupę, w której umieszczono wyłącznie tlenki kwasowe:
CO2, Cr2O3, PbO
NO, NO2, N2O5
CrO3, NO2, SO2
CrO, CrO3, Cr2O3
72. Do wodnego roztworu NaOH wprowadzono gazowy dwutlenek siarki. Produktem reakcji nie był na pewno:
wodorosiarczyn sodu
siarczyn sodu
siarczan sodu
siarczan IV sodu
73. Która z grup zawiera tlenki o charakterze zarówno kwasowym, amfoterycznym, jak też zasadowym ?
SO2, SO3, CaO
ZnO, PbO, Al2O3
K2O, P2O5, CO
CrO3, Cr2O3, CrO
74. Pamiętając o tym, że siarczan amonu należy do soli hydrolizujących, nawóz zawierający ten związek powinno stosować się do nawożenia gleb:
kwaśnych
kwaśnych i zasadowych
zasadowych i obojętnych
kwaśnych, zasadowych i obojętnych
75. Saletra amonowa będąca nawozem mineralnym ma wzór:
NH4NO2
NaNO3
(NH4)3PO4
NH4NO3
76. Ortofosforan amonu ma wzór:
(NH4)3PO4
(NH3)3PO3
(NH4)3PO3
(NH3)4PO3
77. Saletry używane w rolnictwie jako nawozy mineralne to z chemicznego punktu widzenia:
azotany
azotyny
fosforany
fosforyny
78. Substancja o wzorze sumarycznym NH4NO3 jest to:
azotyn amonu
azotan amonu
saletra chilijska
azotan azotowy
79. Saletra potasowa to:
KCl
KNO3
K3PO4
KNO2
80. Przemijającą twardość wody powodują głównie:
chlorki wapnia, magnezu i żelaza II
węglany wapnia i magnezu
wodorowęglany wapnia i magnezu
wodorowęglany sodu i potasu
81. Nieprzemijającą twardość wody powodują głównie:
wodorowęglany wapnia i magnezu
węglany wapnia i magnezu
rozpuszczone sole żelaza i manganu
chlorki i siarczany wapnia i magnezu
82. Twardość wody powodują:
kationy sodu i potasu
kationy magnezu i wapnia
aniony siarczanowe i fosforanowe
wszystkie wyżej wymienione jony
83. Związek o wzorze Fe2(SO3)3 to:
siarczan żelaza II
siarczyn żelaza II
siarczan żelaza III
siarczyn żelaza III
84. Wodny roztwór nadtlenku wodoru nazywa się zwyczajowo:
wodą królewską
wodą ciężką
wodą utlenioną
salmiakiem
85. Prawą stronę równania reakcji NH3 + H2O, zgodnie z teorią Br*nsteda przedstawia zapis:
NH4OH
NH3⋅H2O
NH4+ + OH−
NH4− + OH−
86. Do 5 probówek zawierających wodę, oznaczonych numerami od 1 do 5 wprowadzono następujące substancje: BaO, CO2, K2CO3, NH4NO3, P2O3. Odczyn kwaśny stwierdzono w probówkach oznaczonych numerami:
3, 4, 5
1, 2, 5
2, 3, 4
2, 4, 5
87. Po wprowadzeniu do wody stężonego roztworu H2SO4 wydziela się ciepło.
Jest to wynikiem:
utleniających właściwości kwasu siarkowego
procesu redukcji kwasu siarkowego
częściowego ulatniania się gazowego SO3
hydratacji anionów siarczanowych
88. W wyniku reakcji tlenku wapnia z HNO2 powstaje:
azotan III wapnia
azotan V wapnia
azotan II wapnia
ta reakcja nie zachodzi
89. Produktem reakcji Cl2O3 z NaOH jest:
chloran V sodu i wodór
chloran V sodu i woda
chloran III sodu i woda
chlorek sodu i woda
90. Do wydzielenia wodoru z wody nie można użyć:
magnezu i wapnia
sodu i potasu
litu i baru
miedzi i srebra
91. ClO4− to anion:
chlorkowy
chloranowy
chlorynowy
nadchloranowy
92. Siarczan VI żelaza II nie powstaje w wyniku reakcji:
SO3 z Fe(OH)3
SO3 z Fe(OH)2
H2SO4 z FeO
SO3 z FeO
93. Azotan III glinu ma wzór:
Al(NO3)3
AlNO3
AlNO2
Al(NO2)3
94. Która z podanych niżej reakcji nie przebiegnie ?
MnSO4 + Mg → MgSO4 + Mn
NiSO4 + Zn → ZnSO4 + Ni
K2SO4 + Fe → FeSO4 + 2K
MgSO4 + 2Na → Na2SO4 + Mg
95. Próbka siarczanu potasu zawiera X jonów. Liczba jonów siarczanowych w tej próbce wynosi:
3/2 X
2/3 X
1/3 X
1/2 X
96. Przyswajalność przez rośliny fosforanów x: Ca3(PO4)2, y: CaHPO4,
z: Ca(H2PO4)2 jest związana z ich rozpuszczalnością w wodzie i zmienia się następująco:
z > x > y
y > z = x
x > y > z
z > y > x
97. Siarczan IV potasu może powstać w reakcji:
SO2 z KOH
SO3 z KOH
SO2 z K2O
w reakcjach wymienionych w punkcie a i c
98. Które z równań reakcji najlepiej ilustrują charakterystyczną właściwość tlenku glinu ?
I Al2O3 + 6H+ → 2Al3+ + 3H2O
II 2Al(OH)3 → Al2O3 + 3H2O
III Al2O3 + 2OH− → 2AlO2− + H2O
IV Al2O3 + 3H2O → 2Al(OH)3
II i IV
I i III
I, II i III
wszystkie
99. Wskaż właściwe zakończenie rozpoczętego równania reakcji chemicznej:
ZnSO4 + KOHnadmiar →
Zn(OH)2↓ + K2SO4
ZnO + K2SO4 + H2O
K2[Zn(OH)4] + K2SO4
reakcja taka nie zachodzi
100. Wspólną cechą cząsteczek: H2, O2, N2, Cl2, F2 jest:
mała aktywność chemiczna
jednakowa liczba wiążących par elektronowych
występowanie wiązań koordynacyjnych
moment dipolowy równy zeru
101.Litery x, y, z w schemacie:
, to:
x y z
HClO3 NaOH HClO2
HCl H2O H2O2
HCl NaOH KMnO4
HClO Cu(OH)2 K2Cr2O7
102. Azot na stopniu utlenienia -3 występuje w połączeniu z:
chlorem i bromem
tlenem i wodorem
tlenem i fluorem
sodem i wodorem
103. W którym zestawie wszystkie wymienione kwasy mogą tworzyć wodorosole ?
H2CO3, H3PO4, H2SO4
H2S, HCl, HNO3
HNO2, HClO4, H2SO3
HBr, H2CO3, H3PO3
104. Pierwiastek X, którego tlenek ma wzór XO2, może utworzyć związek:
Na2XO3
H2XO3
BaXO3
wymienione w punktach a, b i c
105. Bezwodnik kwasowy i zasadowy można otrzymać w wyniku prażenia:
CaCO3
H2O2
Mg(OH)2
KCl
3.7. Węglowodory
1. Poniższy węglowodór to: 
2,3-dimetylopentan
3,4-dimetylopentan
3-etylo-2-metylobutan
3-etylo-2-metylobuten
2. Nazwa systematyczna poniżej przedstawionego węglowodoru jest następująca:
3-etylo-2,3,4-metyloheksan
3-etylo-2,3,4-trimetylopentan
etylotrimetylopentan
2,3,4-trietylo-3-metylopentan
3. Poniższy wzór strukturalny przedstawia: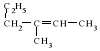
3-metylo-2-heksen
4-metylo-4-heksen
4-etylo-3-metylo-2-buten
1-etylo-2-metylo-2-buten
4. Które z poniższych związków są izomerami ?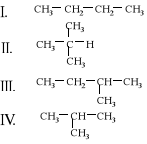
I i III
II i IV
I i IV
III i IV
5. Drugim związkiem w szeregu homologicznym alkenów jest:
acetylen
etyn
eten
propen
6. Toulen (metylobenzen) ma wzór sumaryczny:
C6H8
C10H8
C7H8
C7H9
7. Wzór ogólny szeregu homologicznego alkenów jest następujący:
CnH2n−2
CnH2n+2
CnH2n
CnH2n−1
8. Drugim związkiem w szeregu homologicznym alkinów jest:
acetylen
etyn
eten
propyn
9. Podstawniki X i Y w poniższych związkach znajdują się w pozycjach odpowiednio: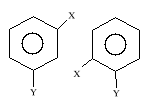
meta-, para-
orto-, para-
meta-, orto-
para-, meta-
10. Przedstawione wzory związków są przykładem izomerii:
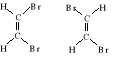
optycznej
łańcuchowej
geometrycznej
konstytucyjnej
11. Wiązanie π występuje w szeregach homologicznych węglowodorów o niżej podanym wzorze ogólnym:
CnH2n+2
CnH2n
CnH2n−2
odpowiedzi b i c są poprawne
12. W którym z poniższych związków atomy C występują w stanie hybrydyzacji typu sp ?
13. Liczba wszystkich możliwych alifatycznych izomerów związku o wzorze C4H8 wynosi:
2
3
4
6
14. Hybrydyzacja atomów węgla w poniższym związku jest następująca:![]()
sp3, sp3, sp, sp2, sp2
sp, sp, sp3, sp2, sp2
sp, sp2, sp3, sp2, sp3
sp2, sp, sp3, sp2, sp3
15. Ogólny wzór szeregu homologicznego CnH2n odnosi się:
tylko do alkenów
do alkenów i cykloalkanów
do alkenów, cykloalkanów i alkinów
do alkenów i węglowodorów aromatycznych
16. Liczba możliwych izomerów pentanu wynosi:
2
3
4
5
17. W cząsteczce etenu (etylenu), pomiędzy atomami węgla występują wiązania:
jedno σ (sigma) i jedno π (pi)
jedno σ i dwa π
dwa σ i jedno π
jedno wiązanie σ
18. Poniższe wzory:
przedstawiają tę samą cząsteczkę
przedstawiają izomery, które ze względu na zbliżone właściwości nie można rozdzielić
przedstawiają łatwe do rozdzielenia izomery
przedstawiają dwa enancjomery dimetylobenzenu
19. Atomy węgla w benzenie występują w stanie hybrydyzacji:
sp
sp2
sp3
sp3d2
20. Benzen jest typowym przedstawicielem węglowodorów aromatycznych, ponieważ:
ulega jedynie reakcji substytucji
jest nienasyconym związkiem pierścieniowym
zawiera 12 elektronów π wspólnych dla sześciu atomów węgla, stanowiących symetryczny sześciokąt
zawiera sześć równocennych atomów węgla o hybrydyzacji sp2
21. Atomy węgla w cząsteczce etynu (acetylenu) występują w stopniu utlenienia:
−4
+4
−1
+1
22. W wyniku reakcji propenu z chlorowodorem otrzymujemy:
1-chloropropan
1-chloropropen
2-chloropropan
2-chloropropen
23. Reakcja substytucji jest charakterystyczna dla:
alkanów
alkenów
alkinów
alkadienów
24. Który z poniższych związków może ulegać reakcji polimeryzacji?
2-metylopentan
3-metylo-1-penten
1-chlorobutan
1,3-dichlorobutan
25. Reakcja z bromem umożliwia odróżnienie:
metanu od etanu
butanu od butenu
etenu od propenu
etanu od propanu
26. W wyniku chlorowania węglowodoru wydzielił się chlorowodór. Który z podanych węglowodorów poddano chlorowaniu?
C2H4
C2H6
C2H2
C3H6
27. Alkiny ulegać mogą reakcjom:
podstawiania
eliminacji
estryfikacji
przyłączania
28. Reakcja nitrowania benzenu jest reakcją:
eliminacji
substytucji
addycji
polimeryzacji
29. 2-buten można otrzymać w reakcji eliminacji ...
HCl z 1-chlorobutanu
Cl2 z 1,2-dichlorobutanu
Cl2 z 2,3-dichlorobutanu
HBr z 1-bromobutanu
30. Regułę Markownikowa stosuje się przy addycji fluorowcowodoru do:
etenu
2-butenu
propenu
3-heksenu
31. W wyniku reakcji 1-butenu z HCl jako główny produkt otrzymuje się:
1-chlorobutan
2-chlorobutan
2-chlorobuten
1-chlorobuten
32. Surowcem do produkcji polietylenu jest:
etan
eten (etylen)
etanol
odpowiedzi b i c są poprawne
33. Z mieszaniny monochlorowcopochodnych metanu i etanu w reakcji W*rtza można otrzymać:
etan i butan
propan
butan
wszystkie wyżej wymienione
34. Do alkenu o wzorze CH3 − CH = C(CH3)2 przyłączono chlorowodór. Prawidłowa nazwa otrzymanego produktu to:
2-chlorodimetylopropen
1-chloro-1,1-dimetylopropan
3-chloro-2-metylobutan
2-chloro-2-metylobutan
35. W wyniku katalitycznego uwodnienia etenu otrzymuje się:
etanol
etanodiol
1-propanol
2-propanol
3.8. Pochodne węglowodorów, związki wielofunkcyjne
1. Wodny roztwór metanolanu sodu ma odczyn zasadowy.
Odczyn ten jest wynikiem:
obecności grupy hydroksylowej w alkoholu
reakcji alkoholu z zasadą sodową
hydrolizy metanolanu sodu
dysocjacji metanolanu sodu
2. W wyniku utleniania 2-propanolu otrzymujemy:
propanal
propanon
kwas propionowy
propen
3. 2-propanol możemy otrzymać w reakcji:
1-chloropropanu z NaOH
propenu z wodą
propanu z NaOH
1-chloropropanu z wodą
4. W wyniku reakcji propanolu z kwasem mrówkowym otrzymujemy:
mrówczan propylu
propionian metylu
propionian etylu
etanolan propylu
5. Głównym produktem reakcji eliminacji wody z 3-metylo-2-butanolu jest:
2-metylo-2-buten
3-metylo-1-buten
3-metylo-2-buten
2-metylo-1-buten
6. W wyniku utleniania 2-butanolu jako główny produkt powstaje:
butanal
butanon
kwas butanowy
buten
7. Produktem reakcji metanolu z kwasem octowym jest:
octan etylu
octan metylu
metanolan octowy
wszystkie wyżej wymienione substancje
8. Fenol od benzenu można oddzielić dodając do mieszaniny tych związków:
etanol
chlorowodór
amoniak
wodny roztwór NaOH
9. W wyniku utleniania związku o wzorze strukturalnym
otrzymano związek o wzorze:
C5H10O
C5H10O3
C5H12O2
C5H12
10. Ile izomerycznych alkoholi alifatycznych ma związek o wzorze ogólnym C4H9OH ?
3
4
5
6
11. Który z poniższych związków nie jest alkoholem ?
C6H5OH
C4H9OH
C5H10(OH)2
C3H5(OH)3
12. Alkoholem drugorzędowym jest:
3-metylo-1-butanol
3-metylo-3-heksanol
2-metylo-2-pentanol
3-metylo-2-butanol
13. Za pomocą, której z podanych niżej reakcji można wykazać, że fenol jest jednym z najsłabszych kwasów:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + H2SO4 → C6H4(OH)SO3H + H2O
C6H5ONa + H2O + CO2 → C6H5OH + NaHCO3
C6H5ONa + HCl → C6H5OH + NaCl
14. Wskaż, w którym szeregu ustawiono związki według wzrastającej kwasowości ich wodnych roztworów:
C6H5OH, C3H5(OH)3, C2H4(OH)2, C2H5OH
C2H5OH, C2H4(OH)2, C3H5(OH)3, C6H5OH
C6H5OH, C2H5OH, C2H4(OH)2, C3H5(OH)3
C3H5(OH)3, C2H5OH, C2H4(OH)2, C6H5OH
15. Próba Tollensa umożliwia odróżnienie:
butenu od butanu
butanalu od butanonu
butanalu od propanalu
butanonu od propanonu
16. Najsilniejsze właściwości kwasowe wykazuje:
kwas octowy
kwas chlorooctowy
kwas fluorooctowy
kwas fluorochlorooctowy
17. Reakcja aldehydów z odczynnikiem Tollensa jest dowodem:
ich redukujących właściwości
ich utleniających właściwości
ich kwasowo-zasadowych właściwości
ich kancerogennego charakteru
18. Związek o wzorze:![]()
to:
maślan etylu
propionian propylu
4-heksanon
octan butylu
19. Ester o wzorze sumarycznym C4H8O2 ma następującą liczbę izomerów:
3
4
5
6
20. Związek o wzorze CH3−CH2−CHO powstaje w wyniku reakcji:
utlenienia 2-propanolu
utlenienia 1-propanolu
redukcji 2-propanolu
utlenienia gliceryny
21. Który z przedstawionych poniżej związków należy utlenić, aby otrzymać propanon (aceton) ?
1-propanol
2-propanol
propantriol
propanal
22. Proces odwrotny do zapisanego równaniem:
RCOOH + HO-R' → RCOOR' + H2O, to:
estryfikacja
hydroliza
zobojętnianie
hydratacja
23. Związek o wzorze
to:
tristearynian gliceryny
trioleinian gliceryny
tripalmitynian gliceryny
distearynian gliceryny
24. Tłuszcze proste zawierają w swoich cząsteczkach:
węgiel, wodór i tlen
węgiel, wodór, tlen i azot
węgiel, wodór, tlen i fosfor
tylko węgiel i wodór
25. W wyniku ogrzewania tłuszczu z nadmiarem NaOH otrzymujemy:
glicerynę i kwasy tłuszczowe
glicerynian sodu i kwasy tłuszczowe
glicerol i kwasy tłuszczowe
glicerynę i sole sodowe kwasów tłuszczowych
26. Mydła są produktami:
zasadowej hydrolizy tłuszczu
reakcji uwodornienia tłuszczu
reakcji estryfikacji wyższego kwasu tłuszczowego
reakcji utwardzania tłuszczu
27. Do mydeł nierozpuszczalnych w wodzie należy:
palmitynian sodu
stearynian potasu
oleinian sodu
palmitynian wapnia
28. W cząsteczce fruktozy występują grupy funkcyjne:
hydroksylowe i aldehydowa
hydroksylowe i karboksylowa
hydroksylowe i karbonylowa
tylko hydroksylowe
29. W wyniku reakcji hydrolizy glukozę można otrzymać z:
sacharozy
maltozy
celulozy
ze wszystkich substancji wymienionych w punktach a, b i c
30. Wybierz grupę zawierającą wyłącznie cukry proste:
glukoza, maltoza, ryboza
ryboza, fruktoza, galaktoza
galaktoza, sacharoza, maltoza
celuloza, skrobia, glukoza
31. W wyniku utleniania glukozy mocnym utleniaczem otrzymano:
alkohol heksahydroksylowy
kwas pentahydroksopentanokarboksylowy
aldehyd pentahydroksylowy
kwas tetrahydroksobutanodikarboksylowy
32. Skrobia jest wielocukrem, którego podstawową jednostką jest:
glukoza
fruktoza
ryboza
sacharoza
33. Właściwości redukujących nie wykazują następujące węglowodany:
glukoza i fruktoza
sacharoza i skrobia
glukoza i maltoza
maltoza i celobioza
34. Poniższy wzór Hawortha przedstawia cząsteczkę:
α,D-glukopiranoza
β,D-glukopiranoza
α,L-glukopiranoza
β,L-glukopiranoza
35. Produktami reakcji hydrolizy 1 mola maltozy są:
α,D-glukopiranoza i α,D-fruktofuranoza
2 mole α,D-glukopiranozy
2 mole β,D-glukopiranozy
α,D-glukopiranoza i β,D-fruktofuranoza
36. W wyniku redukcji fruktozy otrzymano:
sorbitol
mieszaninę sorbitolu i mannitolu
kwas cukrowy
kwas glukonowy
37. Ile asymetrycznych atomów węgla ma α,D-fruktofuranoza ?
3
4
5
6
38. Fruktozę można otrzymać w wyniku hydrolizy:
sacharozy
maltozy
celobiozy
wszystkich związków wymienionych w punktach a, b i c
39. Związek o wzorze 
zwany sorbitolem otrzymuje się z glukozy w wyniku reakcji:
utlenienia
zobojętnienia
hydrolizy
redukcji
40. Efekt Tyndalla można zaobserwować przepuszczając wiązkę światła przez wodne roztwory:
sacharozy
maltozy
skrobi
substancji wymienionych w punktach a i b
41. W wyniku całkowitej hydrolizy 1 mola dwucukru powstają dwa mole glukozy. Cukrem tym jest:
maltoza
sacharoza
laktoza
amyloza
42. Skrobia i celuloza wykazują podobieństwo w budowie. Obydwa związki zbudowane
są z:
reszt fruktozowych połączonych mostkami tlenowymi
reszt pentoz i heksoz
wielu cząsteczek maltozy
dużej liczby reszt glukozowych połączonych mostkami tlenowymi
43. Alanina ma następujący wzór chemiczny:
44. Wiązanie peptydowe przedstawia wzór:
45. Podstawowym wiązaniem łączącym aminokwasy w peptydy jest wiązanie:
wodorowe
amidowe
estrowe
peptydowe
46. Jaki proces zachodzi, gdy na białko działamy alkoholem etylowym w temperaturze pokojowej ?
kondensacja
estryfikacja
peptyzacja
denaturacja
47. Jaki jest wzór glicyny w środowisku kwaśnym ?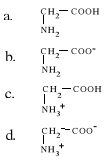
48. Anilina ma następujący wzór chemiczny: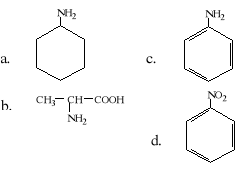
49. Anilina to nazwa zwyczajowa:
amidu kwasu benzoesowego
jednego z aminokwasów
aminobenzenu
tworzywa sztucznego
50. Związek o wzorze C6H5NO2 można otrzymać w reakcji:
aniliny i kwasu azotowego
benzenu i dwutlenku azotu
benzenu, kwasu siarkowego i azotowego
chlorobenzenu i kwasu azotowego
51. Który z poniższych związków nie wytworzy się w wyniku pełnej hydrolizy peptydu o wzorze ?![]()
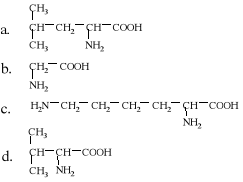
52. Liczba izomerycznych amin, odpowiadająca wzorowi C3H9N, wynosi:
2
3
4
6
53. Różnica między estrami kwasu azotowego, a nitrozwiązkami polega na tym że:
hydroliza obu związków przebiega z różną szybkością
hybrydyzacja atomu azotu w obu grupach związków jest różna
redukcja obu typów związków prowadzi do powstania różnych amin
różny jest sposób połączenia atomu azotu z grupy NO2 z atomem węgla
54. W podanym schemacie reakcji związki oznaczone symbolami literowymi, to:![]()
A: bromoetan, B: etanol, C: etanal, D: kwas etanowy, E: octan metylu
A: bromoeten, B: etanal, C: etanol, D: kwas octowy, E: octan etylu
A: bromometan, B: metanol, C: metanal, D: kwas metanowy, E: octan metylu
A: bromoetan, B: etanol, C: kwas etanowy, D: etanal, E: etenal
55. Utleniono pewien alkohol alifatyczny. Otrzymano kwas, który w reakcji z tym samym alkoholem daje związek o wzorze sumarycznym C4H8O2. Jaki alkohol został poddany utlenieniu ?
metanol
etanol
propanol
butanol
56. Propanal należy do szeregu homologicznego:
alkoholi
ketonów
aldehydów
amin
57. Który z podanych niżej związków jest końcowym produktem cyklu przemian ?
alkoholan
sól
ester
mydło
58. Mocznik jest:
estrem
aminokwasem
amidem kwasowym
ketonem
59. Glicyna jest to:
alkohol dihydroksylowy
aldehyd zawierający trzy atomy węgla
związek aromatyczny
aminokwas
60. Która z poniższych substancji nie ulega dysocjacji ?
stearynian sodu
octan magnezu
glukoza
kwas octowy
61. W wyniku zasadowej hydrolizy tłuszczu otrzymuje się:
glicerynę i wodę
mydło i glicerynę
kwas i wodę
kwas i glicerynę
62. Związek oznaczony symbolem D to:![]()
mrówczan metylu
mrówczan etylu
octan etylu
octan metylu
63. Analizowany związek organiczny ulega m.in. reakcji nitrowania i podstawiania oraz reaguje z zasadami tworząc sole hydrolizujące. Z soli tych może być wyparty kwasem węglowym. Wodny roztwór tego związku wykazuje odczyn kwaśny. Związkiem tym może być:
benzen
metylobenzen
hydroksybenzen
bromobenzen
64. Który z poniższych związków wykazuje czynność optyczną ?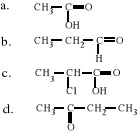
65. Triazotan gliceryny jest:
estrem
nitrozwiązkiem
amidem kwasowym
tłuszczem
66. Pewna klasa związków organicznych charakteryzuje się tym, że ich cząsteczki posiadają zdelokalizowany sekstet elektronowy. Przykładem tych związków jest:
cykloheksan
heksanol
aldoheksoza
chlorobenzen
67. Próba Tollensa, czyli tzw. reakcja lustra srebrowego umożliwia odróżnienie:
glukozy od rybozy
propanonu od propanalu
glukozy od maltozy
propanonu od propanolu
68. W którym z poniższych związków występuje asymetryczny atom węgla ?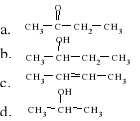
69. Z wodnym roztworem NaOH na zimno reaguje wyłącznie:
chlorobenzen
fenol
toulen
benzen
70. Który z poniższych związków może wykazywać czynność optyczną ?
kwas α-chloropropionowy
kwas β-chloropropionowy
kwas α,α-dichloropropionowy
chlorek kwasu propionowego
71. W którym szeregu, we właściwej kolejności napisano wzory ogólne: azotanów, azotynów, nitrozwiązków, amidów i amin ?
RONO, RNO2, RONO2, RNH2, RCONH2
RONO2, RONO, RNO2, RCONH2, RNH2
RCONH2, RNO2, RNH2, RONO, RONO2
RONO, RONO3, RNO2, RNH2, RCONH2
72. Który wzór przedstawia związek powstający w mięśniach podczas pracy fizycznej ?
CH3CH(NH2)COOH
C6H4(OH)COOH
C15H31COOH
CH3CH(OH)C
73. Mieszaniną nitrującą podziałano na:
I - benzen, II - ksylen, III - fenol, IV - toluen
Związki nitrowe otrzymano:
we wszystkich przypadkach
tylko w przypadkach I i II
tylko w przypadkach II i IV
tylko w przypadkach I i IV
74. Który z wymienionych związków jest końcowym produktem następujących przemian ? ![]()
moczniknitrobenzen
anilina
kwas aminooctowy
75. W reakcji: ![]()
substratem A jest:
n-butan
2-buten
butanal
1-butanol
76. W których z poniższych substancji występują wiązania wodorowe ?
węglowodory nasycone i fenole
węglowodory aromatyczne i cukry proste
cylkoalkany i cykloalkeny
kwasy nukleinowe i białka
77. Spośród wymienionych związków: I - kwas mlekowy, II - kwas pirogronowy,
III - aldotrioza, IV - mrówczan etylu, wzorem sumarycznym C3H6O3 można zapisać:
substancje I i II
substancje I i III
substancje II i IV
wszystkie substancje
78. Ustal wzory związków w przedstawionym schemacie:![]()
x y z
C3H7OH C3H6 C3H6Br2
C2H5OH C2H5OH C2H5Br
C3H7OH C3H5Br C3H5OH
C2H5OH C2H4(OH)2 C2H4(OH)2
79. Wzór CnH2nO opisuje:
alifatyczne nasycone aldehydy i ketony
wszystkie aldehydy i ketony
estry kwasów organicznych
alifatyczne nasycone etery
80. Symbolami X, Y, Z, W w ponizszym schemacie oznaczono:![]()
|
X |
Y |
Z |
W |
a |
aldehyd |
kwas |
amina |
amid |
b |
alkohol |
aldehyd |
sól |
amina |
c |
aldehyd |
kwas |
sól |
amid |
d |
alkohol |
aldehyd |
kwas |
sól |
3.9. Zadania z chemii organicznej
1. Węglowodór, który w warunkach normalnych jest gazem o gęstości 2,59 g/dm3
i zawiera 82,8% węgla to:
propan
butan
pentan
buten
2. Spalono 8 g pewnej substancji organicznej, otrzymując 5,6 dm3 dwutlenku węgla (warunki normalne) oraz 9 g wody. Wskazać najprostszy wzór sumaryczny tej substancji:
CH4
CH4O
C2H6O
CH2O
3. Jaką masę molową ma alkohol typu ROH, jeśli w wyniku reakcji
2ROH + 2Na → 2RONa + H2
z 23 g alkoholu, sód wypiera 5,6 dm3 gazowego wodoru (warunki normalne)?
23 g
46 g
69 g
92 g
4. Spalono 11,2 dm3 pewnego węglowodoru i uzyskano 22,4 dm3 CO2 i 27 g H2O. Objętości gazów mierzono w warunkach normalnych. Spalony węglowodór miał wzór:
C4H6
C4H10
C2H6
C2H4
5. Spalając 2,8 dm3 pewnego gazowego węglowodoru uzyskano 8,4 dm3 dwutlenku węgla (w warunkach normalnych) i 4,5 g wody.
Spalonym węglowodorem był:
C3H4
C2H2
C3H6
C2H6
6. Podczas działania 1 mola Br2 na 1 mol pewnego węglowodoru otrzymano tylko jeden produkt reakcji - substancję o masie cząsteczkowej 202 u.
Reakcji bromowania został poddany:
benzen
propen
butan
2-buten
7. Który z poniższych węglowodorów jest (w warunkach normalnych) gazem
o gęstości 2,02 g/dm3 i zawiera 81,8% węgla ?
C4H8
C2H6
C4H10
C3H8
8. Z 5,75 g sodu przereagowało całkowicie 18,5 g pewnego alkoholu. Alkohol ten miał następujący wzór sumaryczny:
C4H9OH
C2H5OH
C3H7OH
CH3OH
9. Jaka objętość (warunki normalne) tlenu jest konieczna do całkowitego spalenia 2 moli etanu ?
122,4 dm3
156,8 dm3
144,8 dm3
178,4 dm3
10. Jaką masę karbidu zawierającego 10% zanieczyszczeń, należy zużyć
na wytworzenie 1 m3 acetylenu w warunkach normalnych ?
3,17 kg
3,17 g
6,34 kg
6,34 g
11. Zakładając, że gaz którym napełniane są butle turystyczne, jest czystym butanem, oblicz, jaka objętość tlenu jest niezbędna do całkowitego spalenia
1 kg tego gazu.
386 dm3
2,5 m3
2,5 dm3
3,9 m3
12. Po przepuszczeniu etylenu (etenu) przez roztwór wody bromowej masa naczynia z wodą bromową wzrosła o 1,4 g. Ile dm3 etylenu (w warunkach normalnych) przereagowało z bromem ?
2,24 dm3
1,12 dm3
22,4 dm3
11,2 dm3
13. W wyniku reakcji 8,0 g alkoholu jednohydroksylowego z sodem metalicznym wydzieliło się 2,8 dm3 wodoru (w warunkach normalnych). Masa molowa tego alkoholu wynosiła:
32 g/mol
46 g/mol
60 g/mol
74 g/mol
14. Roztwór zawierający 2,2 g pewnego aldehydu zmieszano z Cu(OH)2 i ogrzano. Wytrącony w reakcji Cu2O ważył 7,15 g. Podaj wzór aldehydu.
CH3CHO
HCHO
CH3CH2CHO
C3H7CHO
15. Na 2,4 g pewnego aldehydu podziałano amoniakalnym roztworem tlenku srebra otrzymując 8,94 g metalicznego srebra. Aldehydem tym był:
metanal
etanal
propanal
butanal
16. Jaką objętość 30% roztworu aldehydu octowego o gęstości 1,1 g/cm3 utleniono do kwasu octowego, jeśli na zobojętnienie powstałego kwasu zużyto 20 cm3 roztworu NaOH o stężeniu 2,0 mol/dm3 ?
2,8 cm3
5,3 cm3
10,6 cm3
12,8 dm3
17. Jaką objętość zajmie wodór (warunki normalne) niezbędny do uwodornienia
2 moli kwasu oleinowego ?
22,4 dm3
44,8 dm3
11,2 dm3
5,6 dm3
18. Na zobojętnienie 100 cm3 roztworu, zawierającego 33 g kwasu dikarboksylowego w 1 dm3, zużyto 25 cm3 roztworu NaOH o stężeniu
2 mol/dm3. Wzór sumaryczny tego kwasu był następujący:
C5H8O4
C3H4O4
C2H2O4
C4H6O4
19. Ile gramów octanu etylu można otrzymać z 5,6 dm3 acetylenu jako jedynego substratu organicznego ?
11 g
22 g
5,5 g
3,3 g
20. Ile cm3 alkoholu etylowego o gęstości 0,8 g/cm3 i stężeniu 80% można otrzymać z 1 kg glukozy, jeśli wydajność procesu wynosi 60% ?
240 cm3
192 cm3
384 cm3
479 cm3
21. Ile kg glukozy zużyto, jeśli otrzymano 2 dm3 roztworu etanolu o gęstości
0,75 g/cm3 i stężeniu 70%, przy sumarycznej wydajności procesu równej
60% ?
2,05 kg
2,50 kg
3,42 kg
1,05 kg
22. W wyniku hydrolizy sacharozy otrzymano 5,1 kg fruktozy. Ile sacharozy wzięto do reakcji ?
9,7 kg
10,2 kg
2,55 kg
7,65 kg
23. Jaką objętość CO2 (w warunkach normalnych) można maksymalnie otrzymać
w wyniku fermentacji alkoholowej próbki glukozy, jeśli w procesie tym otrzymano 23 g etanolu ?
22,4 dm3
11,2 dm3
44,8 dm3
5,6 dm3
24. Ile moli wodoru przereaguje z 1/3 mola nitrobenzenu, jeśli produktem reakcji jest anilina ?
1/3 mola
1 mol
3 mole
6 moli
25. Ile moli wodoru należy użyć w celu zredukowania 88 g aldehydu octowego ?
0,5 mola
1 mol
2 mole
4 mole
3.10. Test sprawdzający
1. Jądro jonu składa się z:
16 protonów i 18 elektronów
16 protonów i 16 elektronów
16 protonów i 32 nukleonów
16 protonów i 16 neutronów
2. Pierwiastek X o liczbie atomowej 20 może utworzyć tlenek o wzorze:
X2O
XO
XO2
X2O3
3. Który z poniższych zapisów przedstawia konfigurację elektronową jonu Y−, jeśli wiadomo, że pierwiastek o symbolu Y znajduje się w III okresie i VII grupie głównej układu okresowego ?
1s22s22p63s23p6
1s22s22p63s23p5
1s22s22p63s23p7
1s22s22p63s23p3
4. 16 gramów to masa:
6,02⋅1023 cząsteczek tlenu w warunkach normalnych
6,02⋅1023 atomów tlenu w warunkach normalnych
12,04⋅1023 atomów tlenu w warunkach normalnych
12,04⋅1023 cząsteczek tlenu w warunkach normalnych
5. W której z poniższych cząsteczek związków chemicznych występuje zarówno wiązanie jonowe, atomowe spolaryzowane jak i koordynacyjne ?
HNO3
KNO3
HClO4
Mg(OH)Cl
6. W której z poniższych grup, wszystkie tlenki reagują z KOH ?
BaO, SO2, CO2
NO, NO2, N2O3
N2O5, SO3, Al2O3
Li2O, CO, P2O5
7. Która z poniższych reakcji nie przebiegnie ?
NH4NO3 + P2O5 →
NaCl + H2SO4 →
Cu + HCl →
Na2SO4 + CaCl2 →
8. W celu uzyskania soli obojętnej z 1 mola diwodoroortofosforanu wapnia należy dodać:
2 mole Ca(OH)2
1 mol Ca(OH)2
1 mol H3PO4
2 mole H3PO4 i 2 mole Ca(OH)2
9. Kwas azotawy jest słabym elektrolitem. Wskaż stężenie roztworu, w którym jego stopień dysocjacji jest najmniejszy:
1 mol/dm3
0,1 mol/dm3
0,01 mol/dm3
stopień dysocjacji nie należy od stężenia roztworu
10. W 4 probówkach umieszczono po 10 cm3 0,1 molowych roztworów następujących związków: I - ZnCl2, II - Mg(NO3)2, III - FeCl2, IV - NH4NO3. Do każdej probówki dodano nadmiar roztworu NaOH. Osad pojawił się
w probówkach:
I i II
II i III
III i IV
IV i I
11. W którym z poniższych punktów przedstawiono właściwe współczynniki stechiometryczne równania ?
xH2O2 + yFe2+ + zH+ → wFe3+ + nH2O
x y z w n
1 3 4 3 2
2 4 4 4 4
1 2 2 2 2
2 6 4 6 4
12. W którym z poniższych zestawów podano jony o właściwościach jedynie redukujących ?
Fe2+, H+, Na+
S2−, ClO4−, Cu2+
Cl−, NO2−, NO3−
J−, S2−, Br−
13. W wodnym roztworze azotynu potasu przebiegają następujące procesy:
dysocjacja elektrolityczna
hydroliza
hydratacja
wszystkie wymienione powyżej
14. H2O − 2e → 1/2O2 + 2H+ to reakcja:
katodowego utleniania wody
anodowego utleniania wody
katodowej redukcji wody
anodowej redukcji wody
15. W czasie elektrolizy wodnego roztworu nadchloranu sodu na katodzie:
redukuje się woda i wydziela tlen
redukuje się sód i powstają jony OH−
redukuje się woda i wydziela wodór
wszystkie powyższe reakcje przebiegają jednocześnie
16. Nadchloranu potasu nie można otrzymać w reakcji:
Cl2O7 + K2O →
HClO4 + K2O →
KOH + Cl2O5 →
KOH + Cl2O7 →
17. Roztwór rzeczywisty różni się od układu koloidalnego:
wielkością cząsteczek rozpuszczalnika
wielkością cząsteczek substancji rozpuszczonej
stanem skupienia
wszystkie odpowiedzi są poprawne
18. Odczyn kwaśny mają wodne roztwory soli podanych w zestawie:
NaHSO4, Na2SO3, KNO3
MnCl2, KHSO4, NH4NO3
NaHCO3, Mg(OH)Cl, KCl
AlCl3, Mn(NO3)2, Na2S
19. Która z poniższych reakcji nie przebiegnie ?
Al(OH)3 + NH4OH →
PbO + NaOH →
Zn(OH)2 + KOH →
Al2O3 + KOH →
20. W ogniwie złożonym z elektrody cynkowej i wodorowej przebiegają następujące reakcje:
2H+ + 2e → H2, Zn − 2e → Zn2+
H2 − 2e → 2H+, Zn − 2e → Zn2+
H2 − 2e → 2H+, Zn2+ + 2e → Zn
2H+ + 2e → H2, Zn2+ + 2e → Zn
21. Tlenki, w temperaturze pokojowej, występują w stanie skupienia:
stałym
ciekłym
gazowym
wszystkich wymienionych powyżej
22. Ile gramów miedzi wzięło udział w reakcji z rozcieńczonym kwasem azotowym, jeśli w tej reakcji powstało 2,8 dm3 NO ?
12 g
8 g
6 g
4 g
23. Jaką objętość 1 molowego HCl należy zużyć na rozpuszczenie 2,4 g magnezu ?
10 cm3
100 cm3
20 cm3
200 cm3
24. Jakie jest stężenie molowe roztworu powstałego przez zmieszanie: 200 cm3
0,01 molowego HCl z 2 cm3 37% roztworu HCl, o gęstości 1,18 g/cm3 i 20 cm3 roztworu zawierającego 0,001 mola kwasu solnego ?
0,135 mol/dm3
0,122 mol/dm3
0,148 mol/dm3
0,110 mol/dm3
25. Spalono 3,6 g węgla, a uzyskany gaz rozpuszczono w wodzie otrzymując 2 dm3 roztworu kwasu. Jego stężenie wynosiło:
0,15 mol/dm3
1,8 mol/dm3
1,5 mol/dm3
0,18 mol/dm3
26. Jaką objętość amoniaku (w warunkach normalnych) można uzyskać mając
do dyspozycji po 3 dm3 wodoru i azotu ?
3 dm3
6 dm3
2 dm3
1,5 dm3
27. 2,22 g CaCl2 rozpuszczono w wodzie uzyskując 200 cm3 roztworu o stężeniu molowym:
0,1 mol/dm3
11,1 mol/dm3
1,11 mol/dm3
0,01 mol/dm3
28. W jakim stosunku masowym należy zmieszać 10% roztwór HCl z 25% aby uzyskać roztwór o stężeniu 20% ?
2 : 1
1 : 2
2 : 3
3 : 2
29. Ile gramów wapnia rozpuszczono w wodzie, jeśli na zobojętnienie powstałej zasady zużyto 150 cm3 0,1 molowego roztworu HCl ?
0,1 g
0,2 g
0,3 g
1,0 g
30. Ile gramów AgCl można otrzymać, mając do dyspozycji 10 cm3 2% roztworu HCl o gęstości 1,02 g/cm3 ?
0,8 g
1,6 g
0,4 g
0,6 g
31. Elektrolizę 20 cm3 0,1 molowego roztworu NaCl prowadzono do całkowitego wydzielenia chloru. Jaką objętość zajęły gazy powstałe w czasie tej elektrolizy?
44,8 cm3
22,4 cm3
448 cm3
222 cm3
32. Jaką objętość 40% roztworu NaOH o gęstości 1,4 g/cm3 trzeba zużyć w celu przygotowania 500 cm3 roztworu o stężeniu 0,5 mol/dm3 ?
17,86 cm3
178,6 cm3
8,93 cm3
89,3 cm3
33. Pierwszym w szeregu homologicznym ketonów jest:
metanal
etanal
propanon
etanon
34. Reakcja nitrowania jest reakcją:
addycji
substytucji
eliminacji
estryfikacji
35. W wyniku reakcji HBr z 1-butenem powstaje:
1-bromobutan
1-bromobuten
2-bromobutan
2-bromobuten
36. Które z poniższych związków wykazują czynność optyczną ?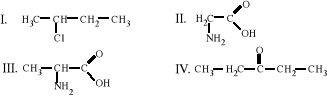
I i II
II i III
IV i III
I i III
37. Poniższy węglowodór ![]()
to:
2,3-dimetylopentan
2-metylo-3-etylobutan
3,4-dimetylopentan
2-etylo-3-metylobutan
38. Z roztworem zasady sodowej nie reaguje:
fenol
glicyna
metanol
tripalmitynian gliceryny
39. Związkami dwufunkcyjnymi są:
hydroksykwasy i aminy
aminokwasy i węglowodany
aldehydy i ketony
tłuszcze i mydła
40. Poniższym wzorom ogólnym przyporządkuj odpowiednie nazwy związków organicznych:
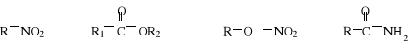
a. |
azotany |
estry |
etery |
aminy |
b. |
nitrozwiązki |
estry |
estry |
amidy |
c. |
azotyny |
etery |
nitrozwiązki |
aminokwasy |
d. |
estry |
kwasy |
azotyny |
amidy |
41. Kwasu propanowego nie można otrzymać w wyniku reakcji:
hydrolizy propionianu metylu
utleniania 2-propanolu
utleniania propanalu
w żadnej z powyższych reakcji
42. Atomy węgla o hybrydyzacji sp2 nie mogą występować w:
alkanach
alkenach
alkadienach
węglowodorach aromatycznych
43. Poniżej przedstawiono wzór strukturalny:![]()
glicyny w środowisku kwaśnym
alaniny w środowisku kwaśnym
glicyny w środowisku obojętnym
alaniny w środowisku obojętnym
44. W wyniku redukcji fruktozy otrzymano:
alkohol heksahydroksylowy
mieszaninę dwóch alkoholi heksahydroksylowych
kwas monokarboksylowy
kwas dikarboksylowy
45. Które z poniższych węglowodanów mają właściwości redukujące ?
glukoza i maltoza
maltoza i sacharoza
sacharoza i fruktoza
skrobia i celuloza
46.
Które z poniższych związków odpowiadają symbolom A, B, C i D ?
|
A |
B |
C |
D |
a. |
etanol |
kwas octowy |
octan amonu |
etylo amina |
b. |
etenol |
etanal |
octan amonum |
etyloamina |
c. |
etanal |
kwas octowy |
amid kwasu octowego |
N-metyloamid kwasu octowego |
d. |
etanal |
kwas octowy |
octan amonu |
amid kwasu octowego |
47. W wyniku spalenia 10 g pewnego związku organicznego otrzymano 9,74 dm3 CO2 i 11,74 g H2O. Spalonym związkiem był:
C2H6
C2H5OH
C3H6O
CH3COOH
48. Jaka objętość wodoru (w warunkach normalnych) jest niezbędna do otrzymania 9,3 g aniliny z nitrobenzenu ?
4,48 dm3
22,4 dm3
2,24 dm3
6,72 dm3
49. Z glukozy otrzymano alkohol etylowy, który następnie utleniono do kwasu octowego. Na zobojętnienie powstałego kwasu zużyto 15 cm3 2 molowego roztworu KOH. Ile gramów glukozy wzięło udział w reakcji, jeśli sumaryczna wydajność procesu otrzymywania kwasu z glukozy wynosi 70% ?
3,9 g
2,7 g
7,7 g
5,4 g
50. 5 gramów mieszaniny propanalu i propanonu poddano reakcji z amoniakalnym roztworem Ag2O, otrzymując 10,8 g srebra. Jaki % analizowanej mieszaniny stanowił propanon ?
42%
21%
58%
79%
3.11. EGZAMIN WSTĘPNY 1995.
Uwaga ! przy rozwiązywaniu zadań należy korzystać z niżej podanych wartości mas atomowych: H - 1, C - 12, N - 14, O - 16, Na - 23, Mg - 24, P - 31, S - 32, Cl - 35,5, K - 39, Ca - 40, Fe - 56, Cu - 63,5, Zn - 65, Br - 80, Ag - 108;
1. Z podanych zdań wybierz fałszywe:
proton jest trwałą cząstką elementarną
proton ma dodatni ładunek elektryczny
masa protonu jest około 1836 razy mniejsza od masy elektronu
proton wchodzi w skład jądra atomowego
2. Jon magnezu 12Mg2+ różni się od atomu magnezu tym, że:
ma na zewnętrznej powłoce 2 elektrony, podczas gdy atom ma ich 8
ma na zewnętrznej powłoce 8 elektronów, podczas gdy atom ma ich 2
ma o 2 elektrony więcej niż atom
na zewnętrznej powłoce nie ma w ogóle elektronów walencyjnych, a atom ma ich osiem
3. Pierwiastek chemiczny VII grupy głównej tworzy tlenek X2O7. Wskaż wzór jego połączenia z wodorem:
HX
XH7
X2H7
H4X
4. Pewien tlenek azotu zawiera 25,92 % azotu. Wartościowość azotu w tym związku wynosi:
I
II
IV
V
5. Atomy o identycznej liczbie atomowej i różnej liczbie masowej to:
izotony
izobary
izotopy
nuklidy
6. Wybierz grupę atomów i jonów o jednakowej konfiguracji elektronowej
1s2 2s2 2p6 3s2 3p6 :
18Ar, 12Mg2+, 17Cl
35Br, 37Rb+ , 36Kr
18Ar, 16S2, 20Ca2+
18Ar, 17Cl, 13Al3+
7. Pierwiastek, którego liczba porządkowa wynosi 16, może występować na następujących stopniach utlenienia:
-1, +5, +6
-2, +4, +6
-4, +4, +6
-3, +4, +5
8. Elektrony podpowłoki d mogą charakteryzować się następującymi wartościami magnetycznej liczby kwantowej:
−1, 0, 1
−3, −2, −1, 0, 1, 2, 3
−2, −1, 0, 1, 2
0
9. Spośród związków chemicznych oznaczonych cyframi od I do V:
I: H2O II: CO2 III: CS2 IV: CCl4 V: NH3
moment dipolowy równy zero wykazują cząsteczki:
III i IV
II, III i IV
I i V
III, IV i V
10. Wiązanie koordynacyjne polega na tym, że
atomy uwspólniają po więcej niż jednym elektronie
atomy uwspólniają po jednej parze elektronowej
jeden atom oddaje parę elektronową drugiemu atomowi
wspólna para elektronowa pochodzi od jednego z atomów
11. Do czterech probówek z kwasem solnym wrzucono po 1 g następujących metali: I. Ca, II - Mg, III - Zn, IV - Cu. W której probówce wydzieliło się najwięcej wodoru:
I
II
III
IV
12. Jaka jest procentowa zawartość 20Ne i 22Ne w naturalnym neonie, którego masa atomowa wynosi 20,2 u ?:
90 % 20Ne, 10 % 22Ne
10 % 20Ne, 90 % 22Ne
20 % 20Ne, 80 % 22Ne
50 % 20Ne, 50 % 22Ne
13. W reakcji, której przebieg opisano równaniem:
8 HI + H2SO4 → 4 I2 + H2S + 4 H2O
utleniaczem jest:
HI
I2
H2SO4
H2S
14. Suma współczynników stechiometrycznych w równaniu reakcji:
...KMnO4 + ...H2SO4 + ... H2O2 → ...MnSO4 + ...H2O + ...O2 + ...K2SO4
wynosi:
26
28
16
22
15. Które z podanych poniżej równań reakcji chemicznych ilustrują procesy utleniania
i redukcji ?
I. SO2 + H2O → H2SO3
II. S + O2 → SO2
III. 2 SO2 + O2 → 2 SO3
IV. S2 Co2+ → CoS
I, II, III
II, III
I, IV
III, IV
16. W reakcji sodu z wodą otrzymano 1,204 x 1023 cząsteczek wodoru. Masa sodu użytego w reakcji wynosiła:
4,6 g
0,4 g
23 g
9,2 g
17. Wiedząc, jak zmienia się aktywność pierwiastków w grupie fluorowców, ustal które z poniższych reakcji chemicznych są możliwe do przeprowadzenia:
I. 2 Cl− + Br2 → 2 Br− + Cl2
II. 2 Br− + Cl2 → 2 Cl− + Br2
III. 2 Br− + I2 → 2 /I− + Br2
IV. 2 I− + Br2 → 2 Br− + I2
I, III
II, IV
II, III
I, IV
18. Jaką objętość, w przeliczeniu na warunki normalne, zajął CO2 wydzielony podczas termicznego rozkładu 20 g CaCO3 ?
4,48 dm3
4,48 cm3
22,4 dm3
44,8 cm3
19. Zmieszano 100 g 3 % roztworu kwasu solnego z 50 g 12 % roztworu tego kwasu. Otrzymano roztwór o stężeniu:
5 %
7 %
4 %
6 %
20. Ile gramów NaNO3 należy odważyć w celu przygotowania 400 cm3 roztworu
o stężeniu 0,200 mol/dm3 ?
8,5 g
7,0 g
6,8 g
3,4 g
21. 5 cm3 roztworu NaOH o stężeniu 40 % i gęstości 1,40 g/cm3 rozcieńczono wodą do objętości 200 cm3. Stężenie otrzymanego roztworu wynosi:
0,50 mol/dm3
0,35 mol/dm3
0,25 mol/dm3
0,52 mol/dm3
22. Ile cm3 0,30 molowego roztworu kwasu siarkowego jest potrzebne
do zobojętnienia 100 cm3 roztworu KOH o stężeniu 0,15 mol/dm3 ?
12,5 cm3
25 cm3
30 cm3
50 cm3
23. Według teorii Br*nsteda sprzężoną parę zasada - kwas przedstawiają:
NH3 i NH4+
PO43− i HPO42−
HS− i H2S
wszystkie powyższe pary
24. Chlorek amonu po rozpuszczeniu w wodzie ulega procesom:
dysocjacji elektrolitycznej
hydratacji
hydrolizy
wszystkim wyżej wymienionym
25. Produktem reakcji dwóch moli KOH z jednym molem H3PO4 jest:
diwodoroortofosforan potasu
ortofosforan potasu
wodoroortofosforan potasu
pirofosforan potasu
26. Roztwór kwasu o wzorze HR zawiera 0,30 mola jonów R− i 3,0 mole niezdysocjowanych cząsteczek HR. Stopień dysocjacji elektrolitycznej
tego kwasu wynosi:
0,091
0,182
0,010
0,100
27. Wskaż zestaw, w którym wszystkie wymienione sole ulegają reakcji hydrolizy:
KCl, FeCl3, HCOOK
NaNO2, CH3COOK, Na2CO3
NaNO3, K2CO3, CaS
Zn(NO3)2, K2SO4, KCN
28. Które z poniższych metali będą reagowały zarówno z rozcieńczonym kwasem solnym, jak i azotowym ?
Zn, Cu, Al
Fe, Pb, Ag
Zn, Fe, Pb
Sn, Au, Zn
29. Ile gramów Fe2+ znajdowało się w roztworze, jeśli na ich utlenienie
w środowisku kwaśnym zużyto 20 cm3 0,1 molowego roztworu KMnO4 ?
0,224 g
0,280 g
0,112 g
0,560 g
30. Reakcja elektrodowa 2H2O + 2e → 2OH− + H2 zachodzi w trakcie elektrolizy wodnego roztworu:
NaOH, na katodzie
NaOH, na anodzie
HNO3, na katodzie
HNO3, na anodzie
31. Sód można otrzymać w czasie elektrolizy:
stopionego NaCl
wodnego roztworu NaCl
wodnego roztworu NaOH
poprawna jest odpowiedź b i c
32. Jakie było stężenie molowe roztworu AgNO3, jeśli blaszka cynkowa, zanurzona do 200 cm3 tego roztworu zwiększyła swą masę o 1,0 g ?
0,05 mol/dm3
0,07 mol/dm3
0,10 mol/dm3
0,01 mol/dm3
33. Z zasadą sodową reagują następujące wodorotlenki:
Ca(OH)2, Zn(OH)2, NH4OH
KOH, Al(OH)3, Cu(OH)2
Zn(OH)2, Al(OH)3, Pb(OH)2
Fe(OH)2, Cu(OH)2, Pb(OH)2
34. Stop glinu z magnezem rozpuszczono w kwasie solnym. Do otrzymanego roztworu dodano w nadmiarze roztwór NaOH. W jakiej postaci znajduje się glin po zakończeniu reakcji ?
w roztworze jako aniony Al(OH)4−
w osadzie jako Al(OH) 3
w roztworze jako kationy Al3+
stop glinu i magnezu nie rozpuszcza się w roztworze HCl
35. Która z poniższych reakcji nie zachodzi ?
CaCO3 + HCl →
AgNO3 + NaCl →
Na2SO4 + HCl →
AgNO3 + H2S →
36. Twardość wody powodują:
rozpuszczone sole żelaza i manganu
kationy magnezu i wapnia
aniony siarczanowe i fosforanowe
kationy żelaza i manganu
37. Bezwodnik kwasowy i zasadowy można otrzymać w wyniku prażenia:
KOH CuO, temp. próba Tollensa
Mg(OH)2
H2O2
CaCO3
KCl
38. W wyniku całkowitego spalenia 0,5 mola pewnego cukru otrzymano 67,2 dm3 CO2 (warunki normalne). Cukrem tym była:
trioza
tetroza
pentoza
heksoza
39. W cząsteczce acetylenu występują:
jedno wiązanie σ (sigma) i dwa wiązania π (pi)
trzy wiązania σ (sigma) i dwa wiązania π (pi)
jedno wiązanie σ (sigma) i trzy wiązania π (pi)
wyłącznie wiązania σ (sigma)
40. Wzór strukturalny
przedstawia:
3-metylo-2-heksen
4-metylo-4-heksen
4-etylo-3-metylo-2-buten
1-etylo-2-metylo-2-buten
41. Spalono 6,51 mg pewnego węglowodoru, otrzymując 20,47 mg CO2 i 8,36 mg wody. Masa cząsteczkowa tego związku wynosi 28 u. Wskazać, który to węglowodór:
etan
eten
metan
acetylen
42. Roztwór zawierający 2,2 g pewnego aldehydu zmieszano z Cu(OH)2 i ogrzano. W wyniku reakcji powstało 7,15 g Cu2O. Wzór aldehydu był następujący:
CH3CHO
HCHO
CH3CH2CHO
C3H7CHO
43. Spośród wymienionych związków: I - kwas mlekowy, II - kwas pirogronowy,
III - aldotrioza, IV - mrówczan etylu, wzorem sumarycznym C3H6O3 można zapisać:
substancje I i II
substancje I i III
substancje II i IV
wszystkie substancje
44. Reguła Markownikowa znajduje zastosowanie przy addycji fluorowcowodoru do:
2-butenu
propenu
3-heksenu
etenu
45. W wyniku zasadowej hydrolizy tłuszczu otrzymujemy:
glicerynę i kwasy tłuszczowe
sole kwasów tłuszczowych i glicerynę
kwas octowy i wyższe alkohole
kwasy tłuszczowe i etanol
46. Reakcja ksantoproteinowa jest charakterystyczna dla:
białek
estrów
aldehydów
cukrów
47. Alkoholem drugorzędowym jest:
3-metylo-1-butanol
3-metylo-3-heksanol
2-metylo-2-pentanol
3-metylo-2-butanol
48. Cząsteczki monosacharydu w celulozie są połączone wiązaniem:
estrowym
eterowym
glikozydowym
tlen-tlen
49. W wyniku reakcji 1-propanolu z kwasem mrówkowym otrzymujemy:
mrówczan propylu
propionian metylu
propionian etylu
etanolan propylu
50. W poniższym schemacie reakcji chemicznych:
X ____−> Y ____−> Z ____−> CH3COOH
substratem X jest:
chlorek etylu
alkohol etylowy
aldehyd octowy
alkohol metylowy
Odpowiedzi
3.1. Podstawowe pojęcia chemiczne. Budowa atomu. Układ okresowy
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
c |
18 |
c |
35 |
c |
52 |
b |
69 |
b |
2 |
c |
19 |
b |
36 |
c |
53 |
c |
70 |
a |
3 |
c |
20 |
c |
37 |
d |
54 |
a |
71 |
a |
4 |
c |
21 |
d |
38 |
d |
55 |
c |
72 |
d |
5 |
b |
22 |
b |
39 |
c |
56 |
a |
73 |
c |
6 |
d |
23 |
b |
40 |
d |
57 |
c |
74 |
a |
7 |
c |
24 |
b |
41 |
a |
58 |
b |
75 |
c |
8 |
a |
25 |
b |
42 |
a |
59 |
d |
76 |
a |
9 |
b |
26 |
a |
43 |
d |
60 |
a |
77 |
b |
10 |
a |
27 |
c |
44 |
a |
61 |
c |
78 |
a |
11 |
c |
28 |
d |
45 |
b |
62 |
b |
79 |
c |
12 |
d |
29 |
c |
46 |
c |
63 |
c |
80 |
a |
13 |
d |
30 |
b |
47 |
c |
64 |
a |
81 |
c |
14 |
c |
31 |
a |
48 |
d |
65 |
a |
82 |
c |
15 |
c |
32 |
b |
49 |
a |
66 |
d |
83 |
c |
16 |
b |
33 |
c |
50 |
b |
67 |
c |
84 |
b |
17 |
a |
34 |
d |
51 |
a |
68 |
c |
85 |
b |
3.2. Wiązania chemiczne
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
a |
6 |
a |
11 |
d |
16 |
b |
21 |
d |
2 |
b |
7 |
d |
12 |
c |
17 |
d |
22 |
c |
3 |
c |
8 |
a |
13 |
d |
18 |
a |
23 |
a |
4 |
d |
9 |
a |
14 |
d |
19 |
d |
24 |
a |
5 |
d |
10 |
a |
15 |
b |
20 |
d |
25 |
d |
3.3 Roztwory i ich stężenia
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
c |
11 |
b |
21 |
c |
31 |
c |
41 |
d |
2 |
d |
12 |
d |
22 |
b |
32 |
b |
42 |
a |
3 |
c |
13 |
d |
23 |
b |
33 |
a |
43 |
a |
4 |
d |
14 |
c |
24 |
d |
34 |
a |
44 |
c |
5 |
d |
15 |
a |
25 |
c |
35 |
b |
45 |
b |
6 |
b |
16 |
b |
26 |
c |
36 |
c |
46 |
c |
7 |
d |
17 |
b |
27 |
c |
37 |
a |
47 |
a |
8 |
c |
18 |
c |
28 |
b |
38 |
a |
48 |
d |
9 |
c |
19 |
a |
29 |
d |
39 |
b |
49 |
a |
10 |
b |
20 |
c |
30 |
b |
40 |
a |
50 |
c |
3.4. Reakcje w roztworach elektrolitów
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
b |
31 |
b |
61 |
b |
91 |
c |
121 |
a |
2 |
a |
32 |
a |
62 |
b |
92 |
c |
122 |
c |
3 |
a |
33 |
a |
63 |
b |
93 |
c |
123 |
b |
4 |
a |
34 |
a |
64 |
d |
94 |
b |
124 |
d |
5 |
a |
35 |
b |
65 |
c |
95 |
c |
125 |
c |
6 |
b |
36 |
a |
66 |
b |
96 |
a |
126 |
d |
7 |
b |
37 |
a |
67 |
c |
97 |
d |
127 |
b |
8 |
b |
38 |
d |
68 |
b |
98 |
a |
128 |
d |
9 |
b |
39 |
c |
69 |
c |
99 |
a |
129 |
c |
10 |
d |
40 |
c |
70 |
b |
100 |
b |
130 |
c |
11 |
b |
41 |
b |
71 |
b |
101 |
b |
131 |
b |
12 |
d |
42 |
d |
72 |
c |
102 |
c |
132 |
c |
13 |
d |
43 |
a |
73 |
c |
103 |
b |
133 |
a |
14 |
d |
44 |
d |
74 |
a |
104 |
c |
134 |
d |
15 |
d |
45 |
c |
75 |
d |
105 |
c |
135 |
a |
16 |
a |
46 |
a |
76 |
c |
106 |
b |
136 |
c |
17 |
d |
47 |
b |
77 |
b |
107 |
b |
137 |
d |
18 |
d |
48 |
b |
78 |
c |
108 |
c |
138 |
b |
19 |
c |
49 |
b |
79 |
c |
109 |
b |
139 |
b |
20 |
b |
50 |
a |
80 |
b |
110 |
c |
140 |
b |
21 |
b |
51 |
a |
81 |
a |
111 |
c |
141 |
b |
22 |
d |
52 |
d |
82 |
c |
112 |
d |
142 |
d |
23 |
d |
53 |
a |
83 |
c |
113 |
c |
143 |
d |
24 |
d |
54 |
a |
84 |
d |
114 |
b |
144 |
a |
25 |
c |
55 |
b |
85 |
b |
115 |
b |
145 |
d |
26 |
c |
56 |
d |
86 |
c |
116 |
a |
146 |
c |
27 |
d |
57 |
a |
87 |
c |
117 |
c |
147 |
a |
28 |
c |
58 |
a |
88 |
a |
118 |
a |
148 |
b |
29 |
c |
59 |
b |
89 |
d |
119 |
c |
149 |
b |
30 |
c |
60 |
b |
90 |
b |
120 |
c |
150 |
a |
3.5. Elektroliza i ogniwa
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
b |
8 |
d |
15 |
a |
22 |
b |
29 |
a |
2 |
c |
9 |
b |
16 |
d |
23 |
a |
30 |
c |
3 |
c |
10 |
c |
17 |
a |
24 |
b |
31 |
c |
4 |
b |
11 |
b |
18 |
d |
25 |
b |
32 |
a |
5 |
d |
12 |
a |
19 |
d |
26 |
c |
33 |
d |
6 |
b |
13 |
d |
20 |
d |
27 |
a |
34 |
b |
7 |
a |
14 |
c |
21 |
a |
28 |
c |
35 |
b |
3.6. Związki nieorganiczne i ich właściwości chemiczne
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
b |
22 |
a |
43 |
c |
64 |
b |
85 |
c |
2 |
d |
23 |
c |
44 |
b |
65 |
c |
86 |
d |
3 |
c |
24 |
a |
45 |
c |
66 |
b |
87 |
d |
4 |
b |
25 |
d |
46 |
d |
67 |
b |
88 |
a |
5 |
c |
26 |
b |
47 |
d |
68 |
b |
89 |
c |
6 |
c |
27 |
d |
48 |
d |
69 |
a |
90 |
d |
7 |
d |
28 |
a |
49 |
b |
70 |
b |
91 |
d |
8 |
b |
29 |
b |
50 |
a |
71 |
c |
92 |
a |
9 |
b |
30 |
d |
51 |
d |
72 |
c |
93 |
d |
10 |
b |
31 |
a |
52 |
c |
73 |
d |
94 |
c |
11 |
c |
32 |
c |
53 |
c |
74 |
c |
95 |
c |
12 |
c |
33 |
b |
54 |
b |
75 |
d |
96 |
d |
13 |
c |
34 |
b |
55 |
c |
76 |
a |
97 |
d |
14 |
c |
35 |
a |
56 |
d |
77 |
a |
98 |
b |
15 |
c |
36 |
b |
57 |
d |
78 |
b |
99 |
c |
16 |
c |
37 |
c |
58 |
d |
79 |
b |
100 |
d |
17 |
b |
38 |
d |
59 |
b |
80 |
c |
101 |
c |
18 |
b |
39 |
d |
60 |
d |
81 |
d |
102 |
d |
19 |
d |
40 |
b |
61 |
d |
82 |
b |
103 |
a |
20 |
c |
41 |
d |
62 |
c |
83 |
d |
104 |
d |
21 |
a |
42 |
d |
63 |
d |
84 |
c |
105 |
a |
3.7. Węglowodory
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
a |
8 |
d |
15 |
b |
22 |
c |
29 |
c |
2 |
b |
9 |
c |
16 |
b |
23 |
a |
30 |
c |
3 |
a |
10 |
c |
17 |
a |
24 |
b |
31 |
b |
4 |
c |
11 |
d |
18 |
a |
25 |
b |
32 |
b |
5 |
d |
12 |
b |
19 |
b |
26 |
b |
33 |
d |
6 |
c |
13 |
c |
20 |
d |
27 |
d |
34 |
d |
7 |
c |
14 |
b |
21 |
c |
28 |
b |
35 |
a |
3.8. Pochodne węglowodorów, związki wielofunkcyjne
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
c |
17 |
a |
33 |
b |
49 |
c |
65 |
a |
2 |
b |
18 |
a |
34 |
b |
50 |
c |
66 |
d |
3 |
b |
19 |
b |
35 |
b |
51 |
d |
67 |
b |
4 |
a |
20 |
b |
36 |
b |
52 |
c |
68 |
b |
5 |
a |
21 |
b |
37 |
b |
53 |
d |
69 |
b |
6 |
b |
22 |
b |
38 |
a |
54 |
a |
70 |
a |
7 |
b |
23 |
a |
39 |
d |
55 |
b |
71 |
b |
8 |
d |
24 |
a |
40 |
c |
56 |
c |
72 |
d |
9 |
a |
25 |
d |
41 |
a |
57 |
b |
73 |
a |
10 |
c |
26 |
a |
42 |
d |
58 |
c |
74 |
c |
11 |
a |
27 |
d |
43 |
b |
59 |
d |
75 |
b |
12 |
d |
28 |
c |
44 |
c |
60 |
c |
76 |
d |
13 |
c |
29 |
d |
45 |
d |
61 |
b |
77 |
b |
14 |
b |
30 |
b |
46 |
d |
62 |
d |
78 |
a |
15 |
b |
31 |
d |
47 |
c |
63 |
c |
79 |
a |
16 |
d |
32 |
a |
48 |
c |
64 |
c |
80 |
c |
3.9. Zadania z chemii organicznej
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
b |
6 |
b |
11 |
b |
16 |
b |
21 |
c |
2 |
b |
7 |
d |
12 |
b |
17 |
b |
22 |
a |
3 |
b |
8 |
a |
13 |
a |
18 |
a |
23 |
b |
4 |
c |
9 |
b |
14 |
a |
19 |
a |
24 |
b |
5 |
a |
10 |
a |
15 |
c |
20 |
d |
25 |
c |
3.10. Test sprawdzający
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
d |
11 |
c |
21 |
d |
31 |
a |
41 |
b |
2 |
b |
12 |
d |
22 |
a |
32 |
a |
42 |
a |
3 |
a |
13 |
d |
23 |
d |
33 |
c |
43 |
d |
4 |
b |
14 |
b |
24 |
b |
34 |
b |
44 |
b |
5 |
b |
15 |
c |
25 |
a |
35 |
c |
45 |
a |
6 |
c |
16 |
c |
26 |
c |
36 |
d |
46 |
d |
7 |
c |
17 |
b |
27 |
a |
37 |
a |
47 |
b |
8 |
a |
18 |
b |
28 |
b |
38 |
c |
48 |
d |
9 |
a |
19 |
a |
29 |
c |
39 |
b |
49 |
a |
10 |
b |
20 |
a |
30 |
a |
40 |
b |
50 |
a |
3.11. Egzamin wstępny 1995
Nr. Pytania |
Odp. |
Nr. Pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp. |
Nr. pytania |
Odp |
1 |
c |
11 |
b |
21 |
b |
31 |
a |
41 |
b |
2 |
b |
12 |
a |
22 |
b |
32 |
b |
42 |
a |
3 |
a |
13 |
c |
23 |
d |
33 |
c |
43 |
b |
4 |
d |
14 |
a |
24 |
d |
34 |
a |
44 |
b |
5 |
c |
15 |
b |
25 |
c |
35 |
c |
45 |
b |
6 |
c |
16 |
d |
26 |
a |
36 |
b |
46 |
a |
7 |
b |
17 |
b |
27 |
b |
37 |
c |
47 |
d |
8 |
c |
18 |
a |
28 |
c |
38 |
d |
48 |
c |
9 |
b |
19 |
d |
29 |
d |
39 |
b |
49 |
a |
10 |
d |
20 |
c |
30 |
a |
40 |
a |
50 |
a |
26
27
H+
H+
OH
OH
OH
Wyszukiwarka
Podobne podstrony:
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
pods. - budowa atomu a układ okresowy 2, chemia, podsumowanie wiadomości
SPRAWDZIAN Z DZIAŁU BUDOWA ATOMU I UKŁAD OKRESOWY, sprawdziany z chemi
Budowa atomu a układ okresowy pierwiastków chemicznych
pods. - budowa atomu a układ okresowy 1, Budowa atomu, a układ okresowy - powtórzenie
Budowa Atomu a Uklad Okresowy
Budowa atomu a układ okresowy pierwiastków chemicznych
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
1 1 Budowa atomu Układ Odpowiedzi
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
Chemia - Zbiór i testy - Odpowiedzi, Nauka, Chemia
1 1 Budowa atomu Układ Odpowiedzi
Budowa atomu i Układu okresowego
Budowa atomu testy chemia liceum, chemia liceum
uklad okresowy a budowa atomu1, przedmioty, chemia
Uklad okresowy pierwiastkow a budowa atomu
więcej podobnych podstron