
TEMAT 3
Elementy symetrii.
Enancjomery, projekcje Fischera, pojecie chiralności.
Właściwości chemiczne i fizyczne enancjomerów.
1

Spis treści:
1.
Elementy symetrii
2.
Chiralność
3.
Centrum stereogeniczne
4.
Enancjomery
5.
Właściwości fizyczne enancjomerów
6.
Właściwości chemiczne enancjomerów
7.
Projekcje Fischera
2

Elementy symetrii
Elementem symetrii nazywamy obiekt
geometryczny taki jak linia, punkt lub
płaszczyzna
względem
którego
dokonujemy operacji symetrii.
Operacja symetrii to przekształcenie, po
dokonaniu którego każdy punkt ciała
pokrywa się z równoważnym punktem (w
szczególności z samym sobą) przed
wykonaniem transformacji.
3
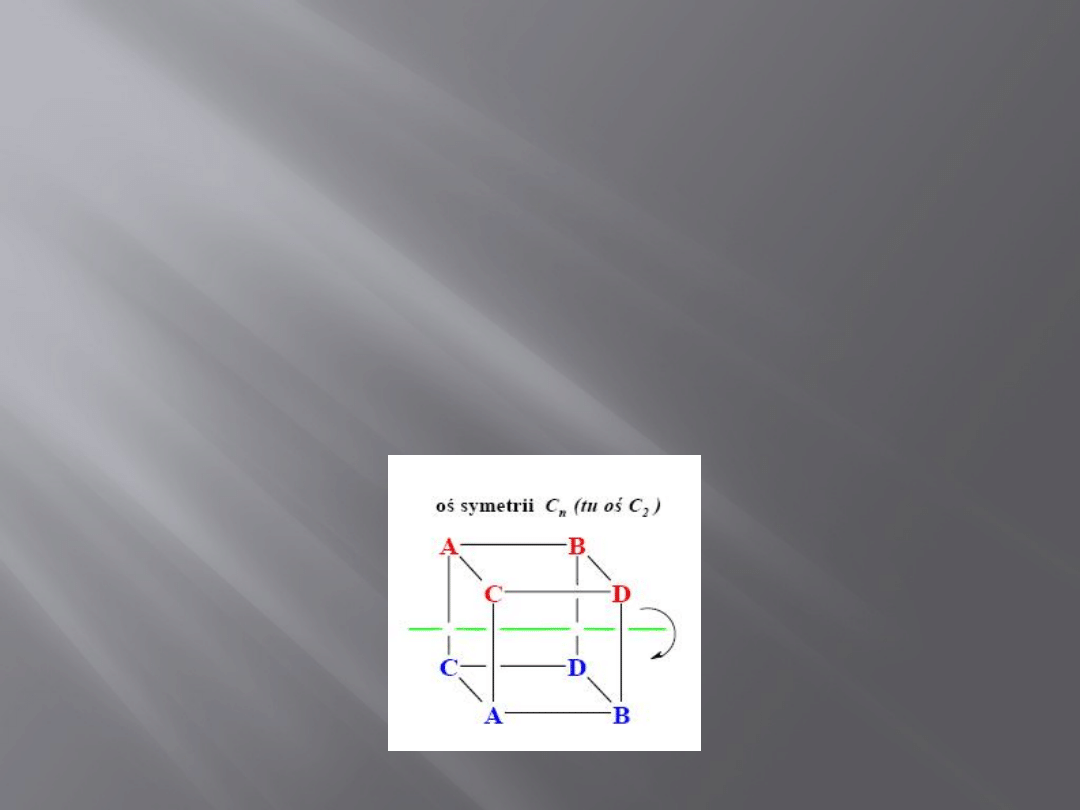
Elementy symetrii
Oś symetrii C
n
n- oznacza krotność osi; największa
wartość n, dla której obrót o kąt 2π/n
prowadzi do konfiguracji równoważnej
4
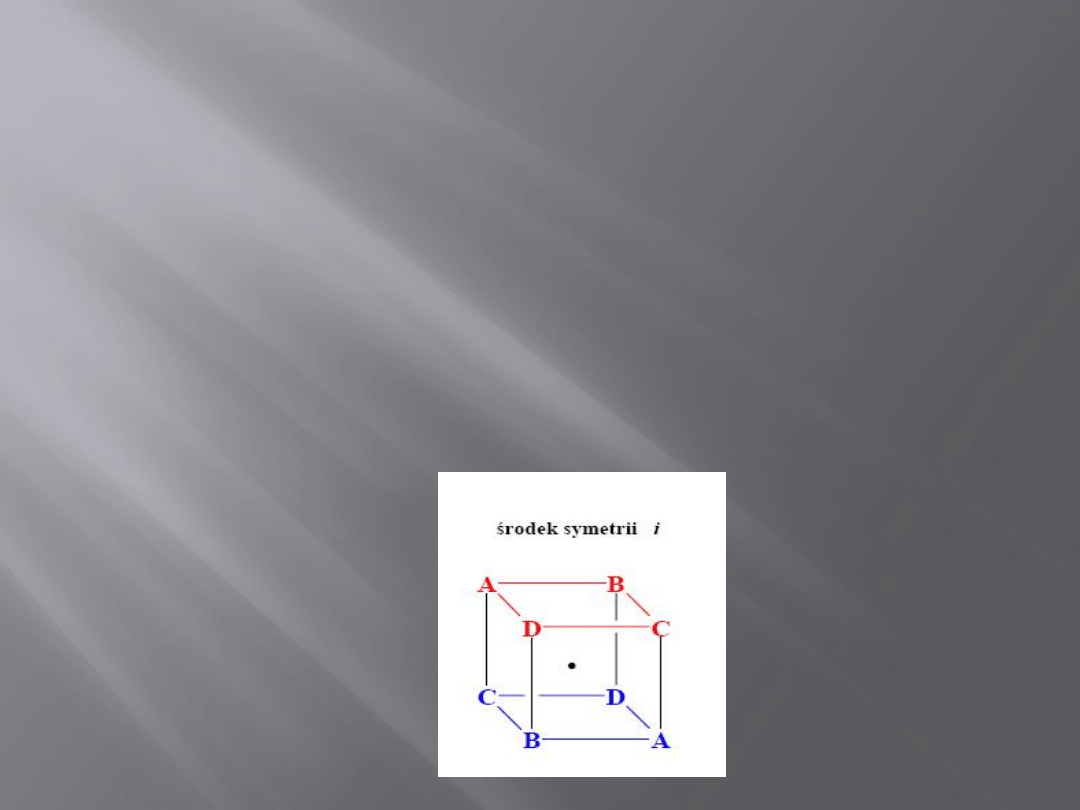
Elementy symetrii
Środek symetrii i nazywamy punkt, w
którym znajduje się początek układu
kartezjańskiego.
Zamiana współrzędnych (x,y,z) każdego
atomu na współrzędne (-x,-y,-z) prowadzi
do konfiguracji równoważnej cząsteczki
atomów.
5
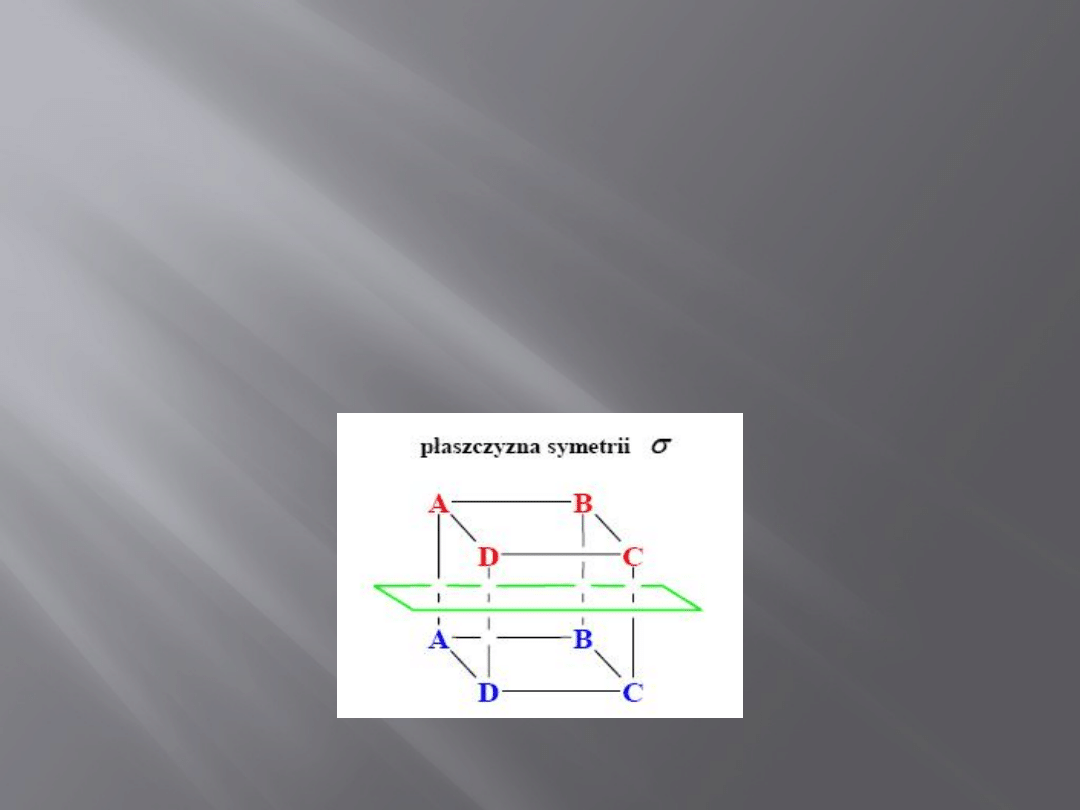
Elementy symetrii
Płaszczyzna symetrii σ dzieli ciało na
dwie równe części będące wzajemnie
swoimi odbiciami zwierciadlanymi.
6

Elementy symetrii
Oś niewłaściwa (inwersyjna) S
n
Złożenie dwóch operacji symetrii:
Obrotu właściwego
Odbicia w płaszczyźnie prostopadłej do osi
obrotu
Obrót niewłaściwy o kąt 2π/n oznacza się
symbolem S
n
Cząsteczka która ma oś C
n
i prostopadłą do niej
płaszczyznę symetrii ma także oś inwersji S
n
Cząsteczka może mieć S
n
, wtedy gdy nie ma C
n
oraz prostopadłej do niej płaszczyzny symetrii
7
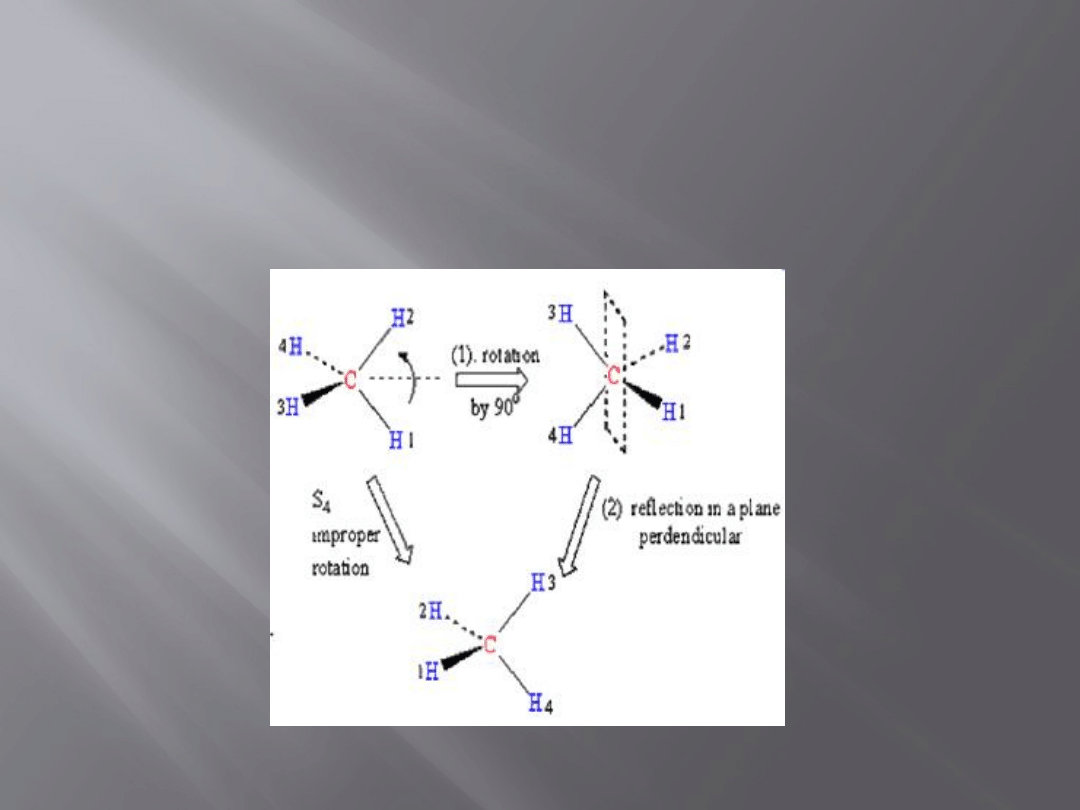
Elementy symetrii
Oś przemienna S
n
8
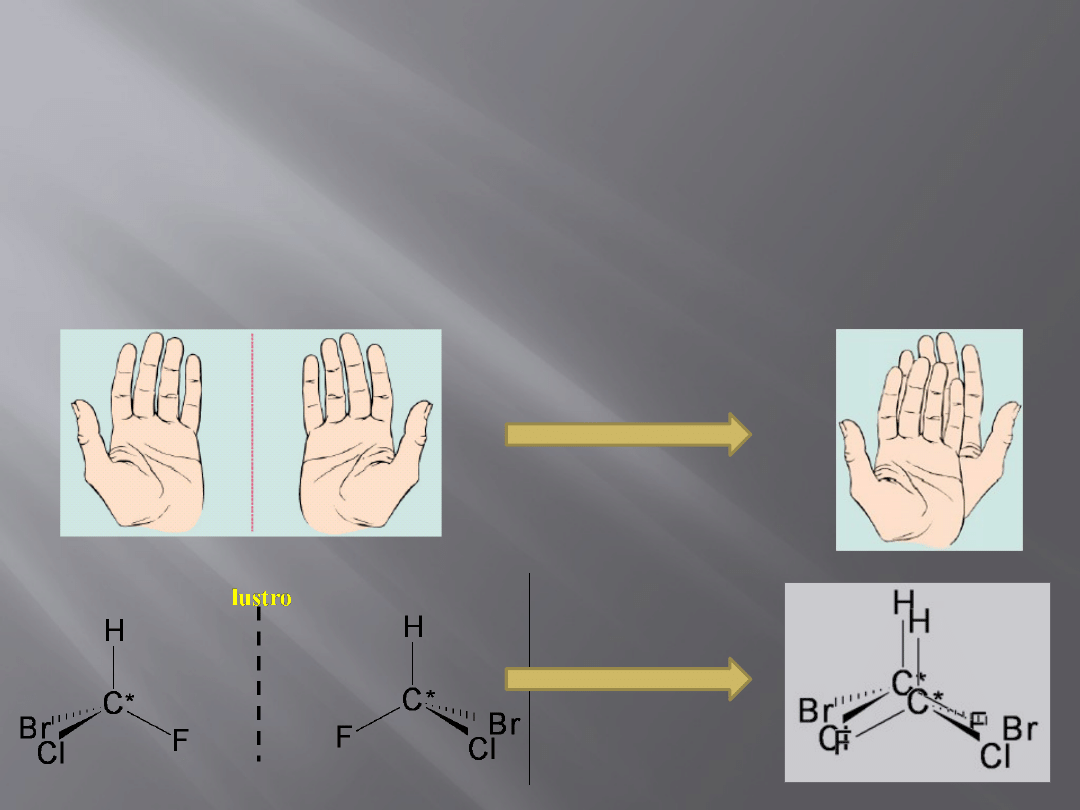
Chiralność
Chiralność (od greckiego słowa cheir = ręka) jest to cecha fizyczna
polegająca na braku możliwości nałożenia przedmiotu na jego własne
lustrzane odbicie w taki sposób aby wszystkie punkty się pokrywały
9
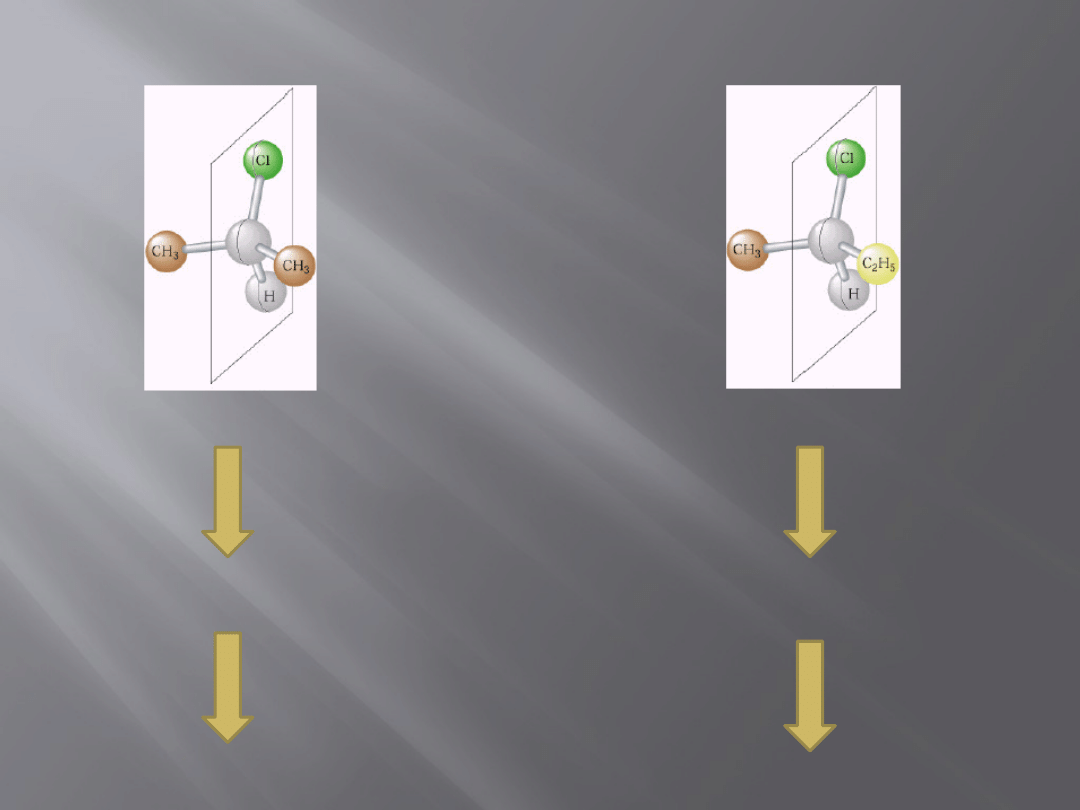
Kiedy cząsteczka jest chiralna?
Cząsteczka
achiralna
Cząsteczka
chiralna
Posiada
płaszczyznę
symetrii
Brak płaszczyzny
symetrii
10
Identyczna z
lustrzanym
odbiciem
Nie jest
identyczna z
lustrzanym
odbiciem
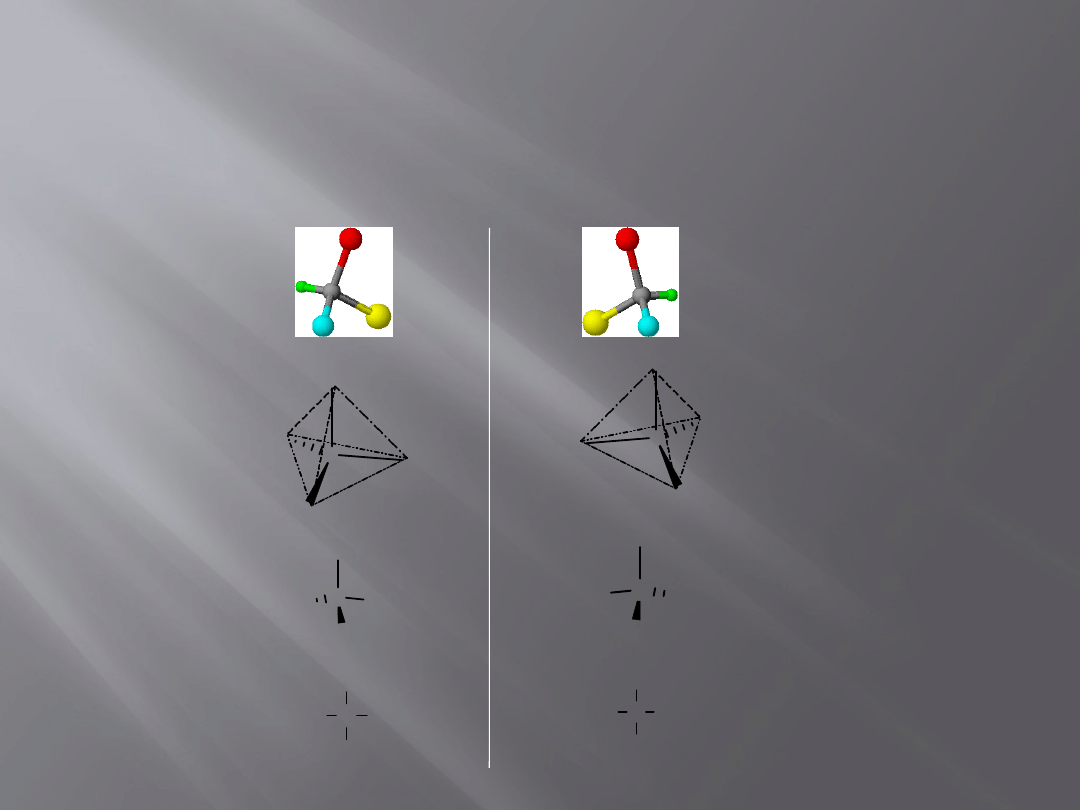
Centrum stereogeniczne
11
Atom węgla, który jest związany z czterema różnymi podstawnikami
nazywamy centrum asymetrii albo centrum stereogenicznym
(e)
(d)
(a)
(b)
C
(e)
(d)
(a)
(b)
C
C
(a)
(d)
(b)
(e)
C
(a)
(d)
(b)
(e)
C
(a)
(d)
(b)
(e)
C
(a)
(d)
(b)
(e)
LUSTRO
Cząsteczki chiralne
12
C
COOH
CH
3
H
OH
C
CH
3
H
OH
*
1. Kwas
mlekowy
CH
3
CHCOOH
OH
*
2. 1-fenyloetanol
C
6
H
5
CHCH
3
OH
*
*
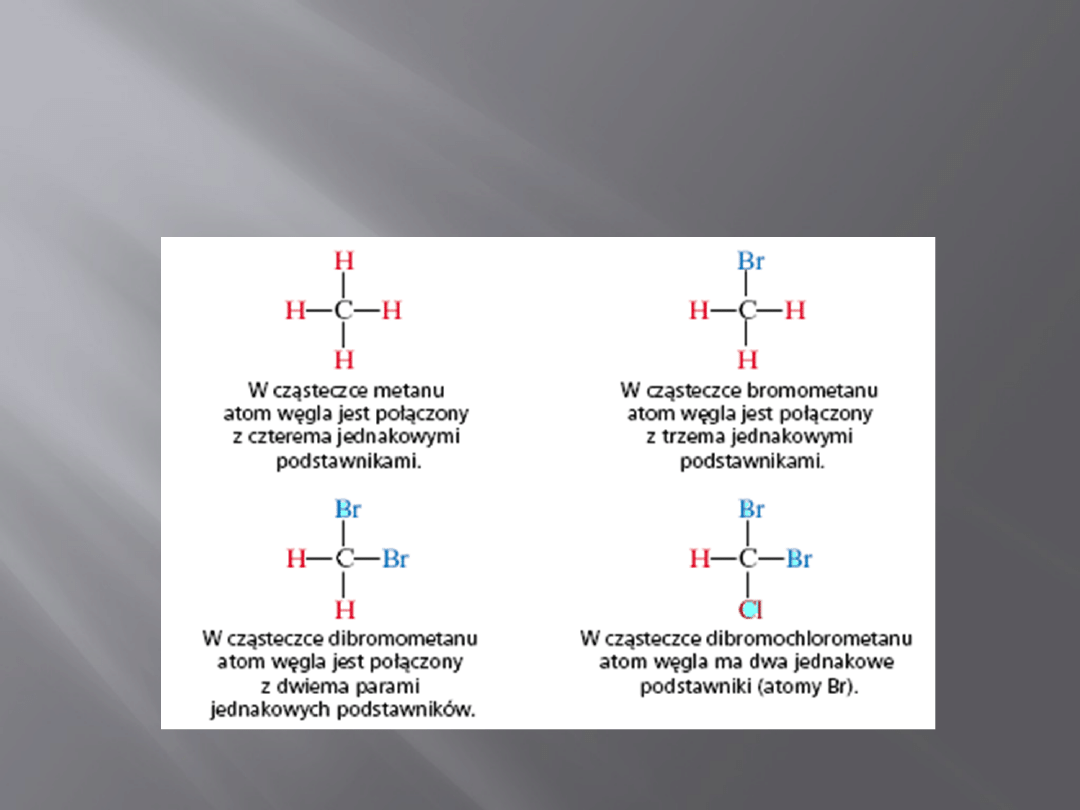
13
Atomy węgla w poniższych cząsteczkach nie są asymetryczne
ponieważ każdy z nich połączony jest co najmniej z dwoma
identycznymi atomami
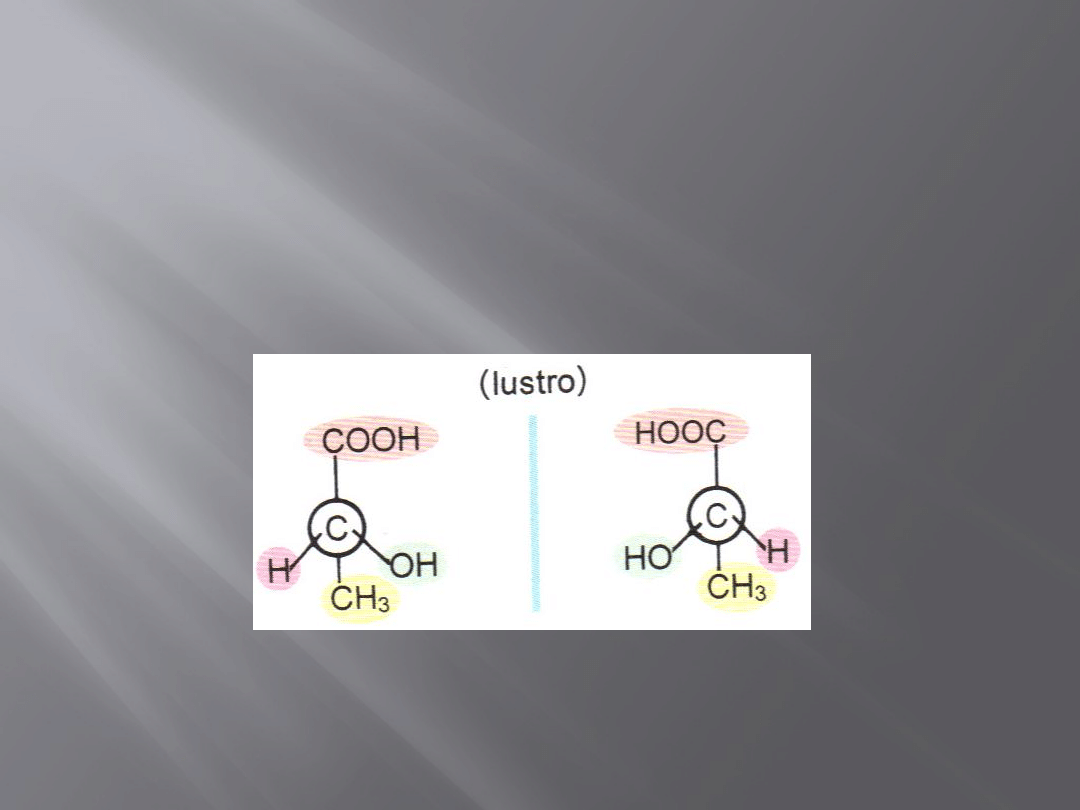
Enancjomery
Cząsteczka, która nie jest identyczna ze swoim odbiciem lustrzanym,
stanowi specjalny rodzaj stereoizomeru nazywanego enancjomerem
(od greckiegio enantio -„przeciwny”)
14
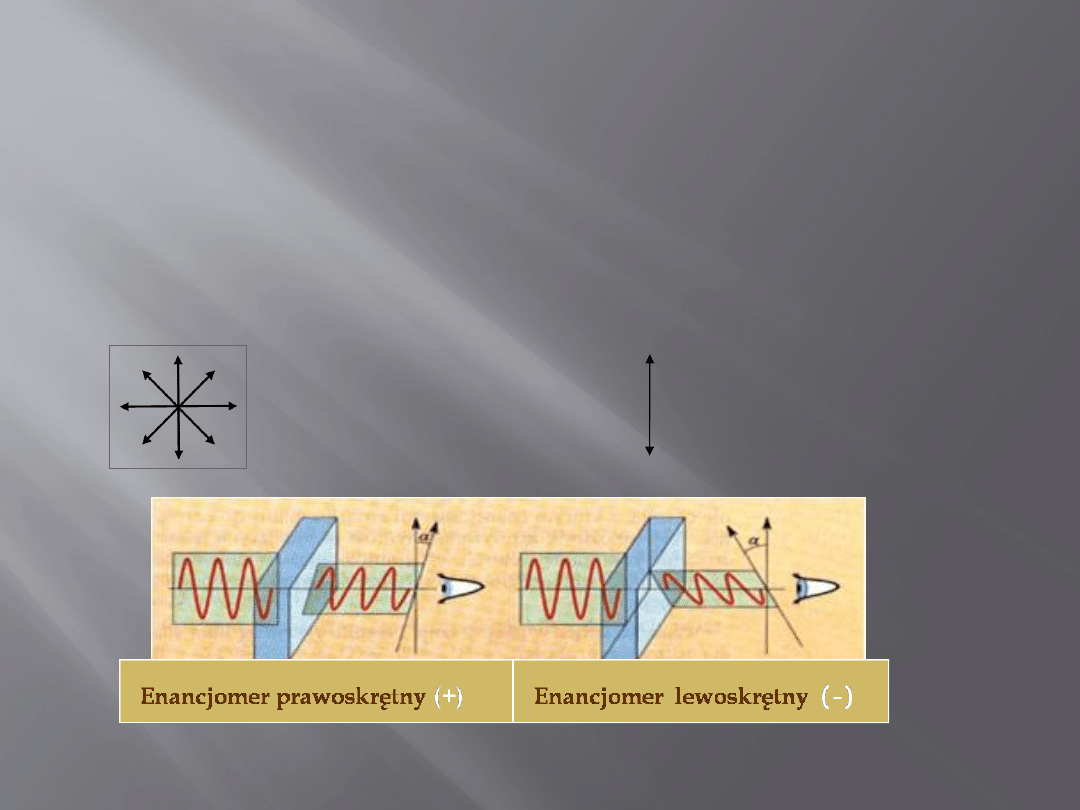
Właściwości fizyczne
enancjomerów
15
•Niemal wszystkie właściwości fizyczne enancjomerów, tej samej
substancji, są jednakowe, ale zawsze enancjomery różnią się
kierunkiem skręcania płaszczyzny światła spolaryzowanego: jeden
w prawo(+), drugi w lewo (), o ten sam kąt, charakterystyczny dla
danej substancji.
•Enancjomery mogą także różnić się barwą, zapachem lub
smakiem.
Światło
niespolaryzowan
e
Światło
spolaryzowane
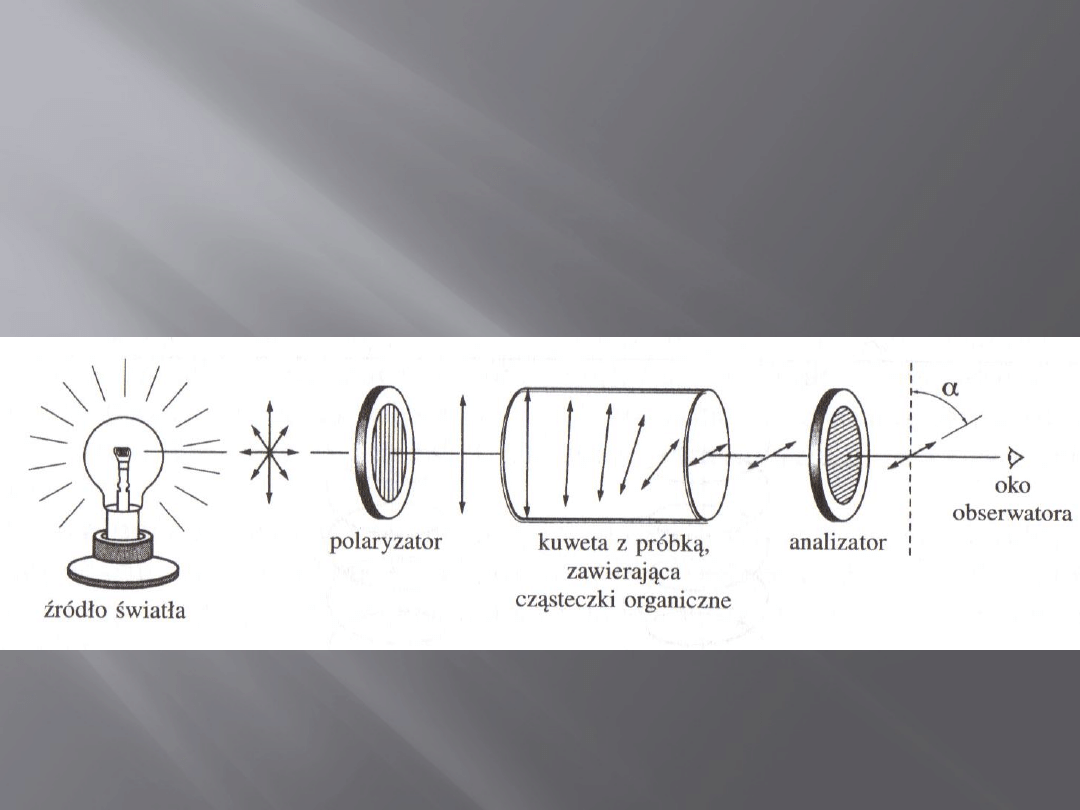
Polarymetr
16
Jest to przyrząd służący do badania czynności optycznej i
pomiaru kąta skręcenia płaszczyzny polaryzacji przez
roztwór badanej substancji.
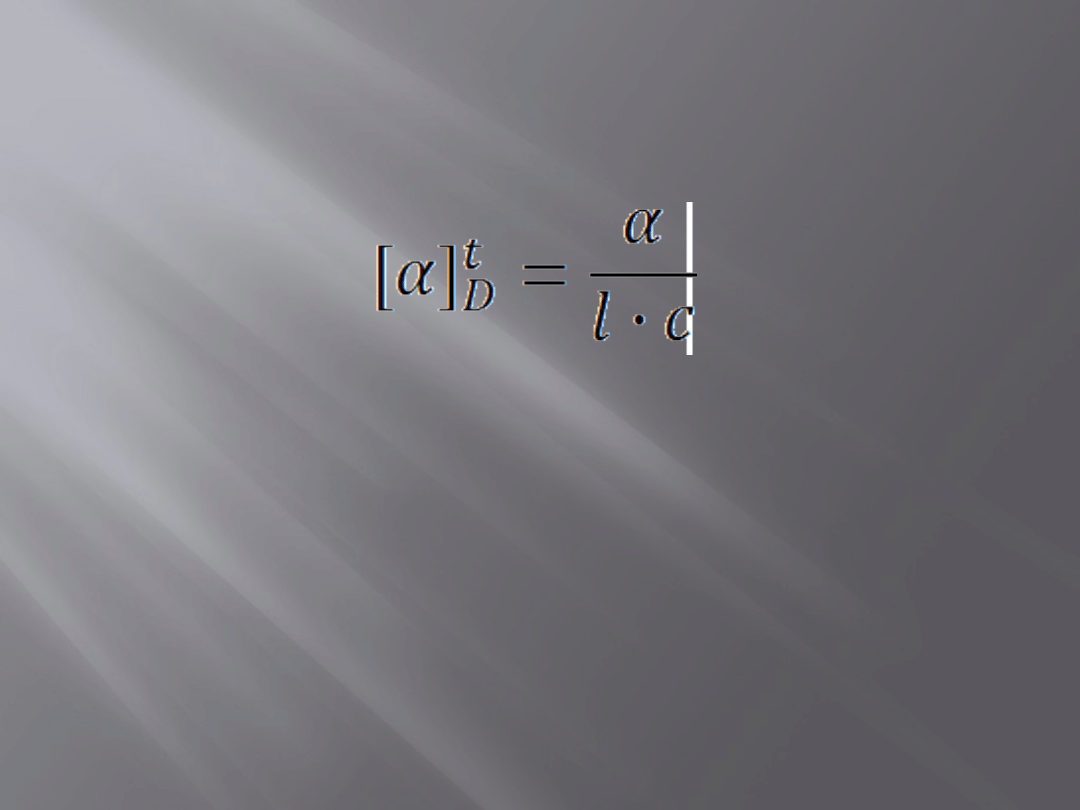
Skręcalność właściwa
17
α- obserwowany kąt skręcenia w stopniach
l – długość kuwety polarymetru [dm]
c – gęstość czystej cieczy lub stężenie roztworu [g/cm
3
]
t - temperatura pomiaru [
o
C]
D- światło z linii D lampy sodowej o długości 589,6 [nm]
Skręcalność właściwa zależy od:
a) Długość fal
b) Temperatury
c) rozpuszczalnika

Właściwości fizyczne
enancjomerów
18
Stereoizomer
Temperatura
topnienia
[
o
C]
[α]
D
[stopni
e]
Gęsto
ść
[g/cm
3]
Rozpuszczalno
ść w 20
o
C
[g/100ml H
2
O]
(+)
168-170
+12
1,7598 139,0
(-)
168-170
-12
1,7598 139,0
Mezo
146-148
0
1,6660 125,0
(±)*
206
0
1,7880 20,6
Tabela. Niektóre właściwości stereoizomerów kwasu winowego
* mieszanina równych ilości (tj. równomolowa) enancjomerów tej
samej substancji to tzw. mieszanina racemiczna czyli racemat.
Mieszanina ta jest optycznie nieczynna, pomimo występowania w niej
chiralnych cząsteczek. Oznaczana jest symbolem (+/).

Właściwości chemiczne
enancjomerów
W środowisku achiralnym wszystkie właściwości chemiczne
enancjomerów są jednakowe, ale zupełnie odmiennie
zachowują się te izomery w reakcjach z udziałem innych
substancji chiralnych, to znaczy:
zasadniczo inna jest szybkość reakcji enancjomerów tej samej
substancji, z inną substancją chiralną (jeden z izomerów może
nawet praktycznie nie reagować),
inna jest rozpuszczalność obu enancjomerów w tym samym,
chiralnym rozpuszczalniku, wobec tego inne stężenie i przez to
inna szybkość reakcji,
chiralny katalizator inaczej zmienia szybkość reakcji każdego z
enancjomerów z achiralnym reagentem,
w wyniku reakcji enancjomerów z inną chiralną substancją
tworzyć się mogą także inne izomery optyczne produktu, w
tym sensie inny więc będzie kierunek reakcji.
19
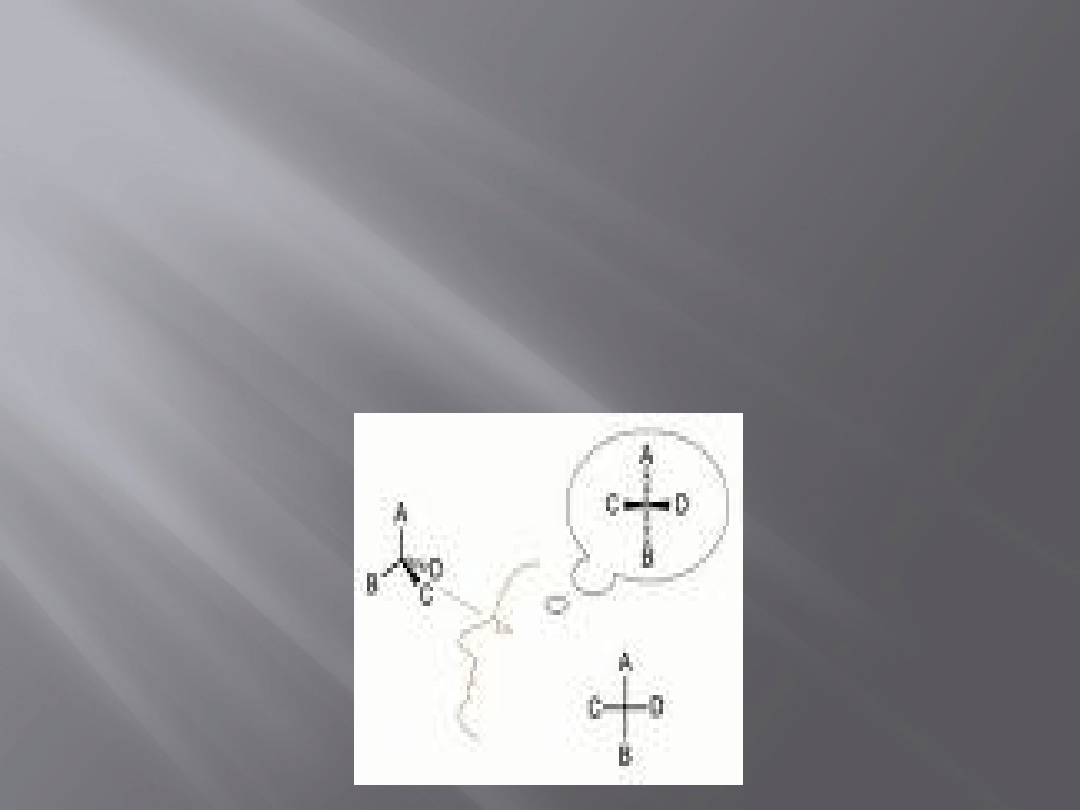
Projekcje Fischera
Metoda oparta na rzutowaniu
tetraedrycznego
atomu
węgla
na
płaszczyznę.
Stanowi
obecnie
standardową
metodę
przedstawiania
centrów stereogenicznych.
20
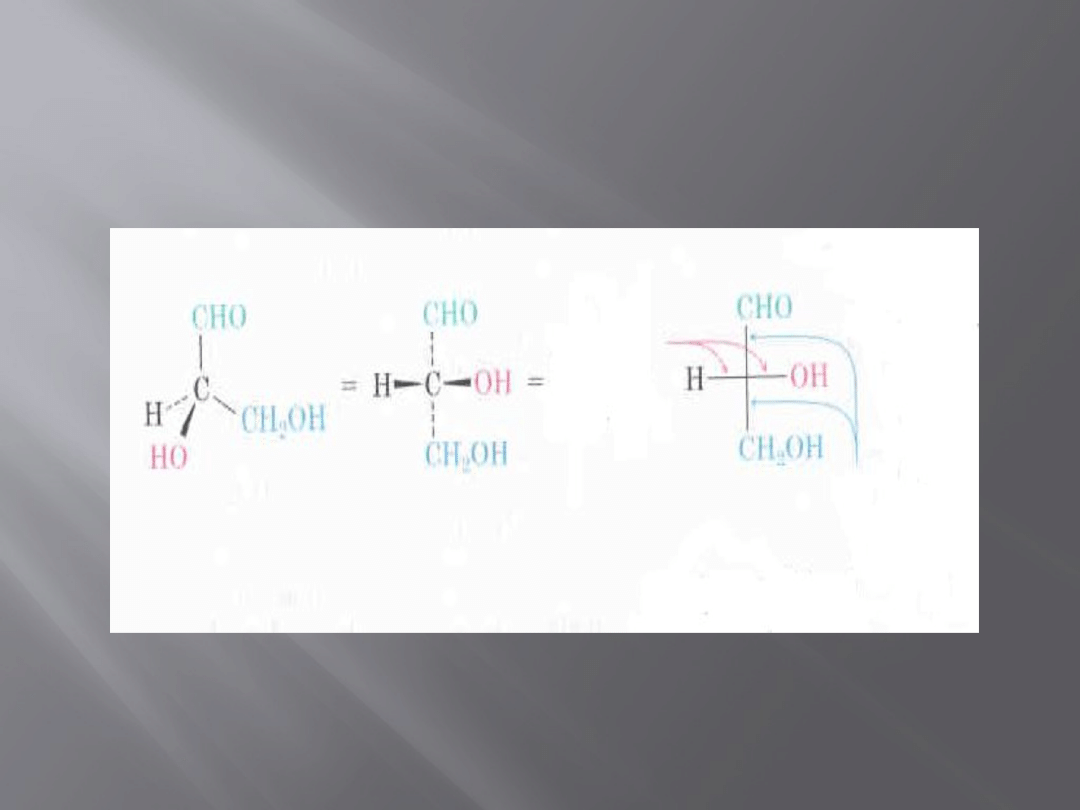
Projekcja Fischera
21
wiązania
wystające
do przodu
wiązania
„wrastające”
w kartkę
Rys. Projekcja Fischera (R)-gliceroaldehydu (aldehydu glicerynowego)

Dozwolone operacje przekształceń przy
sprawdzaniu identyczności cząstek
Projekcje Fischera można obracać o kąt
180˚
W projekcji Fischera można pozostawić
jeden z podstawników w niezmienionej
pozycji, a pozostałe trzy przemieścić albo
zgodnie ze wskazówkami zegara, albo
przeciwnie
22

Projekcja Fischera
Projekcjom Fischera można przypisać konfiguracje
R lub S używając trzyetapowej procedury:
Zgodnie ze znaną zasadą ustal hierarchię czterech
podstawników
Używając jednego z dwóch dowolnych
przekształceń umieść najmniej ważny podstawnik
w górnej części projekcji Fischera. Oznacza to, że
grupa najmniej ważna jest umieszczona z tyłu
najdalej od obserwatora, zgodnie z zasadą
określania konfiguracji
Oznacz kierunek rotacji
1 2 3 pozostałych trzech grup
23

Bibliografia
1.
J. McMurry, Chemia Organiczna, Wydawnictwo Naukowe PWN,
Warszawa 2003.
2.
D.G. Morris, Stereochemia, Wydawnictwo Naukowe PWN,
Warszawa 2008.
3.
Źródła internetowe.
24
Document Outline
- Slide 1
- Spis treści:
- Elementy symetrii
- Elementy symetrii
- Elementy symetrii
- Elementy symetrii
- Elementy symetrii
- Elementy symetrii
- Chiralność
- Kiedy cząsteczka jest chiralna?
- Centrum stereogeniczne
- Cząsteczki chiralne
- Slide 13
- Enancjomery
- Właściwości fizyczne enancjomerów
- Polarymetr
- Skręcalność właściwa
- Właściwości fizyczne enancjomerów
- Właściwości chemiczne enancjomerów
- Projekcje Fischera
- Projekcja Fischera
- Slide 22
- Projekcja Fischera
- Bibliografia
Wyszukiwarka
Podobne podstrony:
Projektowanie nowych białek o zadanych właściwościach katalitycznych
,elementy i układy elektroniczne I P, projektowanie wzmacniaczy oe
Blazek wyklady z ub roku (2006-07), Zmienne konatywne, Zmienne konatywne- projekty, dążenia, zadania
3.Elementy symetrii w chemii, III
3.Elementy symetrii w chemii, III
wyklad 6 elementy symetrii
wyklad 6 elementy symetrii
wyklad 6 elementy symetrii
Elementy symetrii
03. ELEMENTY SYMETRII w CHEMII – SYMETRIA
WYKAZ ELEMENTÓW EPS 150, projekty, NN, prostownik z rozuchem
wyklad 6 elementy symetrii
1 pojecie przedmiot i wlasciwosci pr pracy, Prawo karne, Studia- administracja, Prawo pracy i prawo
3 Elementy symetrii w chemii id Nieznany (2)
więcej podobnych podstron