Sprawność egzergetyczna dla obiegu cieplnego to stosunek sprawności rzeczywistego silnika do sprawności obiegu Carnota
Scharakteryzować parametry przemiany fazowej ciecz - para.
Ilość faz oraz składników jaka może występować w danym układzie jest zależna od temperatury i ciśnienia. Zależność tę ujmuje reguła faz Gibbsa s=α+2-β
s - ilość stopni swobody, czyli parametrów które możemy dowolnie zmieniać
α- ilość składników niezależnych, β- ilość faz.
W układzie ciecz-para w równowadze są 2 fazy (β = 2), stąd liczba stopni swobody
s = 1 - 2 + 2 = 1. Można wówczas zmienić temperaturę albo ciśnienie - jeżeli zmienimy temperaturę, ciśnienie musi zmienić się samo, jeżeli zmienimy ciśnienie, wówczas temperatura układu musi się odpowiednio dostosować - nie można zmienić dowolnie (nawet o niewielkie wartości) naraz obu parametrów intensywnych bez opuszczenia krzywej równowagi ciecz-para.
Jakie zjawiska powoduje wsypanie cukru do wody.
Rozpuszczanie(efekty cieplne, wzrost entropii układu)
efekty cieplne(zrywanie wiązań oraz solwoliza)
Powstaje jednorodny roztwór Jest to zjawisko fizyczne
Proces jest nieodwracalny
Omówić efekty energetyczne reakcji chemicznych
Podczas reakcji chemicznych wyróżniamy przemiany:
Egzotermiczną dla ciepła oddawanego do otoczenia
Endotermiczną dla ciepła pochłanianego z otoczenia
efekty cieplne reakcji chemicznych zależą:
temperatury (dosyć istotnie)
ciśnienia (niezbyt istotnie)
zaawansowania reakcji
stężeń reagentów
stanu skupienia reagentów (bardzo istotnie)
Omówić pojęcie -stała równowagi reakcji.
Stała równowagi reakcji to współczynnik opisujący stan równowagi odwracalnych reakcji chemicznych.
Stała ta jest równa ilorazowi reakcji w stanie doskonałej równowagi
![]()
A + B ⇌ AB
Gdy stała k > 1 oznacza to, że równowaga jest przesunięta w stronę produktów
Gdy stała k < 1 oznacza to, że równowaga jest przesunięta w stronę substratów
Gdy stała k =1 oznacza równowagę produktów i substratów
Jak zmienia się stała równowagi reakcji egzotermicznej ze wzrostem temperatury.
Wzrost temperatury przesuwa położenie równowagi chemicznej, w przypadku reakcji egzotermicznej , przesuwa ją w kierunku substratów (z prawej strony na lewą).
w myśl reguły przekory i równocześnie zmienia wartość stałej równowagi Kc (maleje)
Dla jakich reakcji stała równowagi ciśnieniowa jest równa stałej stężeniowej.
Dla reakcji w których liczba moli produktów = liczbie moli substratów
Zdefiniować pojęcia: reakcja dwucząsteczkowa i reakcja drugiego rzędu.
Reakcja dwucząsteczkowa - to reakcja uwarunkowana zderzeniem dwóch cząsteczek Np. H2 + I2 → 2HI (a zarazem reakcja drugiego rzędu)
Rząd reakcji - jest równy sumie wykładników potęgowych stężeń substratu w równaniu kinetycznym v = k × cH2 × cI2
Omówić reakcje złożone
Reakcja prosta to pojedynczy akt zerwania lub powstania jednego wiązania chemicznego. W przyrodzie bardzo rzadko obserwuje się jednak reakcje proste.
Reakcje złożone, to reakcje w których dochodzi jednocześnie do rozpadu jednych wiązań i powstania drugich. Każdą reakcje złożoną można zapisać jako ciąg następujących po sobie reakcji prostych, które w tym przypadku nazywają się reakcjami elementarnymi. Kompletny zbiór reakcji elementarnych zachodzących podczas reakcji złożonej jest często nazywany jej mechanizmem.
Czy można zastosować równanie Van der Walsa do gazu doskonałego?
Tak, jeśli zaniedbamy oddziaływanie między cząsteczkami (a=0) i rozmiary samych cząsteczek (b=0) to równanie van der Waalsa przechodzi w równanie Clapeyrona.
Kiedy i dlaczego zmienia się ciepło właściwe
W przypadku gazów rzeczywistych ciepło właściwe (zarówno cp jak i cv) jest zależne od temperatury. Rośnie ono wraz z temperaturą
Ściśliwość gazów powoduje, że inną ilość ciepła należy dostarczyć ogrzewając gaz o 1°C przy niezmiennym ciśnieniu, a inną - przy niezmiennej objętości
Wytłumaczyć, dlaczego w obiegu silnikowym nie można wykorzystać na pracę całego dostarczonego ciepła.
Silnik cieplny nie może działać bez różnic temperatury
![]()
Nie można bez wkładu pracy przesyłać energii termicznej między ciałami mającymi tę samą temperaturę. Oznacza to, że perpetum mobile II rodzaju nie istnieje.
Podać przykłady trzech procesów, w których entropia maleje.
Zamrożenie wody w zamrażalniku
Poukładanie książek na regale
Namagnesowanie kawałka stali
Uwaga całkowita entropia rośnie
Typowe procesy nieodwracalne. Co się dzieje z energią i entropią tych procesów?
Proces nieodwracalny - proces termodynamiczny, powodujący wzrost sumy entropii układu i otoczenia oraz spadek energi. Przykładem takiego procesu jest np. swobodne rozprężanie gazu lub zmieszanie się dwóch cieczy.
Udział objętościowy ri składnika w mieszaninie jest to stosunek objętości Vi danego składnika
do całkowitej objętości V mieszaniny:
Udział masowy gi składnika w mieszaninie jest to stosunek masy mi danego składnika do całkowitej masy m mieszaniny
Tak, dla gazów doskonałych
Zdefiniuj współczynnik wydajności chłodniczej dla chłodziarek i pompy cieplnej.
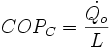
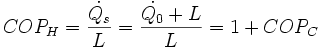
To samo urządzenie użyte jako pompa ciepła ma współczynnik wydajności o jeden większy niż w przypadku zastosowania go jako urządzenia chłodniczego.
Współczynnik wydajności chłodniczej (lub cieplnej) jest w praktyce wyraźnie uzależniony od temperatury otoczenia.
W przypadku chłodziarek im wyższą temperaturę ma powietrze odbierające ciepło od skraplacza, tym sprawność układu jest mniejsza.
W przypadku pomp ciepła im niższą temperaturę ma powietrze dostarczające ciepło do parownika, tym sprawność układu jest mniejsze
Omówić i narysować na wykresie i-x proces mieszania się dwóch strumieni powietrza wilgotnego.
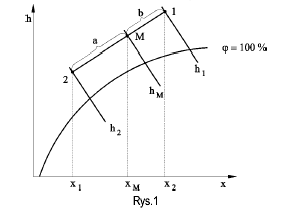
Idea mieszania została przedstawiona na rys Punkty nr 1 i 2 są punktami stanu powietrza przed zmieszaniem.
Zasada mieszania strumieni polega na znalezieniu na odcinku łączącym oba punkty, punktu M - punktu zmieszania poprzez podzielenie odcinka w proporcji odwrotnej do udziału strumieni składowych.
Wspomnianą zależność można również przedstawić za pomocą zapisu matematycznego w postaci:
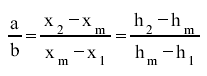
Co to jest egzergia?
egzergia - max praca użyteczna, jaką substancja wykona w procesie odwracalnym, gdzie wykorzystuje otoczenie jako źródło bezwartościowego ciepła i substancji, gdy na końcu wszystko osiąga stan równowagi z powszechnymi składnikami otoczenia,
układ zamknięty: Δ0B=U-U0-T0(S-S0)-p0(V0-V) otwarty: Δ0B=I-I0-T0(S-S0)
Powinowactwo chemiczne - pojęcie termodynamiczne związane z możliwością zajścia reakcji chemicznej w określonych warunkach. Gdy powinowactwo chemiczne jest równe 0 to znaczy, że układ znajduje się w stanie równowagi chemicznej Powinowactwo chemiczne jest pojęciem, które odnosi się zwykle do określonego pierwiastka lub związku chemicznego w stosunku do innego pierwiastka lub związków. Mówiąc np. że powinowactwo chemiczne tlenu do wodoru jest bardzo wysokie, a tlenu do azotu znacznie mniejsze, mamy na myśli to, że w większości przypadków tlen będzie chętniej reagował z wodorem niż azotem. Powinowactwo jest jednak silnie zależne od warunków termodynamicznych i może się radyklanie zmienić ze zmianą ciśnienia, temperatury, objętości i stężenia.
Straty w procesie spalania.
![]()
Trudno jest określić ilość ciepła tracona na skutek niezupełnego i niecałkowitego spalania
oraz straty do otoczenia, które obejmują nieuchwytne ciepło wypromieniowane lub oddane
do otoczenia skutek przewodzenia i ciepło wydzielające się podczas tarcia w mechanizmach
silnika. Dlatego stosuje się przekształcenie równania bilansu cieplnego do obliczenia straty
spalania i straty do otoczenia, po uprzednim obliczeniu pozostałych składników bilansu.
20.Czym różni się praca maksymalna od egzergii?
Praca maksymalna jest to praca jaka może być wykonana przez układ znajdujący się w kontakcie z otoczeniem oraz innymi układami o określonych właściwościach wzajemnego oddziaływania podczas przemiany odwracalnej, zachodzącej miedzy dwoma stanami.
Egzergia jest to maksymalna praca użyteczna, jaką substancja może wykonać w procesie odwracalnym, w którym wykorzystuje się otoczenie jako źródło bezwartościowego ciepła i bezwartościowych substancji, jeżeli przy końcu tego procesu wszystkie uczestniczące w nim postaci substancji osiągają stan równowagi termodynamicznej z powszechnymi składnikami otoczenia.
21.Oszacować egzergię i energię powietrza znajdującego się w tej Sali.
Egzergia powietrza znajdującego się w Sali t1 jest równa 0 gdyż powietrze jest nieruchome i można je traktować jako powszechny składnik otoczenia. Energia nieruchomego powietrza jest również równa 0.
22.W jakich sytuacjach ηegz<ηenerg?
Sprawność egzegetyczna jest stosunkiem egzergii Bi dostarczonej do idealnego procesu odwracalnego do egzergii Br użytej w procesie rzeczywistym jeśli efekt użyteczny obu procesów jest taki sam.
Sprawność energetyczna = sprawność egzergetyczna x sprawność obiegu Carnota
Sprawności są wyrażane w przedziale od 0 do 1 więc sprawność energetyczna będzie mniejsza od sprawności egzegetycznej lub jej równa dla obiegu Carnota.
23.Warunki równowagi fazowej:
Wszystkie fazy zawierają te same składniki, układ izolowany od otoczenia, zmiany stanu spełniają warunki U= const, δS≤0 lub S=const δU≥0 T'=T” p'=p” μ'=μ” W układzie nie występują siły wewnętrzne siły kapilarne, elektryczne, magnetyczne itepe. Wartość stopni swobody w układzie nie może być ujemna.
24.Rola pracy maksymalnej w reakcjach chemicznych
Praca maksymalna reakcji chemicznej jest to suma pracy zwiększenia objętości układu oraz pracy wykonanej przeciwko wszystkim działającym na układ siłom, w przypadku gdy reakcja ta jest odwracalną przemianą termodynamiczną. Odwracalność termodynamiczna oznacza możliwość przebiegu reakcji w stanach równowagi termodynamicznej. Przemiana w której została wykonana praca maksymalna jest odwracalna i nie spełnia warunków reakcji w której wydziela się lub jest pochłaniany efekt cieplny. Lpmax = Gsubstratów - Produktów ( G entalpia swobodna) Lvmax = Fsubstratów - Produktów (F energia swobodna)
25.Co to jest stała równowagi chemicznej i od czego zależy?
Stała równowagi chemicznej określa stan równowagi chemicznej w danej reakcji. Zależy ona wyłącznie od temperatury. Różnica między Kp i Kc jedna zawiera ciśnienia cząstkowe, druga stężenia reagentów w stanie równowagi. Licznik substraty, mianownik produkty reakcji
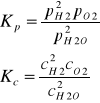
Prawo przekory, reguła przekory Reguła Le Chateliera - Brauna. Jeżeli na układ będący w stanie równowagi podziała bodziec zewnętrzny zakłócający tę równowagę, to reakcja przebiegać będzie w tym kierunku by przeciwdziałać temu bodźcowi. Działanie bdźca się zmniejsza. Jako bodziec zewnętrzny brana jest pod uwagę najczęściej zmiana ciśnienia (stężenia, objętości) lub temperatury. Przy pomocy tej reguły możemy rozpatrywać wszystkie reakcje odwracalne
26.Na czym polega powinowactwo chemiczne i co jest jego miarą?
Powinowactwo chemiczne to chęć zachodzenia reakcji. Miarą powinowactwa chemicznego reagujących związków jest praca maksymalna. Aby wielkość była porównywalna dla różnych reakcji ustalamy warunki początkowe i końcowe reakcji. Ciśnienia cząstkowe wszystkich reagentów są równe jedności wtedy L max = -BTlnKp
27.Wpływ współczynnika nadmiaru powietrza na straty w procesie spalania.
Współczynnik nadmiaru powietrza λ jest to stosunek ilość powietrza doprowadzonego do teoretycznej ilości powietrza. Określa on nadwyżkę ilości rzeczywiście doprowadzonego powietrza nad jego teoretycznym zapotrzebowaniem. Wartość zależy od warunków spalania i stopnia rozdrobnienia paliwa. Nie powinien być zbyt mały by nie występowało niezupełne spalanie, nie powinien być także zbyt duży gdyż rośnie wówczas strata odlotowa.
Po pobieżnym przejrzeniu czepiłbym się paru tych odpowiedzi.
19. Tu nie ma odpowiedzi na pytanie. Pytanie nie brzmi jak się określa straty w praktyce tylko JAKIE są te straty. Należy je wymienić i krótko opisać.
W 20. są dwie definicje, a nie odpowiedź na pytanie jaka jest różnica. Przy tak udzielonej odpowiedzi prowadzący (może nie każdy, ale niektórzy) wysnuwa wniosek, że student przepisał dwie definicje ze ściągi. A ma wysnuć wniosek, że student ROZUMIE różnicę pomiędzy pojęciami - dokładnie o to tutaj chodzi. Pytanie nie brzm "podaj dwie definicje" tylko podaj różnicę.
21. Energia powietrza w sali NIE JEST równa zero, chyba że w sali mamy temperaturę 0 K (ale wtedy nie piszemy w niej egzaminu
). W przeciwnym przypadku energia mamy do czynienia co najmniej z pokaźną ilością energii wewnętrznej. Cały sens tego pytania polega na tym, żeby pokazać, że w powietrzu jest kupa energii, tyle że niemal kompletnie bezużytecznej praktycznie.
27. Wartość współczynnika nadmiaru powietrza nie zależy od rozdrobnienia paliwa, tylko od stosunku powietrze/paliwo. OPTYMALNA wartość istotnie zależy od rozdrobnienia paliwa, ale między tymi dwoma zdaniami jest kardynalna różnica.
Odpowiedź jest znowu naokoło pytania i co najmniej niekompletna.
Prawidłowa brzmi: zmniejszanie współczynnika nadmiaru powietrza powoduje wzrost strat niezupełnego i niecałkowitego spalania (a nie tylko niezupełnego) ze względu na niedobór tlenu.
Zbyt wysoki - wzrost straty odlotowej ze względu na zwiększoną produkcję spalin/konieczność podgrzania większej ilości powietrza.
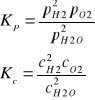
Wyszukiwarka
Podobne podstrony:
Terma III, Termodynamika III sc, PRACA MAKSYMALNA I EGZERGIA:
OTWP 2007 TEST III odpowiedzi
Test Testy 07 wozek widlowy wozki widlowe UDT Test, ZESTAW III odpowiedzi
Spr terma III (2)
wid6 test r iii a i b odpowiedzi
OTWP 2010 TEST III odpowiedzi
kolokwium III odpowiedzi, spss cwiczenia
Test Testy 2007 wozek widlowy wozki widlowe UDT, Test, ZESTAW III odpowiedzi
OTWP 2007 TEST III odpowiedzi
Test R III A i B ODPOWIEDZI[1]
OTWP 2010 TEST III odpowiedzi
OTWP 2007 TEST III odpowiedzi
1 3 Termodynamika chemiczna +Odpowiedzi
Termodynamika Mendel I odpowiedzi
notatki i ściągi, terma egzamin, Termodynamika - egzamin
sprawdzian z fizyki termodynamika grupa b odpowiedzi
termodynamiki sprawdzian odpowiedzi
1 3 Termodynamika chemiczna +Odpowiedzi
więcej podobnych podstron