Technologia Chemiczna |
|
28.11.2007 |
Grupa 5, zespół 3 |
Ćw. 7 |
Dr inż. Izabela Stępniak |
Temat: Zależność stałej równowagi reakcji od temperatury.
Cel ćwiczenia: Przebadanie stałej równowagi reakcji rozpuszczania soli BaCO3.
1.Pomiary dla wody destylowanej
Lp. |
Temperatura [ºC] |
Temperatura [K] |
Przewodnictwo właściwe[μS/cm] |
1. |
26,0 |
299,0 |
34 |
2. |
36,1 |
309,1 |
39,4 |
3. |
46,1 |
319,1 |
48,3 |
4. |
56,0 |
329,0 |
64,7 |
5. |
65,1 |
338,1 |
82,6 |
6. |
74,9 |
347,9 |
104,5 |
2.Pomiary dla soli BaCO3
Lp. |
Temperatura [ºC] |
Temperatura [K] |
Przewodnictwo właściwe[μS/cm] |
1. |
26 |
299,0 |
155,7 |
2. |
36,1 |
309,1 |
154,8 |
3. |
46,1 |
319,1 |
155.4 |
4. |
56,1 |
329,1 |
171.2 |
5. |
65,1 |
338,1 |
198,0 |
6. |
74,9 |
347,9 |
228,0 |
3.Obliczanie przewodnictwa właściwego Kr badanego roztworu w różnych temperaturach odejmując od przewodnictwa soli K przewodnictwo wody destylowanej Kw.
Kr=K-Kw
Lp. |
Temperatura[ºC] |
K[μS/cm] |
Kw[μS/cm] |
Kr[μS/cm] |
1. |
26 |
155,7 |
34 |
121,7 |
2. |
36,1 |
154,8 |
39,4 |
115,4 |
3. |
46,1 |
155.4 |
48,3 |
107,1 |
4. |
56,1 |
171.2 |
64,7 |
106,5 |
5. |
65,1 |
198,0 |
82,6 |
115,4 |
6. |
74,9 |
228,0 |
104,5 |
123,5 |
4.Obliczenie stężenia jonów na podstawie równania oraz obliczenie Ir.
C+=C-=C
K=F(V++V-)· α · z · C
Gdzie:
C+ - stężenie kationu
C- - stężenie anionu
C - stężenie
F- stała Faraday'a (9,648533 · 104 C · mol-1)
V+ - ruchliwość kationu Ba2+( 5,7 · 10-8 m2s-1V-1)
V- - ruchliwość anionu, CO32-( 7,2 · 10-8 m2s-1V-1)
α - współczynnik stechiometryczny w równaniu reakcji
z - wartościowość anionu
![]()
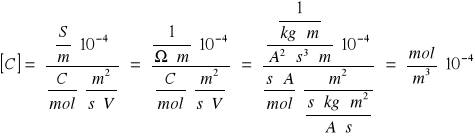
Przykładowe obliczenia dla temperatury 26[şC]
C=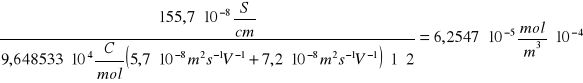
Ir=C+·C-=C2
Lp. |
Temperatura [şC] |
C [mol/m3]*10-4 |
Ir (mol/m3)2 |
1. |
26 |
6,2547 · 10-5 |
3,9121 · 10-9 |
2. |
36,1 |
6,2185 · 10-5 |
3,8669 · 10-9 |
3. |
46,1 |
6,2426 · 10-5 |
3,8970 · 10-9 |
4. |
56,1 |
6,8774 · 10-5 |
4,7298 · 10-9 |
5. |
65,1 |
7,9539 · 10-5 |
6,3264 · 10-9 |
6. |
74,9 |
9,1591 · 10-5 |
8,3889 · 10-9 |
4. Wyznaczanie ciepła standardowego na podstawie wzoru:
![]()
y = ax + b
y = log K
![]()
x =![]()
b = const
Wartość współczynnika a i b wyliczyłem za pomocą programu EXCEL i funkcji regresji liniowej.
y = -352,58x + 3,3355
a = -352,58
b = 3,3355
![]()
5. Wykresy
Wykres zależności log Ir = f(T-1)
Lp. |
Ir (mol/m3)2 |
Log Ir |
T[ºC] |
T[K] |
1/T[K] |
1. |
3,9121 · 10-9 |
-8,4075 |
26,0 |
299,0 |
0,003344 |
2. |
3,8669 · 10-9 |
-8,4126 |
36,1 |
309,1 |
0,003235 |
3. |
3,8970 · 10-9 |
-8,4092 |
46,1 |
319,1 |
0,003133 |
4. |
4,7298 · 10-9 |
-8,3251 |
56,0 |
329,0 |
0,003039 |
5. |
6,3264 · 10-9 |
-8,1988 |
65,1 |
338,1 |
0,002957 |
6. |
8,3889 · 10-9 |
-8,0763 |
74,9 |
347,9 |
0,002874 |
Wykres pomocniczy zależności log K = f(T-1) regresja liniowa.
Lp. |
K |
Log K |
T[K] |
1/T[k] |
1. |
155,7 |
2,1923 |
299,0 |
0,003344 |
2. |
154,8 |
2,1897 |
309,1 |
0,003235 |
3. |
155.4 |
2,1914 |
319,1 |
0,003133 |
4. |
171.2 |
2,2335 |
329,0 |
0,003039 |
5. |
198,0 |
2,2966 |
338,1 |
0,002957 |
6. |
228,0 |
2,3579 |
347,9 |
0,002874 |
WNIOSKI:
W stanie równowagi chemicznej stosunek iloczynu stężeń molowych produktów do iloczynu stężeń molowych substratów substratów danej temperaturze, dla danej reakcji jest wielkością stała.
Stała równowagi reakcji chemicznej nie zależy od stężeń lub ciśnień, ale zmienia się wraz z temperaturą. Ze wzrostem temperatury maleje wartość K dla reakcji egzotermicznych, egzotermicznych rośnie dla reakcji endotermicznych.
Wyszukiwarka
Podobne podstrony:
przykład sprawozdania, Technologia chemiczna, Projekt technologiczny, Projekty, fwd pd , projekt tec
przykład sprawozdania2, Technologia chemiczna, Projekt technologiczny, Projekty, fwd pd , projekt te
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
sprawozdania, Technologia chemiczna, Chemia organiczna, Semestr 3, Laborki
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
Sprawozdania z technologii betonu, Przygotowanie próbnego zarobu, 1
Sprawozdania z technologii betonu, wytrzymałość na ściskanie, 1
Sprawozdania z technologii betonu, Zginanie 2, 1
sprawozdanie technolgia betonów i zapraw, recepta robocza moja, ETAP 6 - SPORZĄDZENIE RECEPTY ROBOCZ
sprawozdanie technolgia betonów i zapraw, Tech. betonw sprawko 3a, Bydgoszcz, dnia 28
Sprawozdania z technologii betonu, betony-sciaga-samson, SPOIWA
sprawozdanie technolgia betonów i zapraw, Tech. betonw sprawko 3a, Bydgoszcz, dnia 28
Sprawozdania z technologii betonu, betony-sciaga-samson, SPOIWA
Sprawozdanie 3 Właściwości chemiczne metali, Politechika Białostocka, budownictwo semestr I 2013-201
moje sprawozdania Technologia łączenia tworzyw sztucznych
Kinetyka frakcji-sprawozdanie, technologia wody i sciekow Jachimko
Przykłady zastosowań technologii RFID w magazynach, ABC Magazynu
więcej podobnych podstron