131. Szkielet komórkowy
Szkielet komórkowy (cytoszkielet) to system białkowych filamentów, ktory rozpościera się w cytozolu. Jego funkcje to:
kotwiczenie organelli we właściwych miejscach,
uczestniczenie w ruchu organelli, pęcherzyków, kompleksów białkowych
nadawanie komórkce właściwego kształtu i wytrzymałości mechanicznej (bez cytoszkieletu błona komórkowa przyjmuje automatycznie kształ kulisty
kotwiczenie komórki do macierzy zwenątrzkomórkowej i innych komórek
uczestniczenie w ruchu komórki
Cytoszkielet skłąda się z trzech głownych rodzajów włókienek: mikrofilamentów aktynowych, filamentów pośrednich (budowanych przez wiele białek, ale podobnych do siebie) oraz mikrotubul zbudowanych z alfa i beta tubuliny. Organizuje komórkę nie tylko umiejscawiając organella tam gdzie powinny być, ale też porządkując kompleksy białkowe cytozolu oraz białka błony komórkowej (tę role pełnią filamenty szkielet błonowego, prawdopodobnie organizują w pewien sposób również lipidy błonowe). Cytoszkielet, jest niezbędny do ruchu komórki jako całości. Mikrotubule tworzą wikti i rzęski (eukariotyczne), a mikrofilamenty aktynowe biorą udział w ruchu pełzakowatym.
Cytoszkielet jest strukturą dynamiczną. Różne filamenty mają zdolość ciągłej polimeryzacji i depolimeryzacji, a w regulację tych procesów zaangażowanych jest wiele białek.
132. Główne systemy szkieletu komórkowego.
Mikrofilamenty aktynowe: średnica 8-9nm, zbudowane z jednostek globularnej aktyny tworzącej skeconą dwuniciową strukturę. Biorą udział w odporności mechanicznej komórki i ruchach pełzakwoatych komórki
Filamenty pośrednie: zbudowane z wielu spokrewnionych białek mają strukturę skręconej liny, ale nie wiadomo jak dokładnie układają się monomery. 10nm średnicy. Utrzymują stały kszałt komórki, kotwiczą aktynowe i mikrotubularne struktury. Utrzymują prawidłową architekturę jądra i organizację chromatyny. Tworzą szklielet błonowy.
Mikrotubule: mają postać rurek o sednicy 24nm. Zbudowane są z protofilamentów dimerów alfa i beta tubuliny. Ich ajwazniejszą rolą jest przemieszczanie organelli i pęcherzyków transportowych oraz rozdział chromosomów w czasie podziału komórki.
133. Mikrofilamenty
Mikrofilamenty to włókienka mające postać dwóch nawiniętych w okół siebie łańcuhców monoerów aktyny. Mają średnice 8-9nm, a aktyna to białko o masie 42kDa. Głównym zadaniem tych filamentów jest zapenwianie komórce mobilności, odporności mehcanicznej i przesuwanie organelli podczas ruch kmórki. Na tą funkcję składają się dwa aspekty. Po pierwsze, szkielet aktynowy jest ogromny. W mieśniach aktyna stanowi 10% masy komórki, a nawet w innych komórkach jest jej bardzo dużo. Sama polimeryzacja i depolimeryzacja mikrofilamentów, zmieniająca strukturę szkieletu aktynowego wystarczy do zmiany kształtu i poruszania komórką (po prostu mikrofilamenty rozpychją komórkę w odpowiednim kieruku). Po drugie, po mikrofilamentach poruszają się białka motoryczne (głównie miozyna), które przenoszą organella, pęcherzyki i inne filamenty po mikrofilamentach (o białkach motorycznych należy również ogólnie wspomnieć w 131, nie chce mi się już tam dopisywać). Polimeryzacja aktyny w formę filamentów jest zależna od obecności jonów magnezu posatu i sodu, a proces ten, podobnie jak depolimeryzację i rozgałęziane, kontroluje wiele białek. Mikrofilamenty wykazują polarność. Maja koniec + i -, a wszystkie monomery aktyny zwrócone są w tą samą stronę (należy o tym wspomnieć przy 131 i 132).
134. Aktyna g i aktyna f
Aktyna to najliczniejsze białko wnętrza komórki. Ma masę 42kDa i jego sekwencja jest bardzo konserwatywna. Wszystkie eukariotyczne aktyny (Lodisz mówi: od ameby do człowieka) mają ok 80% homologii. Aktyna może występować w dwóch formach: monomerycznej, globularnej G oraz polimerycznej, filamentarnej F. U kręgowców występuje 6 izoform lamin: 4 rodzaje alfa aktyn w mięśniach, gamma aktyna budująca włókna naprężeniowe komórek niemięśniowych i beta aktyna tworząca "leading edge" czyli aktynowe struktury przedniej krawędzi poruszającej się lub zmieniającej kształ komórki. Monomer aktyny składa się jakby z dwóch półkul, pomiędzy którymi znajduje się wcięci ze skompleksowanym jonem magnezu, który może wiązać ATP lub ADP (ATPase fold). W zależności których z tych dwóch jest związany półkule są inaczej ustawione wobec siebie. Aktyna bez żadnego nukleotydu jest szybko degradowana.
W F aktynie każdy monomer znajduje się w kontakcie z czterema innymi. Jednym poniżej, jedynm powyżej i dwoma obok. F aktyna ma swój + i - koniec, a każdy monomer jest ustawiony w ten sam sposób. Plus to ta strona monomeru, a więc i koniec filamentu, od którego strony nie ma dostępu do domeny wiążącej ATP. Plus to strona z eksponowaną do roztworu domentą wiążącą ATP.
135. Polimeryzacja aktyny i jej regulacja in vitro i in vivo
In vitro, polimeryzacja aktyny jest kontrolowana przez stężenie soli (a konkretnie jonów Mg2+, Na+ i K+) oraz stężenie G-aktyny. Powyżej stężenia krytycznego G-aktyna zaczyna spontanicznie polimeryzować tworząc sieć rozgałęzionych filamentów. Obniżenie stężenia poniżej stężenia krytycznego spowoduje depolimeryzację F-aktyny. Stężenie krytyczne jest mniejsze dla końca +, co oznacza, że konce plus rosną szybciej, a dla stężeń G-aktyny pomiędzy krytycznymi dla + i - nowe monomery są dodawane na + i oddysocjowyują na -. W stanie równowagi, kiedy stężenie G-aktny jest średnią stężeń krytycznych obu końców, długość F-aktyny nie zmienia się, ale następuje ciągły "przepływ" monomerów przez filament, jak w taśmociągu (po ang. Treadmilling), stężenie to w normlanych warunkach wynosi 0,1μM. Monomery G-aktyny w F-aktynie powoli hydrolizują ATP tworząc F*ADP-aktynę, co stabilizuje filamenty. Nie jest to jednak konieczne do ich utworzenia, bo G-aktyna związana z nierozkładalnymi analogami ATP też polimeryzuje.
Taka spontaniczna polimeryzacja ma 3 fazy. W pierwszej fazie - lag - tworzą się niestabilne oligomery G-aktyny. Kiedy osiągną długość 3-4 monomerów dają zarodki filamentów i rozpoczyna się druga faza, gwałtownego przyrostu. Następnie, kiedy stężęnie G-aktyny ustali sia na poziomie stężenia krytycznego, nastaje stan równowagi i tyle samo aktyny jest polimeryzowanej co depolimeryzowanej.
In vivo regulacja nie jest taka prosta, ponieważ stężenia jonów muszą być utrzymywane na mniej więcej tym samym poziomie. Komórki więc używają białek promujących polimeryzację lub depolimeryzację. Musi tak być, ponieważ w warunkach komórki (dość duża siła jonowa, 0,5μM stężenie aktyny) prawie cała aktyna byłaby spolimeryzowana, a tak nie jest. Przykładem białka inhibującego polimeryzację, jest tymozyna β4. To małe białko o masie 5kDa wiąże G-ATP-aktyne w stosunku 1:1, uiemożliwiając jej polimeryzację. W płytkach krwi, nawet 70% G-ATP-aktyny jest związane z tymozyną. W ten sposób tymozyna kontroluje stężęnie F-aktyny, bo zmieniająć stężenie wolnej G-aktyny zmienia równowagę między F i G aktyną.
Białkiem promującym polimeryzację jest np. Profilina. Ona również wiąże G-aktynę w stosunku 1:1 ale z drugiej strony, nie zasłaniając miejsca wiązania ATP. Pomaga ona wymienić ADP G-aktyny, która właśnie oddysocjowała od filamentów na ATP i przyłączyć się takiej G-aktynie do końca + filamentu (jest tam rekrutowana przez forminę, o której zaraz). Warto wspomnieć, że profilina jest jedynym białekim wiążącym G-aktynę, które nie zasłania miejsca wiązania ATP. Poza tym, prolifina reaguje z PIP2, który pojawia się w komórce w odpowiedzi na szlaki sygnalizacyjne. Taka interakcja blokuje wiązanie G-aktyny, czyli inhibicję profiliny. Oprócz tego profilina wiąże błonowe białka bez zahamowania aktywności, co powoduje powstawanie F-aktyny pod błoną.
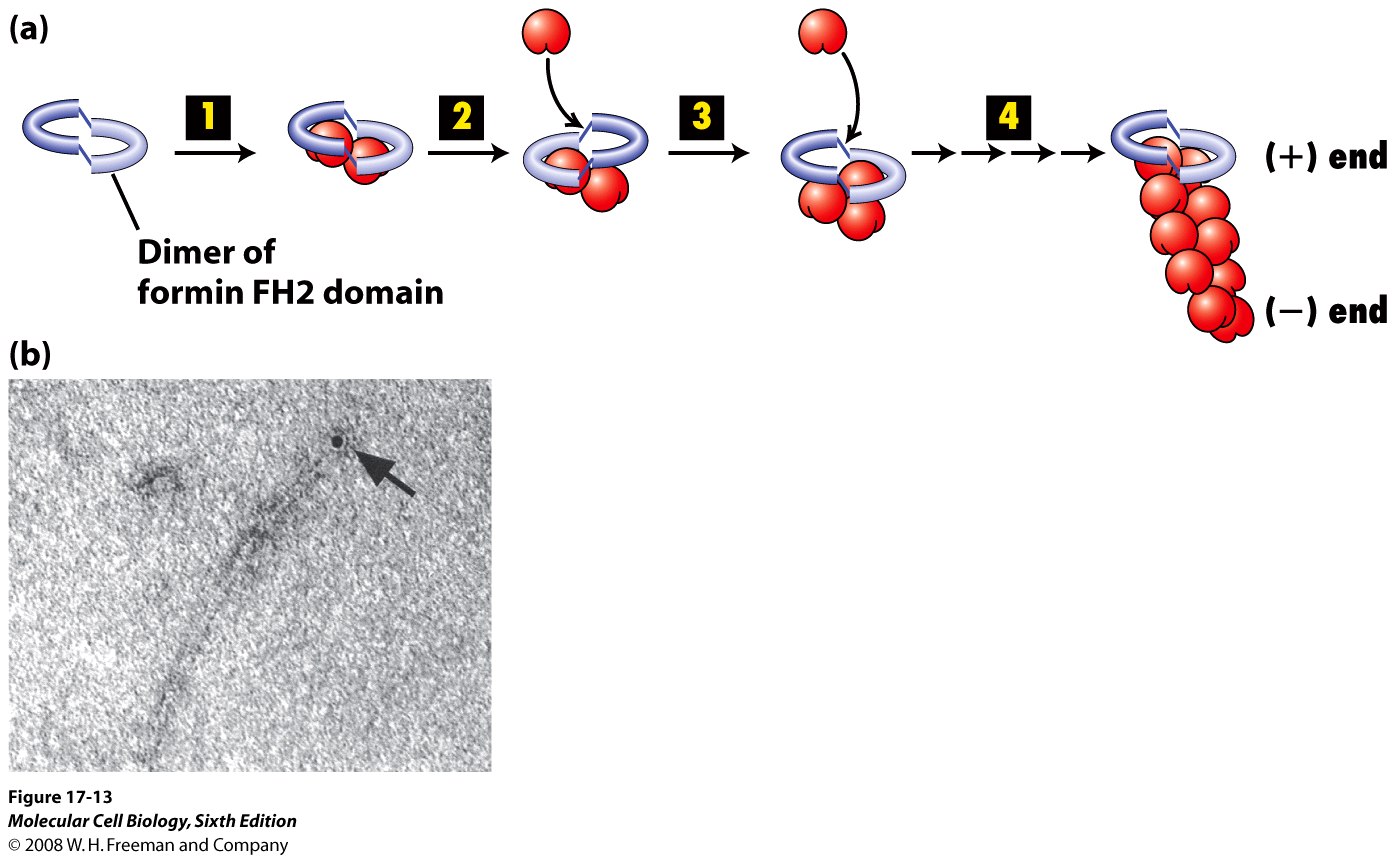
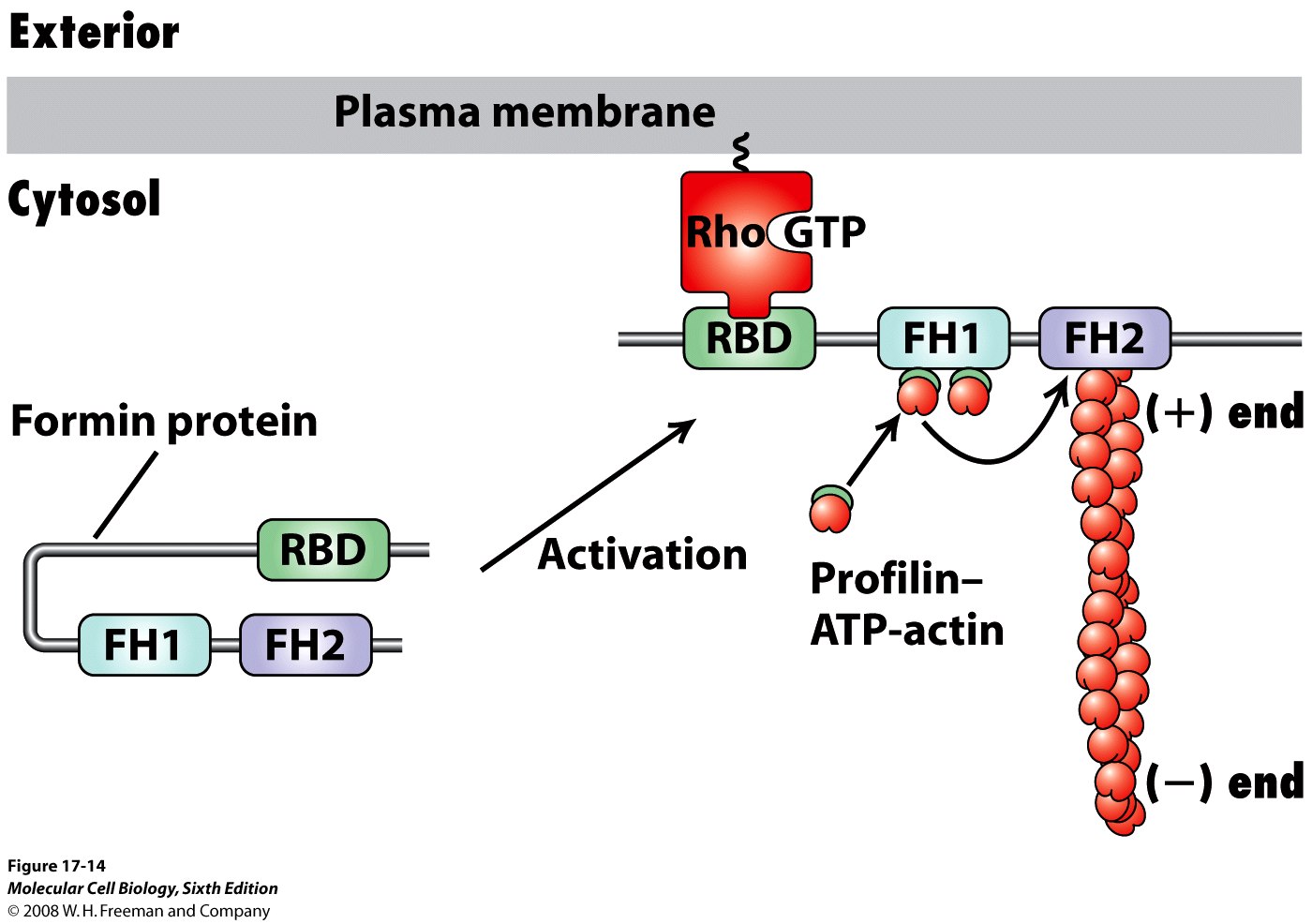
Niezwykle istotnymi białkami dla polimeryzacji aktyny in vivo są frominy. To różorodna grupa białek, jadnak wszystkie zawierają domeny FH1 i FH2. Dimer domen FH2 przyłącza dwie podjednostki G-aktyny (ich + końcem) i powoduje powstanie zarodka nowego filamentu. Formina pozostaje związana z + końcem, a jednocześnie on polimeryzuje. Jest to możliwe, ponieważ formina "kiwa się" na + końcu F-aktyny, raz wiążąc monomer z jednej, raz z drugiej strony. Domeny FH1 rekrutują na + koniec nowego filamentu profilinę niosącą G-ATP-aktynę. Jednocześnie, formina blokuje wiązanie białke "cappujących", które mogłyby blokować wzrost filamenty, dlatego filament F-aktyny powstałe dzięki forminie sa bardzo długie. Tak powstają np. Włókna naprężeniowe. Oczywiście, aktywnośc forminy jest regulowana. Normlanie istnieje ona w zamkniętej, "zawiniętej" konformacji, w której domeny FH związane są przez jej C-koniec. Związanie z aktywnę formą błonowej GTP-azy - Rho - pozwala na rozwinięcie się forminy i jej aktywność.
Wyszukiwarka
Podobne podstrony:
JW 142 152 cytoszkielet3
131 135
Mindell O sztuce terapii metaumiejętności str 1 2, 13 53, 131 135(1)
131 135
4 Spawanie w gazach ochronnych MIG (131), MAG(135)
III CSK 135 05
135 136
131 Duszpasterstwo indywidualne
135. Koncepcja Strategiczna Sojuszu...., STUDIA EDB, Obrona narodowa i terytorialna
Cytoszkielet - histologia, I rok, I rok, gieldy, pen, medycyna, 2 semestr, HISTOLOGIA
AVT 135 Cyfrowa skala częśt
131 166 ROZ w spr okreslenia Nieznany (2)
131
135 136
PaVeiTekstB 131
Dz U Nr 135 Poz 1140 W sprawie szkolenia i egzaminowania osób maj cych dostp do materiałów wybuchowy
obrbka cieplna 131
jw pomal 2005
więcej podobnych podstron