142. Miozyny
Miozyny to białka będące motorami molekularnymi. Wykorzystują energię z hydrolizy ATP do przemieszczania się po filamentach aktynowych. W komórce, ruchy te wykorzystywane są do przemieszczania organelli, pęcherzyków, w endocytozie, cytokinezie, skurczu włókien mięśniowych i w wielu innych procesach. Istnieje wiele rodzajów miozyn, niektóre z nich przedstawia tabelka. Wszystkie miozyny mają jeden lub dwa łańcuchy ciężkie i różną liczbę łańcuchów lekkich, pełniących funkcje regulatorowe. Łańcuchy ciężkie mają charakterystyczne domeny główki, szyjki i ogona. Głowa zawiera miejsce aktywności ATP-azowej i to ona odpowiada za ruch, szyjka stanowi dźwignię dla głowy i miejsce przyczepu łańcuchów lekkich, a ogon może tworzyć dimery coiled-coil z innymi miozynami i odpowiada za konkretną rolę danego typu miozyn, łącząc się z różnymi rzeczami. Miozyny poruszają się po aktynie krokami, a na każdy krok hydrolizowana jest cząsteczka ATP. W zależności od rodzaju, krok waha się w granicach 5-36nm. W większości przypadków im dłuższa szyjka tym dłuższy krok, choć nie zawsze. Miozyny poruszają się w stronę + filamentu aktynowego, z wyjątkiem miozyny VI. Wszystkie miozyny regulowane są stężeniem jonów wapnia, choć w rożny sposób. Miejsca wiązania wapnia znajdują się na łańcuchach lekkich i to ich różnorodność odpowiada za różne sposoby regulacji.
143. Miozyny niemięśniowe.
Niemięśniowe miozyny to przede wszystkim miozyna I, V i VI odpowiedzialne za transport pęcherzykowy oraz miozyna XI odpowiedzialna za prąd cytoplazmy w komórkach glonów i roślin. Pierwsza grupa wiąże ogonami błony pęcherzyków transportowych, w nieznany do tej pory sposób, i przeciąga je po filamentach aktynowych. Miozyny te występują jako pojedyncze monomery albo dimery. Takie małe cząsteczki ie odpadają od filamentu dlatego, że przez większość cyklu ATP-azowego (czyli cyklu ich pracy) pozostają przyczepione do filamentu, mimo iż ich pojedyncze części się poruszają.
Miozyna XI to jedna z najszybszych miozyn. Przeciąga ona błony ER i pęcherzyki transportowe w komórkach glonów i roślin po filamentach aktynowych położonych pod błoną komórkową i warstwą chloroplastów. Dzięki temu w komórce roślinnej mamy nieruchomą cytoplazmę z chloroplastami zaraz pod błoną, potem warstwę filamentów aktynowych a potem warstwę krążącej wokół wakuoli cytoplazmy
Komórki niemięśniowe, tak jak mięśniowe zawierają miozynę II tworzącą grube filamenty przesuwające się wzdłuż filamentów aktynowych i dających w efekcie kurczliwe struktury. Nie są one jednak tak dobrze zorganizowane jak sarkomery i mogą być przejściowe. Komórki nabłonka mają pas takich włókien dookoła siebie w miejscu gdzie łączą się jedna z drugą tight junctions. Ponadto włókna naprężeniowe również są takimi elemantami kurczliwymi. Rozpościerają się one w komórce między miejscami adhezji do podłoża i głównie odpowiadają za jej wytrzymałość mechaniczną. Oprócz tego kurczący się pierścień powodujący cytokinezę też składa się z takich włókien.
144.Kinetyka polimeryzacji aktyny i tubuliny.
Kinetyka polimeryzacji aktyny już była.
Kinetyka polimeryzacji tubuliny:
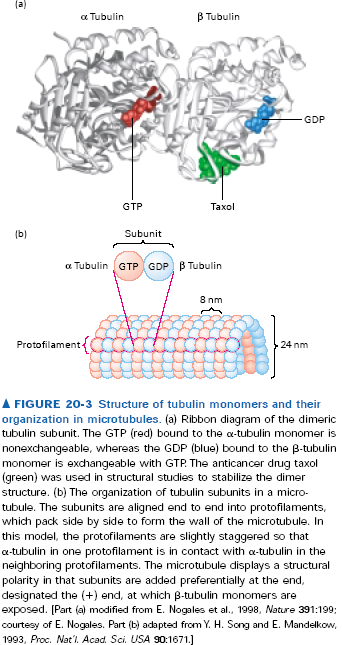
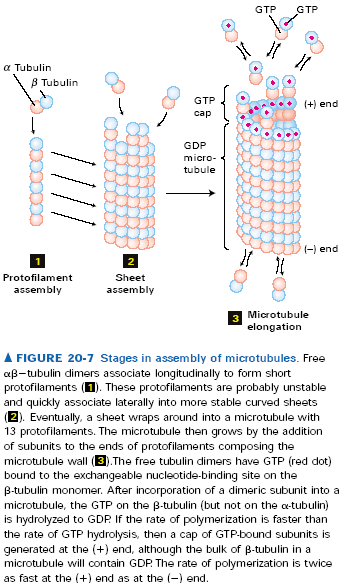
Mikrotubule składają się z podjednostek będących dimerami alfa i beta tubuliny. Oba te białka o masie ok 55kDa wiążą GTP, jednak wiązanie z alfa tubuliną jest nieodwracalne, bo GTP jest wciskane między dwie podjednostki. Takie dimery asocjują ze sobą „head-to-tail” tworząc protofilamenty, w których kolejne podjednostki są co 8nm. To pierwszy stopień polimeryzacji mikrotubul. Takie protofilamenty są niestabilnie i asocjują bokami, wskutek czego powstają płaskie warstwy mikrofilamentów (ang. sheets), które zaginają się, aż w końcu 13 protofilamentów zawija się tworząc rurkowatą mikrotubulę. Taka pojedyncza tubula może dodać kolejne 10 protofilametów tworząc podwójną, albo jeszcze 10 tworząc potrójną.
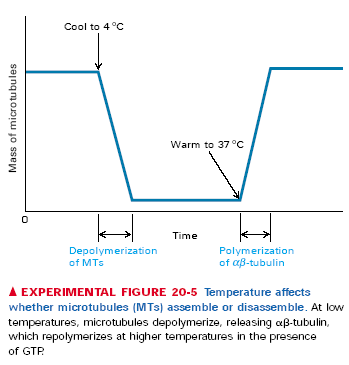
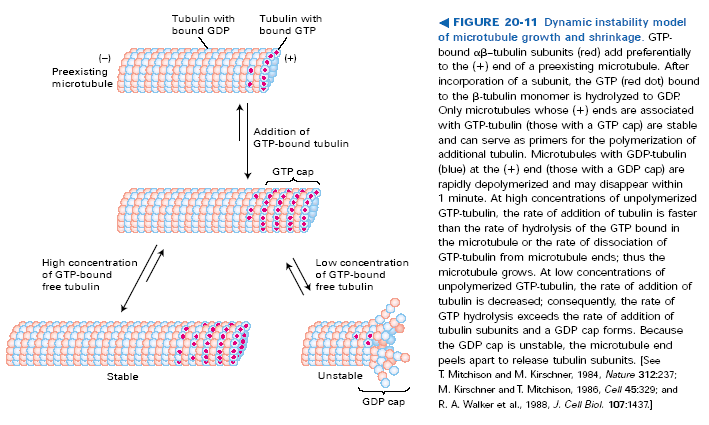
Wszystkie podjednostki we wszystkich protofilamentach zwrócone są w tą samą stronę tak, że mikrotubule mają koniec + i -. + jest tam gdzie mikrotubula kończy się beta-tubuliną, - tam gdzie alfa tubuliną. Podobnie jak przy aktynie plus koniec rośnie dużo szybciej, a jest to związane z tymi wspomnianymi wcześniej różnicami w sposobie wiązania GTP. Odmienny sposób wiązania GTP/GDP powoduje różnice w krytycznym stężeniu wolnej alfa/beta tubuliny, które jest niższe dal plus końca. Podobnie jak z mikrofilamentami, dla stężeń pośrednich obserwuje się treadmilling. Starsze podjednostki, tzn te dalej od plus końca mają GDP związane z beta tubuliną, to je stabilizuje. I jeszcze jedno, protofilamenty nie muszą rosnąć równo, tzn. plus końce mikrotubul są postrzępione. Depolimeryzacja tubul prawdopodobnie odbywa się jakimś innym mechanizmem i najpierw niszczone są boczne oddziaływania między protofilamentami, bo depolimeryzujące mikrotubule mają rozczapierzone końce. Aha, jeszcze jedno: polimeryzacja mikrotubul jest wrażliwa na temperaturę, w niskiej temperaturze nast. Depolimeryzacja.
145. Dynamiczna niestabilność mikrotubul.
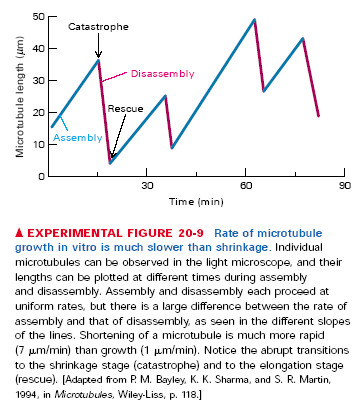
In vitro zaobserwowano, że w danych warunkach cześć mikrotubul rośnie a część się kurczy, mimo że wszystkie są w takich samych warunkach. Jak się później okazało taka sytuacja ma też miejsce in vivo, tylko że dotyczy głównie + końców, bo - końce są zablokowane w MTOCs (microtubule organization centres, np. centrosomy). To zjawisko nazywa się dynamiczną niestabilnością mikrotubul. Należy jeszcze dodać, że tempo skracania się jest ok. 7 razy większe niż wydłużania się, a przejścia między tymi fazami bardzo szybkie, nazywane odp. Katastrofą i ratunkiem. Za to zjawisko odpowiadają dwa parametry. Po pierwsze możliwe jest ono tylko przy stężeniach wolnych dimerów tubuliny w okolicach stężenia krytycznego. Po drugie, to czy mikrotubula rośnie czy kurczy się zależy od tego, czy dimery na jej + końcu mają związane GTP czy GDP. Dodawane dimery mają zawsze GTP, ale jeśli prędkość dodawania nowych dimerów spadnie poniżej prędkości hydrolizy GDP, to + koniec obramowany będzie tubuliną beta z GDP. Powoduje to odszczepienie się protofilamentów, a jak już wspomniałem pojedyncze protofilamenty są niestabilne i rozpadają się na dimery tubuliny. Duże stężenie wolnej GTP-tubuliny zapewnia obramowanie + końca dimerami z GTP.
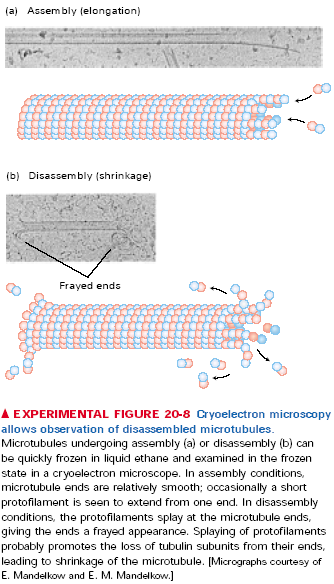
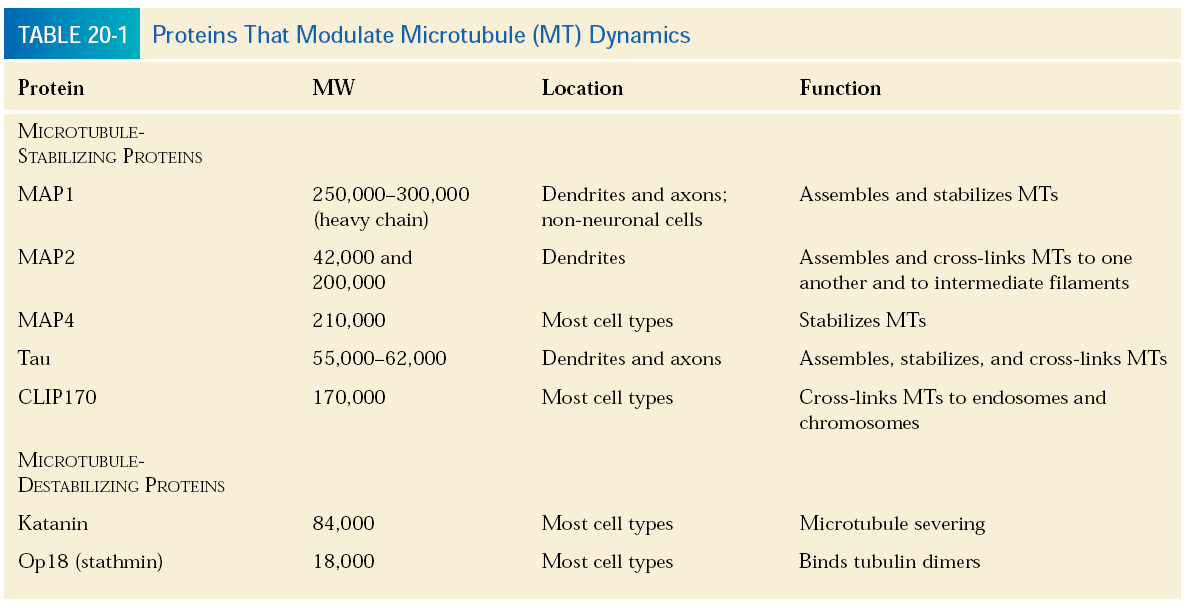
Dynamiczną niestabilność tubuliny może kontrolować wiele białek o wspólnej nazwie MAP (microtubule associated proteins - białka związane z mikrotubulami). Mogą mieć wpływ stabilizujący albo destabilizujący. Nie będę ich tu opisywał bo nie ma zagadnienia „białka wiążące tubulinę”, ale dam tabelkę.
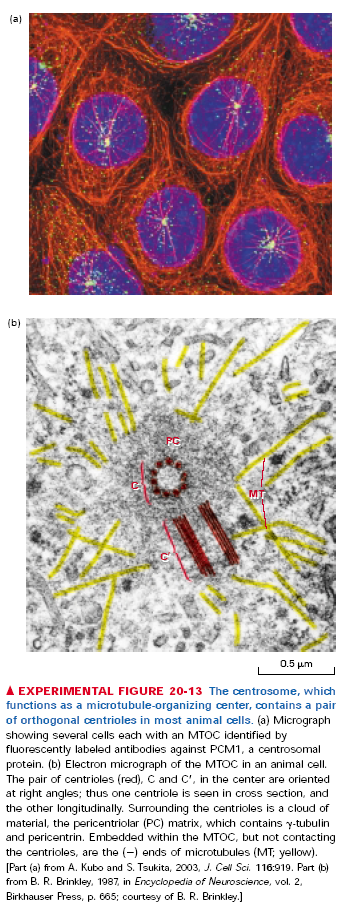
146. Ciałka podstawowe, centriole
Centriole to cylindry powstałe z, najczęściej 9, potrójnych mikrotubul. Znajdują się (po 2, ułożone prostopadle) w środku centrosomów - głównych MTOC komórek zwierzęcych (nie we wszystkich komórkach). Centriole biorą udział w podziale komórki, organizując wrzeciono podziałowe i biorąc udział w cytokinezie. Organizują także interfazowy szkielet mikrotubularny. Nie kontaktują się jednak bezpośrednio z końcami - mikrotubul zakotwiczonych w centrosomie. Otoczone są macierzą okołocentriolową, która zwiera m.in. gamma tubulinę biorącą udział w powstawaniu i kotwiczeniu nowych mikrotubul.
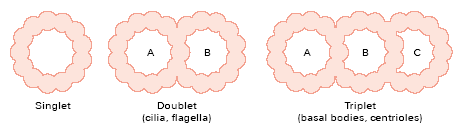
Centriole występują również w ciałkach bazalnych - MTOCach odpowiedzialnych za tworzenie i działanie rzęsek i wici. Takie ciałka stanowią jedną centriolę i krótką cylindryczną wiązkę mikrotubul. Stanowią one zarodek aksonemy, czyli grupy mikrotubul stanowiących rdzeń witki/rzęski i podpierają ją. 4 to ciałko bazalne, 6 to przekrój.
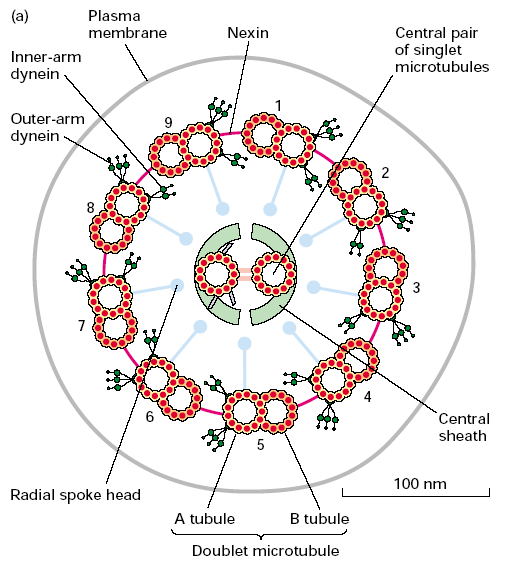
147. Aksonema wici i rzęsek, szkielet mikrokosmka.
Aksonema to centralna wiązka wici i rzęsek eukariotycznych. Składa się z 9 podwójnych mikrotubul ułożonych cylindrycznie dookoła 2 pojedynczych centralnych mikrotubul. Wszystkie te mikrotubule zwrócone są końcem - do podstawy wici/rzęski. Oprócz tego występują tam białka łączące. Centralne mikrotubule są połączone mostkami białkowymi (jak drabina) i otoczone osłonką wewnętrzną. Wystają z niej radialne wiązki białek łączące się z dubletami mikrotubul, które prawdopodobnie mają rolę regulacyjną. Poszczególne dublety są połączone między sobą neksyną, która ogranicza ich wzajemne ślizganie. Na każdym dublecie znajdują dwie wiązki dynein przyczepionych na stałe, ramie wewnętrzne i zewnętrzne. Te dyneiny są bardzo duże, znacznie większe od i tak dużych cytozolowych. Ich ogony zakotwiczone są w mikrotubuli A jednego dubletu, a główki poruszają się po mikrotubuli B drugiego dubletu w stronę -. W ten sposób dublety ślizgają się po sobie, a wspomniane już neksyny ograniczają te ruchy i powodują wygięcie aksonemy. Sekwencyjne wygięcia w przeciwne strony odpychają komórkę od płynu w którym się znajduje (takie same ruchy wykonuje ryba płynąc).
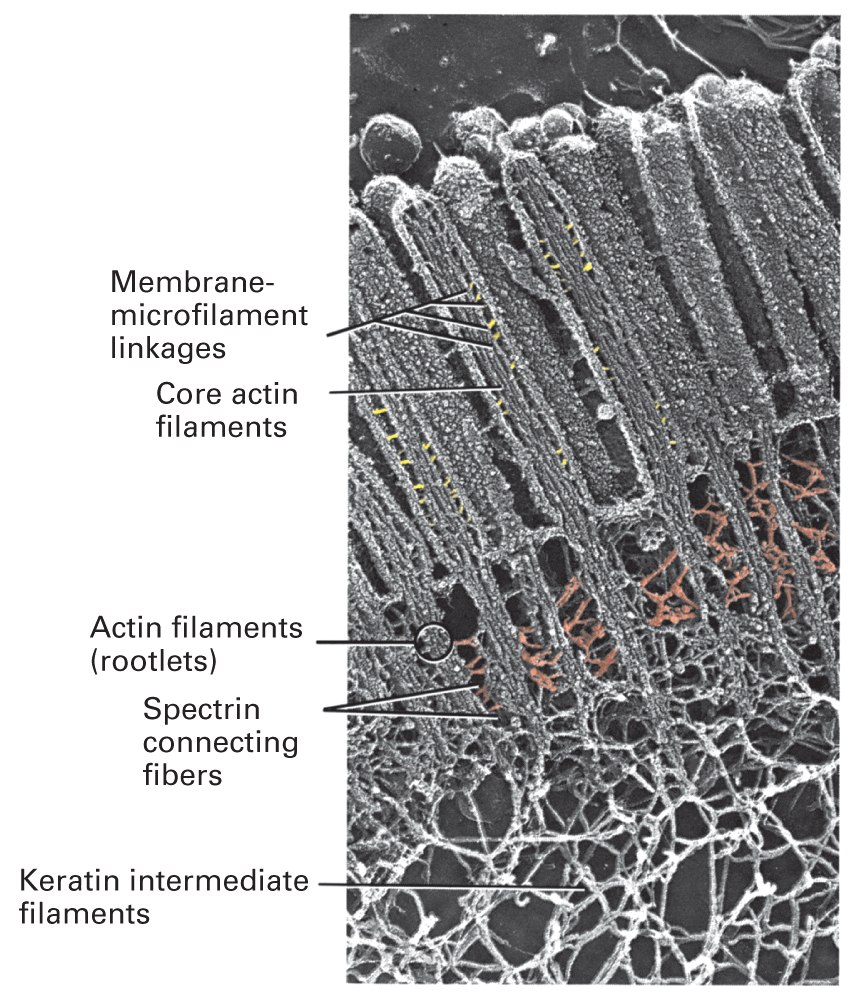
Szkielet mikrokosmków składa się z rdzenia włókienek aktynowych, przyłączonych do błony miozyną I oraz połączeń błonowych z ezryną, jak w tym zagadnieniu o połączeniach. Korzonki filamentów aktynowych wystają do głównego ciała komórki, gdzie łączą się z podbłonowym szkieletem spektrynowym i keratynowymi filamentami pośrednimi. Takie połączenia utrzymują mikrokosmek w pozycji wyprostowanej.
148. Nukleotydy i alkaloidy wiążące się z tubuliną.
Nukleotydy to oczywiście GTP i GDP, których wiązanie i rola zostały omówione wcześniej.
Alkaloidy:
kolchicyna i jej syntetyczna pochodna kolcemid. Alkaloidy te w dużym stężeniu powodują depolimeryzację mikrotubul, ale w małym powodują tylko zablokowanie ich wzrostu. Prowadzi to do zatrzymania komórek w mitozie w metafazie. Po przemyciu komórek roztworem bez kolchicyny mitoza rusza dalej. Można to wykorzystać w hodowlach komórkowych aby uzyskać komórki zsynchronizowane w fazie cyklu komórkowego. Substancje te wiążą się z dimerami tubuliny między alfa i beta tubuliną silnie, ale odwracalnie. Takie dimery mogą się wiązać z mikrotubulami, ale powodują zablokowanie końców przed dodawaniem nowych i stabilizują mikrotubule.
Taksol. Ten roślinny alkaloid w niewielkim stężeniu stabilizuje mikrotubule przez inhibicję ich depolimeryzacji.
149. Rola szkieletu mikrotubularnego.
Szkielet mikrotubularny ma wiele ważnych ról w komórce, a są to:
Poruszanie komórki za pomocą wici i rzęsek
przenoszenie pęcherzyków dzięki białkom motorycznym chodzącym po powierzchni mikrotubul - kinezynie i dyneinie
Uczestniczenie w podziale materiału genetycznego w czasie podziału komórkowego
Organizacja przestrzenna komórki - ustawiane organelli na miejscach
Migracja i wydłużanie się aksonów oraz transport w obrębia aksonów.
150. Właściwości aktyny i tubuliny
To właściwie już było wszystko. Trzeba napisać o strukturach samych cząsteczek, jak polimeryzują i co tworzą i że jedna wiąże ATP/ADP a druga GTP/GDP.
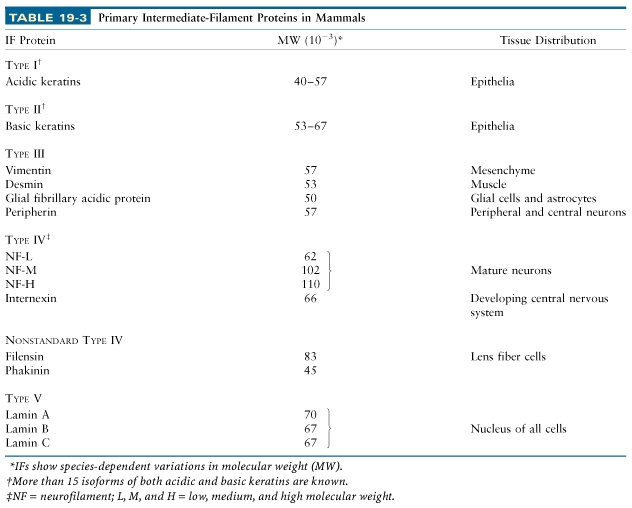
151. Filamenty pośrednie - główne klasy
Filamenty pośrednie występują w komórkach zwierzęcych, a nie występują w roślinnych czy grzybowych. Pełnią przede wszystkim rolę strukturalną. Nie ma na razie żadnych znanych mechanizmów ruchu związanych z filamentami pośrednimi. Ich monomery są wydłużone i tworzą struktury coiled-coil. Nie wiążą też żadnych nukleotydów i nie potrzebują hydrolizy ATP do polimeryzacji. Są najstabilniejszą formą cytoszkieletu. Ich podział na główne klasy przedstawia tabelka:
152.Struktura filamentów pośrednich.
Monomery białek filamentów pośrednich, w przeciwieństwie do pozostałych elementów cytoszkileletu nie są globularne. Posiadają one małą N-koncową globularną głowę i większy C-końcowy globularny ogon, ale pomiędzy nimi znajduje się wydłużona alfa helikalna domena „rod”, która może asocjować bocznie tworząc dimer ze strukturą coiled-coil. Dimery takie dimeryzują bokami dając tetramery. W tetramerach dimery ustawione są antyrównolegle. W ten sposób tetramer jako całość jest symetryczny. Następnie tetramery asocjują końcami tworząc skręcone włókna o średnicy 10nm. Ponieważ tetramery są symetryczne, to filamenty pośrednie nie mają różnych + i - końców. Ale na dobrą sprawę nie wiadomo jak dokładnie filamenty pośrednie asocjują, więc to tylko najbardziej prawdopodobna historia. Mimo iż bardziej stabilne od reszty cytoszkielety filamenty pośrednie wykazują pewną dynamikę i dodanie monomerów do istniejących włókien spowoduje, że się dołączą. Za kontrolę asocjacji odpowiada fosforylacja - ufosforylowane białka filamentów pośrednich dysocjują od siebie (prawdopodobnie zostają w formie dimerów lub tetramerów). Co ciekawe, niektóre białka mogą tworzyć heterofilamenty - czyli filamenty z różnymi białkami filamentów pośrednich.
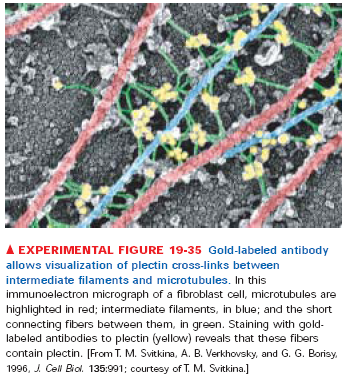
Istnieje szereg białek łączących filamenty pośrednie ze sobą, mikrotubulami i mikrofilamentami. Nazywają się wspólnie IFAP(intermediate filaments associated proteins) i mało o nich wiadomo.
Wyszukiwarka
Podobne podstrony:
JW 131 135 cytoszkielet1
Dz U 02 142 1194 obowiązek dostarczania karty charakterystyki niektórych preparatów niezaklasyfi
142 315
Ir 1 (R 1) 127 142 Rozdział 09
142 144
MPO P1 1P 152
140 142
152 System C sprezenie zewnetrzne bezprzyczepnosciowe
142 143id 15728 Nieznany
152
Cytoszkielet - histologia, I rok, I rok, gieldy, pen, medycyna, 2 semestr, HISTOLOGIA
GA P1P2P4P5 142 model
MJA P1 1P 152
Dz U 2001 nr 142 poz 1592
jw pomal 2005
plik (152)
JW Energetyka Starosta 1 rok, Regulamin laboratorium Metrologii
GM P1 142 Rozwiazania zadan i s Nieznany
więcej podobnych podstron