I Pracownia ZakÅadu Fizyki PL
Nazwisko Staniszewski PaweÅ i imiÄ |
WydziaÅ ZiM 3,5 Grupa |
|||||||
Data 07,12,98 wyk. Äwicz |
Numer Äwicz 7.1 |
Temat Wyznaczanie rÃģwnowaÅžnikÃģw elektrochemicznych, metali staÅej Faraday`a i Åadunku elementarnego. |
||||||
Zaliczenie
|
Ocena |
Data |
Podpis
|
|||||
Zestawienie wynikÃģw:
J = 1A
t = 1800s
m1 = 0,2886 kg
m2 = 0,2892 kg
Podstawy teoretyczne:
W wodnym roztworze siarczanu miedzi, pod wpÅywem wody czÄ steczki CuSO4 rozpada siÄ na jony Cu2+ i SO42-. Pole elektryczne wytworzone miÄdzy katodÄ i anodÄ powoduje wÄdrÃģwkÄ jonÃģw do odpowiednich elektrod. Kationy Cu2+ dÄ ÅžÄ do katody, gdzie ulegajÄ zobojÄtnieniu i osadzajÄ siÄ w postaci cienkiej warstwy miedzi. zachodzi wtedy reakcja:
Cu+2 + 2e â Cu
RÃģwnoczeÅnie aniony SO2-4 dÄ ÅžÄ do anody. Reszty kwasowe i grupy wodorotlenkowe nie wystÄpujÄ w stanie wolnym, reagujÄ wiÄc z materiaÅem anody lub teÅž czÄ steczkami rozpuszczalnika.
JeÅli jednym ze skÅadnikÃģw materiaÅu anody bÄdzie miedÅš, wÃģwczas zajdzie reakcja:
SO2-4 + Cu â CuSO4 + 2e
Utworzona w ten sposÃģb czÄ steczka CuSO4 przechodzi do roztworu i ulega znowu dysocjacji. W ten sposÃģb roztwÃģr siarczanu miedzi regeneruje siÄ, na skutek czego stÄÅženie roztworu, mimo osiadania jonÃģw na elektrodach, nie ulega zmianie.
RÃģwnowaÅžnik chemiczny wyliczamy z I prawa Faraday`a i jest rÃģwny liczbowo masie substancji wydzielonej w procesie elektrolizy na jednej z elektrod podczas przepÅywu Åadunku jednostkowego (q).
Åadunek (q), moÅžna wyraziÄ przez natÄÅženie prÄ du i czas trwania elektrolizy (q= i * t) , a wiÄc ostatecznie wzÃģr na rÃģwnowaÅžnik chemiczny ma postaÄ:
StaÅa Faraday`a ma postaÄ:
gdzie rÃģwnowaÅžnik chemiczny (R) jest rÃģwny ilorazowi masy atomowej (A)przez wartoÅciowoÅÄ (Z)
Natomiast wartoÅÄ Åadunku elementarnego jest ilorazem staÅej Faraday`a (F) przez liczbÄ Avogadra (NA)
Wykonanie Äwiczeni:
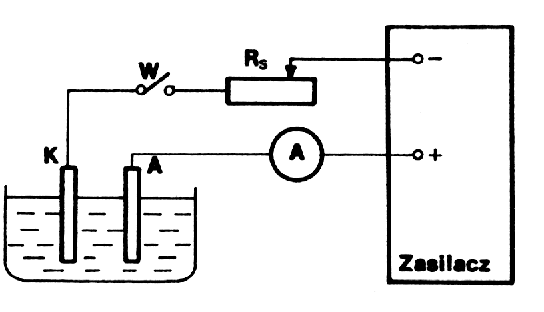
Schemat poÅÄ czeÅ przedstawia rysunek.
Elektrody oczyszczamy odpowiednio papierem Åciernym, spÅukujemy wodÄ destylowanÄ i osuszamy. NastÄpnie do woltametru wstawiamy katodÄ prÃģbnÄ , wlewamy elektrolit, wÅÄ czamy wyÅÄ cznik W
i opornikiem RS regulujemy natÄÅženie prÄ du w obwodzie. WartoÅÄ natÄÅženia ustalamy na 1A. Po tych czynnoÅciach wstÄpnych waÅžymy elektrodÄ pomiarowÄ (m1) i wstawiamy w miejsce elektrody prÃģbnej. Zamykamy obwÃģd wÅÄ cznikiem W, wÅÄ czajÄ c jednoczeÅnie sekundomierz. Czas trwania elektrolizy 30min (1800s). Po zakoÅczeniu elektrolizy, katodÄ opÅukujemy wodÄ zakwaszonÄ kwasem siarkowym, osuszamy i ponownie waÅžymy (m2).
Opracowanie wynikÃģw:
RÃģwnowaÅžnik chemiczny wyliczamy ze wzoru:
StaÅÄ Faraday`a :
a Åadunek elementarny wynosi:
Dyskusja bÅÄdu metodÄ rÃģÅžniczkowÄ :
BÅÄ
d wzglÄdny maksymalny wyliczamy logarytmujÄ
c, a nastÄpnie rÃģÅžniczkujÄ
c rÃģwnanie
, gdzie âm = m2 - m1
gdzie
â(âm) = 2*10-5kg
âm = 0,0006 kg
âi = (1 * 1,5)A/100 +1,5/75 = 0,015A + 0,02A = 0,035A
ât = 3 * 0,2s = 0,6s
BÅÄ d wzglÄdny maksymalny wynosi:
6,86%
Wnioski:
Äwiczenie nie nastrÄcza wiele kÅopotÃģw w czasie jego wykonania. DuÅžy wpÅyw na bÅÄ d ma niedokÅadnoÅÄ wagi technicznej ,na ktÃģrej waÅžono elektrodÄ, oraz bÅÄ d wskazania amperomierza.
4
1
Wyszukiwarka
Podobne podstrony:
Wyznaczanie rÃģwnowaÅžnikÃģw elektrochemicznych metali, staÅej?radayâa i Åadunku elementarnego
Wyznaczanie rÃģwnowaÅžnikÃģw elektrochemicznych metali, staÅej?radayâa i Åadunku elementarnego (2)
sprawozdanie? Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi i staÅej?radaya
Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi i staÅej?radaya na podstawie elektrolizy CuSO4x
Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi i staÅej?radaya na podstawie elektrolizy CuSO4
24.WYZNACZANIE RÃWNOWAÅŧNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAÅEJ FARADAYA., Fizyka
23 Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi oraz staÅej Faradaya
Wyznaczanie rÃģwnowaÅžnika elektro-chemicznego miedzi i staÅej Faraday'a, LABORATORIUM Z PRZETWORNI
24 WYZNACZANIE RÃWNOWAÅŧNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAÅEJ FARADAYA doc
wyznaczanie rÃģwnowaÅžnika elektorchemicznego miedzi i staÅej?radaya
1Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi i staÅej
WYZNACZANIE RÃWNOWAÅŧNIKA ELEKTROCHEMICZ, LABORATORIUM Z PRZETWORNIKËW
Cw 25 - Wyznaczenie rownowaznika elektrochemicznego miedzi, AKADEMIA TECHNICZNO-ROLNICZA W BYDGOSZCZ
Wyznaczanie rÃģwnowaÅžnika elektrochemicznego miedzi, laboratorium fizyczne, Laboratorium semestr 2 RÃ
3. Wyznaczanie wspÃģÅczynnika elektrochemicznego miedzi i staÅej Faradayâa, LAB10 02, Wyznaczanie rËw
wyznaczanie rownowaznika elektrochemicznego miedzi
Wyznaczanie rÃģwnowaÅžnika elektrochemicznego, Ëwiczenie 20
wiÄcej podobnych podstron