WYKŁAD I
Chemia jest nauką o substancjach, ich strukturze, właściwościach i reakcjach w których zachodzi przemiana jednych substancji w drugie.
Badania przemian chemicznych obejmują także: mechanizmy reakcji, sposoby kontrolowania szybkości reakcji oraz wydajności tworzenia produktów. Podstawą ilościowych rozważań dotyczących reakcji chemicznych są wymienione poniżej elementarne pojęcia i prawa:
Masa atomowa i cząsteczkowa.
Materia ma budowę ziarnistą, nieciągłą, gdyż dowolnie mała przestrzeń pomyślana w jej wnętrzu nie jest nią całkowicie wypełniona.
Atom jest najmniejszą jednostką budowy pierwiastka chemicznego, ale już - bez naruszenia zasadniczych właściwości pierwiastka - niepodzielną.
Elektron
Cząstka która posiada ujemny ładunek elementarny o wartości
-1.602 x 10-19(C).
Dla wygody przyjęto, że elektron ma ładunek -1.
5.486 x 10-4 u
Proton
Cząstka o ładunku dodatnim +1 (odpowiednio, +1.602 x 10-19 C)
1.0087 u
Neutron
Cząstka elektrycznie obojętna.
1.0073 u
Jednostka masy atomowej u = 1.66054 x 10-24 grama.
Masy protonu i neutronu są prawie identyczne
W jądrze (protony plus neutrony) skupiona jest prawie cała masa atomu
Elektrony które równoważą dodatni ładunek protonów mają masę równą tylko 0.05% całej ich masy.
Przyspieszenie elektronu, skierowane do środka okręgu: a = v2/R
Siła działająca między elektronem i jądrem: F = e2/R2 e2/R2 = mv2/R2
mv2 = e2/R
Całkowita energia elektronu na orbicie (energia kinetyczna plus energia potencjalna) :
E = T + V = mv2/2 - e2/R /4/
który po zastosowaniu równania mv2 = e2/R przyjmuje postać:
E = -e2 / 2R Tylko pewne z możliwych orbit mogą być dozwolone, te orbity, dla których jest spełniony pewien kwantowy warunek związany z warunkiem Einsteina i Plancka.
Zarówno Planck jak i Einstein założyli, że światło o określonej częstotliwości nie jest emitowane ani absorbowane przez materię w dowolnie małych ilościach, lecz tylko w postaci kwantów energii
E = h * n.
gdzie: h - stała Plancka, n - częstotliwość.
Moment pędu elektronu skwantowany:
L = m*v*R = n*h/2*P, gdzie: n = 1, 2, 3, ...... /6/
Emisja promieniowania elektromagnetycznego:
E' - E'' = hν /7/
Dozwolone promienie:
Rn = h2n2/4P2me2 /8/
gdzie: m -masa elektronu, e - ładunek elektronu, n = 1, 2, 3,....
Promień Bohra:
R1 = ao = 5,3 * 10-9 cm
Energia orbit Bohra:
En = - 2P2me4 / h2n2, n = 1, 2, 3,...
Funkcja falowa
Dla każdej cząstki, czy to dla fotonu, czy elektronu, istnieje stowarzyszone z nią pole fal materii, którego amplituda opisana jest funkcją
Y(x, y, z, t), zwaną funkcją falową.
Częstość(n) i długość fali(l) związanej z falą materii wyznacza się odpowiednio z zależności:
n = E/h oraz l = h/p.
Natężenie fali jest proporcjonalne do kwadratu amplitudy. Stąd natężenie pola materii związanego z cząstką jest proporcjonalne do kwadratu amplitudy tego pola Y(x, y, z, t).
|Y(x, y, z, t)|2 = P
Równanie Schrodingera
Funkcję falową układu z jego energią całkowitą wiąże we wzajemnej zależności podstawowe równanie mechaniki falowej, zwane równaniem Schrodingera. Dla układów stacjonarnych, którymi są atomy z odpowiednio rozmieszczonymi wokół jądra elektronami, równanie Schrodingera zapisujemy w postaci.
HY = EY
gdzie: H - operator Hamiltona, Y - funkcja falowa, E - całkowita energia
Odnosząc funkcję falową do opisu elektronów w atomie można wykreślić rozkład prawdopodobieństwa znalezienia elektronu .
(|Y(x, y, z, t)|2 ) w funkcji odległości od jądra atomowego
Znaczenie fizyczne mają wyłącznie funkcje Y zależne od parametrów zwanych liczbami kwantowymi
Liczby kwantowe:
Główna liczba kwantowa
Główną liczbę kwantową oznacza się za pomocą litery n; może ona przyjmować wartości całkowitych liczb dodatnich
1, 2, 3, ...................
Określa więc powłokę elektronową do której należy elektron. Oprócz oznaczeń liczbowych często powłoki elektronowe oznacza się również za pomocą kolejnych dużych liter wziętych z badań widm emisyjnych lub absorbcyjnych promieniowania rentgenowskiego.
Główna liczba kwantowa n określa energię powłoki elektronowej;
Wartość n |
1 |
2 |
3 |
4 |
5 |
6 |
Symbol literowy |
K |
L |
M |
N |
O |
P |
Poboczna liczba kwantowa
Poboczną liczbę kwantową oznacza się literą l i może przyjmować n wartości:
0, 1, 2, .......do / n-1 /
Charakteryzuje ona podpowłokę elektronową, do której należy elektron. W przypadku atomów zawierających więcej niż jeden elektron, trzeba znać równocześnie liczby n oraz l by określić poziom energetyczny odpowiadający orbicie elektronowej. Z wartości l można określić małą oś elipsy i kształt orbity.
Przykład obliczenia wartości liczby pobocznej l
Dla pierwszej powłoki gdzie n = 1 liczba poboczna l przyjmie wartość
l = n - 1 = 1 -1 = 0
Dla drugiej powłoki gdzie n = 2 liczba poboczna l będzie miała wartości
l = 0 oraz l = n - 1 = 2 - 1 = 1
Dla trzeciej powłoki gdzie n = 3 wartości liczby pobocznej wyniosą
l = 0, 1, 2
Poboczna liczba kwantowa l uściśla wartość energii elektronu oraz charakteryzuje kształt orbitali atomowych.
Oprócz wartości liczbowych, liczby poboczne l oznacza się małymi literami : s, p, d, f, g , itd.
Poboczna liczba kwantowa l |
0 |
1 |
2 |
3 |
4 |
Symbol podpowłoki |
s |
p |
d |
f |
g |
Magnetyczna liczba kwantowa
Magnetyczna liczba kwantowa m określa niewielkie różnice energetyczne pomiędzy elektronami o tej samej liczbie kwantowej n i l oraz wzajemne ustawienie się orbitali w przestrzeni pod wpływem zewnętrznego pola magnetycznego. Przy braku zewnętrznego pola magnetycznego orbitale nie mają określonego kierunku w przestrzeni i nie różnią się energią, są zatem zdegenerowane.
Degeneracja oznacza istnienie dwóch lub wiecej różnych stanów o tej samej energii. Stany p są trzykrotne, stany d - pięciokrotne, a stany f - siedmiokrotnie zdegenerowane. Liczba m może przyjmować (2l + 1) wartości.
m = - l, -(l - 1), ......-1, 0, +1, .......,+(l -1) +l
Dla l = 2 liczba magnetyczna m przyjmie wartości
-2, - (2 -1), 0, +(2 -1) , +2
m = -2, -1, 0, +1, +2
Spinowa liczba kwantowa
Liczba ta może przyjmować tylko dwie wartości: + 1/2 albo - 1/2. oznacza się ją literą s. Charakteryzuje ona najmniejsze różnice w stanach energetycznych elektronu związane z kierunkiem obrotu elektronu dookoła własnej osi /tzw. spin elektronu/.
Kształt orbitali
WYKŁAD II
Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas, gdy ich spiny są przeciwne tj. zorientowane w przeciwnych kierunkach.
Reguła Hunda
Elektrony obsadzają orbitale w taki sposób, aby liczba niesparowanych elektronów w danej podpowłoce była możliwie największa
Okresowość cech chemicznych i fizycznych pierwiastków
Jeżeli będziemy umieszczać obok siebie pierwiastki chemiczne szeregując je według rosnących liczb atomowych, to dostrzeżemy, że co 8-my, co 18-ty lub co 32-gi pierwiastek wykazuje podobne cechy chemiczne. Okresowość zmian charakteru chemicznego pierwiastków była myślą przewodnią w skonstruowaniu przez D.J Mendelejewa tablicy zwanym układem okresowym pierwiastków
Periodyczność cech fizykochemicznych pierwiastków wynika z powtarzającego się podobieństwa rozkładu elektronów na zewnętrznych powłokach.
- grupa I - litowce
- grupa II - berylowce
- grupa III - borowce
- grupa IV - węglowce
- grupa V - azotanowce
- grupa VI - tlenowce
- grupa VII - fluorowce
- grupa VIII - helowce
- grupa I - miedziowce
- grupa II - cynkowce
- grupa III - skandowce
- grupa IV - tytanowce
- grupa V - wanadowce
- grupa VI - chromowce
- grupa VII - manganowce
- grupa VII - żelazowce: ta rodzina składa się z trzech triad tj.
- pierwsza triada: żelazowce Fe, Co, Ni
- druga triada: platynowce lekkie Ru, Rh, Pd
- trzecia triada: platynowce ciężkie Os, Ir, Pt
Pierwiastki zapełniające podpowłoki 4f i 5f tworzą odpowiednio dwie rodziny poddodatkowe
- lantanowce
- aktynowce
Rozmiary atomów i jonów
W obrębie okresu promienie atomów zmniejszają się malejąc w danym okresie od strony lewej do prawej. Wiąże się to ze wzrostem liczby protonów w jądrze, tzn.silniejszym przyciąganiem elektronów przez jądro. Tak więc w poszczególnych okresach litowce mają największe promienie atomów, a fluorowce najmniejsze.
W obrębie grup promienie atomów wzrastają wraz ze wzrostem liczb atomowych. Wiąże się to ze wzrostem liczby powłok elektronowych, których wpływ na wielkość średnicy atomu przewyższa wpływ wzrostu ładunku jądra, decydującego o zmniejszeniu średnicy atomu.
Objętość jonów ujemnych jest większa od objętości atomów, natomiast objętość dodatnich jonów izoelektronowych jest znacznie mniejsza od objętości macierzystego atomu.
Jeżeli ilość doprowadzonej energii jest dostateczna do oderwania elektronu od atomu, tzn. ze sfery przyciągania oddziaływania jądra, to atom przekształca się w jon dodatni.
pierwszym potencjałem jonizacyjnym nazywamy energię potrzebną do przemiany
M → M+
drugim - do przemiany M+ → M2+
trzecim - do przemiany M2+ → M3+.
Elektroujemność i elektrododatność
Pierwiastki, których atomy w reakcjach chemicznych przyłączają elektrony, przyjmując w związkach ujemne stopnie utlenienia lub tworzą jony ujemne nazywamy elektroujemnymi.
Pierwiastki, których atomy w reakcjach chemicznych "tracą" elektrony lub tworzą jony dodatnie, nazywamy elektrododatnimi.
Procentowy udział wiązania jonowego w zależności od różnicy elektroujemności
Różnica elektroujemności |
% udział wiązania jonowego |
Różnica elektroujemności |
% udział wiązania jonowego |
0,2 |
1 |
1,8 |
55 |
Wiązanie chemiczne
Teoria elektronowa
Aby utworzona cząstka była trwała, musi być uboższa energetycznie niż wchodzące w jej skład oddzielne atomy. Trwałość energetyczną osiągają cząsteczki przez utworzenie odpowiednich wiązań między łączącymi się atomami. Wiązania w cząsteczce powstają w wyniku "uwspólnienia" elektronów walencyjnych reagujących z sobą atomów.
energia dysocjacji (energia wiązania)
odległość pomiędzy atomami (długość wiązania)
kąt pomiędzy kierunkami wiązań (kąt walencyjny).
Wiązanie jonowe (elektronowalencyjne)
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością.
W czasie powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje, a atom pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony o różnoimiennych ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych.
Związki zawierające wiązania jonowe składają się z dodatnich i ujemnych jonów rozmieszczonych na przemian w przestrzeni.
Siły oddziaływania elektrostatycznego pomiędzy jonami są równomiernie rozłożone we wszyWiązanie atomowe (kowalencyjne)
Wiążące się atomy dążą do osiągnięcia struktury oktetowej najbliższego gazu szlachetnego, poprzez wytworzenie wspólnej pary elektronowej.
Wiązania atomowe (kowalencyjne) powstają również, gdy łączą się z sobą atomy pierwiastków elektroujemnych o takich samych wartościach elektroujemności.
stkich kierunkach uprzywilejowanych, np. wyróżnienie kierunków wartościowości.
Jeżeli utworzenie jednej wiążącej pary elektronowej nie wystarcza do utworzenia oktetu,
atom może wykorzystać dwa lub trzy elektrony tworząc wiązania podwójne lub potrójne.
Wiązanie atomowe (kowalencyjne) spolaryzowane
Wiązanie atomowe spolaryzowane jest wiązaniem pośrednim między jonowym a atomowym; powstaje wówczas, gdy łączą się ze sobą atomy pierwiastków różniących się elektroujemnością, lecz nie tak znacznie jak w przypadku tworzenia wiązania jonowego.
Cechą charakterystyczną tego wiązania jest przesunięcie pary elektronowej wiążącej atomy w kierunku atomu pierwiastk bardziej elektroujemnego.
Cząsteczki z wiązaniami kowalencyjnymi spolaryzowanymi z powodu nierównomiernego, niesymetrycznego w stosunku do środka cząsteczki, rozmieszczenie ładunków wykazują biegunowość.
Cząsteczki o budowie polarnej nazywamy dipolami, tzn.cząsteczkami dwubiegunowymi.
Cząsteczki dwubiegunowe mają tzw. moment dipolowy μ
μ = q * l
Wiązanie donorowo-akceptorowe (koordynacyjne)
Wiązanie donorowo-akceptorowe tym różni się od wiązania atomowego lub atomowego spolaryzowanego, że para elektronowa tworzących wiązanie oddawana jest przez jeden z dwóch łączących się atomów.
Wiązania van der Waalsa (międzycząsteczkowe)
Siły van der Waalsa są wynikiem wzajemnego oddziaływania elektronów i jąder w cząsteczkach.
W wyniku ruchu elektronów walencyjnych gęstość ładunku ujemnego na zewnętrznej powłoce atomów ulega szybkim fluktuacjom wzbudzając podobną fluktuację w powłoce walencyjnej sąsiednich atomów. Powstają szybkozmienne dipole, które wzajemnie przyciągają się zwiększając, w miarę
zbliżania się, wzajemną polaryzację elektronową.
Siły van der Waalsa są stosunkowo słabe w przypadku małych cząsteczek (kilkanaście razy słabsze od sił wiązania atomów w cząsteczce), ale w przypadku dużych cząsteczek mogą nawet przewyższać siły wiązania chemicznego np. w smarach albo w tworzywach sztucznych.
Wiązanie wodorowe.
Wiązanie wodorowe tworzy się pomiędzy atomem wodoru związanym z atomem o dużej elektroujemności, a atomem z wolnymi parami elektronowymi.
Teoria orbitali molekularnych (metoda MO)
Teoria ta zakłada, że podczas powstawania wiązania chemicznego chmury elektronowe orbitali (zawierających niesparowany elektron) każdego z wiążących się atomów przenikają się lub nakładają nawzajem i powstają w ten sposób tzw. orbitale molekularne. Przy kombinacji dwu orbitali atomowych tworzą się dwa energetycznie różne orbitale cząsteczkowe, jeden (nisko energetyczny) wiążący i jeden (wysoko energetyczny) antywiążący.
Im bardziej dwa orbitale atomowe różnią się początkową energią, tym słabiej oddziaływują ze sobą i tym mniejsze są potencjalne energie wiązań.
W przypadku gdy różnica energii orbitali atomowych wolnych atomów jest bardzo duża, stopień nakładania sie orbitali jest niewielki. Wskutek tego powstające orbitale molekularne tylko nieznacznie różnią się energią i kształtem od pierwotnych orbitali atomowych.
WYKŁAD III
Ilość hybrydyzowanych orbitali która powstaje w wyniku hybrydyzacji jest równa liczbie orbitali początkowych biorących udział w hybrydyzacji.
NAJWAŻNIESZE RODZAJE HYBRYDYZACJI ORBITALI:
Liczba zewn. Ukształtowanie Rodzaj hybrydyzacji.
Orbitali przestrzenne
2 liniowe sp
3 trygonalne płaskie sp2
4 tetraedryczne sp3
4 kwadratowo płaskie sp2d
5 bipiramidalne sp3d
6 oktaedryczne sp3d2
7 piramidalne sp3d
7 tetraedryczne sd3
STAN STAŁY charakteryzuje się utrzymaniem kształtu, postaci i objętości próbki niezależnie od kształtu naczynia.
STAN CIEKŁY odznacza się tym że próbka zachowuje swoja określoną objętość podczas przelewania z jednego zbiornika do drugiego, ale przejmuje kształt dna mieszczącego ją naczynia.
STAN GAZOWY charakteryzuje się tym, że próbka nie ma ani kształtu ani objętości i może rozprzestrzeniać się po całej objętości naczynia, w której jest zawarta.
STAN GAZOWY
Różne gazy zachowują się podobnie, a stan fizyczny każdego gazu określają następujące parametry:
ilość w molach(n) lub masa (m) oraz masa molowa(M) przy czym n=m/M
objętość-V (cm3,dm3, l )
ciśnienie p (Pa)
temperatura (K C)
GAZY DOSKONAŁE
cząsteczki gazu są tak małe że można je uważać za punkty materialne
pomiędzy cząsteczkami gazu nie występują siły wzajemnego przyciągania ani odpychania
cząst. gazu poruszają się stale i bezładnie po torach prostoliniowych, zdeżając się ze sobą i ściankami naczynia w którym się znajdują
zderzenia cząst. gazu są doskonale sprężyste
średnia en. kinetyczna cząst. jest proporcjonalna do temp. gazu w skali Kalvina.
Prawo izotermy(prawo Boyl'a-Marriotta)
Prawo izobary( prawo Gay-Luccasa)
Prawo izochory (prawo Charlesa)
ROWNANIE GAZU STANU DOSKONAŁEGO:
p * v = n * R * T
GAZY RZECZYWISTE
Cząsteczki nie mogą swobodnie poruszać się w całej objętości V. Wynikiem tego jest zmniejszenie swobodnej objętości V.
Istnienie sił przyciągania między cząsteczkami. Siły takie istnieją w przypadku bardzo małych odległości między atomami cząsteczkami( siły Van der Walsa). W wyniku tych sił następuje zmniejszenie się ciśnienia wywieranego przez zbiór cząst. gazu.
(p + a/V2 ) (V - b) = R * T
a/V2 ciśnienie wewnętrzne gazu
b strefa działania cząsteczek.
CIECZE: napięcie powierzchniowe:
r = W/S (J/m2)
Miarą napięcia powierzchniowego cieczy jest stosunek wartości tej pracy do przyrostu powierzchni cieczy.
Wyrażając pracę w dżulach a zmianę powierzchni w m2 otrzymujemy jako jednostkę napięcia powierzchniowego:
J/m2 = N * m/m2 = N/m
Lepkość
F = nS(dv/dx)
CIAŁA STAŁE:
Ciała bezpostaciowe (np. szkło, stopiona i ochłodzona krzemionka, żywice polimetakrylowe) to substancje, których atomy, cząsteczki lub jony nie są rozmieszczone w prawidłowej sieci przestrzennej. Substancje te, określone często jako ciecze przechłodzone o dużej lepkości, wykazują niektóre cechy charakterystyczne dla ciał stałych, jak twardość i zdolność zachowania nie zmienionego kształtu. najłatwiej dostrzegalną włąściwością fizyczną odróżniającą ciałą bezpostaciowe od krystalicznego jest brak określonej temperatury topnienie. Ciała bezpostaciowe ogrzewane stopniowo miękną i rozpływają się.
Ciała bezpostaciowe są izotropowe. Oznacza to, że wykazują one we wszystkich kierunkach identyczne właściwości fizyczne, ich twardość, wytrzymałość mechaniczną, rozszerzalność cieplną, przewodnictwo elektryczne, właściwości optyczne - nie zależą od kierunku działania.
Ciała krystaliczne - wykazują regularne i periodyczne we wszystkich kierunkach ułożenie atomów cząsteczek lub jonów.Wykazują zależność własności od kierunku (anizotropia). Topią się w ściśle określonych temperaturach.
Sieć przestrzenna jest definiowana jako nieskończenie rozciągający się, regularny, przestrzennie periodyczny układ punktów, które są równoważne w tym sensie, że otoczenie obserwowane z każdego z nich wygląda jednakowo. W każdej sieci daje się wydzielić komórkę elementarną opisaną długością jej krawędzi a, b, c i trzema kątami (a, b, g).
Układy krystalograficzne
regularny - trzy jednakowe osie o długości a, tworzące z sobą kąty proste
tetragonalny - dwie jednakowe krawędzie oraz trzecia krawędź o innej długości, wzajemne prostopadłe
heksagonalny i trygonalny nieromboedryczny - dwie równe krawędzie, pod kątem 120o, i trzecia krawędź o innej długości, prostopadła do dwóch pierwszych
rombowy - trzy krawędzie o niejednakowych długościach, wszystkie wzajemne prostopadłe
jednoskośny - dwie krawędzie a i c pod kątem b względem siebie i trzecia krawędź pod kątem prostym do a i c
trójskośny - trzy krawędzie a, b, c z trzema kątami a, b, g między nimi
trygonalny romboedryczny - trzy krawędzie a, b i c oraz kąty a, b, g są jednakowe
WYKŁAD IV
Układy makroskopowe można zdefiniować bez posługiwania się pojęciem atomu czy cząsteczki
Właściwości makroskopowe układu:
Temperatura, gęstość, ciepło właściwe, skład chemiczny.
Termodynamika dział zajmujący się prawami przemian zachodzących w ukł. makroskopowych.
UKŁADY MAKROSKOPOWE
Niejednorodne Jednorodne
(heterogeniczne) (homogeniczne)
Można podzielić na części różniące We wszystkich częściach wykazują
się właściwościami. te same właściwości.
Np. granit np. wodny roztwór NaCl.
Układ heterogeniczny zawsze da się rozdzielić na części homogeniczne.
FAZA- homogeniczna część układu, dająca się odróżnić pod względem fizycznym, ograniczona określoną powierzchnią.
SKŁADNIK UKŁADU- substancja chemiczna wchodząca w skład układu.
Fazy znajdujące się w układzie wielofazowym mogą mieć ten sam skład( woda i lód w topniejącym śniegu) lub też różny skład ( kwarc i skaleń w granicie).
SUBSTANCJA CZYSTA- stanowi jedyny składnik fazy
Np. faza ciekła zawierająca wodę. Gdy do fazy ciekłej wprowadzimy więcej składników otrzymujemy roztwór.
PRZEMIANY UKŁADÓW MAKROSKOPOWYCH:
PRZEMIANA FAZOWA-związana z zanikiem jednej z faz i powstawaniem na jej miejsce innej fazy( suma mas składników ukł. pozostaje stała).
Np. parowanie cieczy, sublimacja ciała stałego, polimorficzne przemiany…
PRZEMIANA CHEMICZNA- przebiega z udziałem substancji zawartych w jednej fazie (np. hydroliza soli zawartych w roztworze wodnym), bądź w kilku fazach (np. spalanie węgla)
Wspólna cechą przemian fazowych i chemicznych, jest to że towarzyszą im efekty cieplne.
Parowanie wody- pochłanianie ciepła
Krzepnięcie stopionego metalu- wydzielanie ciepła
Termiczny rozkład CaCO3 - proces endotermiczny
Łączenie żelaza z siarką - proces egzotermiczny
Potencjał termodynamiczny - funkcja opisująca stan układu.
Potencjał termodynamiczny układu wielofazowego jest sumą potencjałów wszystkich faz.
Potencjał termodynamiczny fazy - suma potencjałów termodynamicznych wszystkich składników.
G = μ1n1 + μ 2n2 + ............+ μini
μ i - potencjał chemiczny.
μ i = μ i(T)0 + RTln xi
Reguła faz Gibbsa
Liczba niezależnych składników n - najmniejsza liczba składników z których można zbudować cały układ.
Liczbę niezależnych składników można ustalić odejmując od liczby substancji obecnych w układzie, liczbę niezależnych reakcji chemicznych.
Układ zawierający: C ; CO ; CO2 - trzy składniki z których tylko dwa są niezależne gdyż:
C + CO2 = CO
Układ zawierający : C ; CO ; CO2 ; H2 ; H2O
To układ zawierający pięć składników z których
trzy są składnikami niezależnymi.
C + CO2 = 2CO
CO + H2O = CO2 + H2
C + H2O = CO + H2
Liczba stopni swobody s - liczba czynników wyznaczających równowagę (temperatura, ciśnienie, stężenie), które możemy dowolnie zmieniać zachowując niezmienioną liczbę faz.
f + s = n + 2
Dla układu jednoskładnikowego np. woda
f = 1, s = n + 2 - f = 2
f = 2, s = 1
f = 3, s = 0
Układ zawierający H2O i NaCl n = 2
f = 1 (tylko faza ciekła, roztwór NaCl)
s = n + 2 = 2 + 2 - 1 = 3
układ trójzmienny, można zmieniać p, T, c.
f = 2 ( roztwór w równowadze z parą wodną)
s = 2 + 2 -2 = 2
wyznaczając stężenie i temperaturę, określamy
prężność pary nasyconej
f = 3 (roztwór w równowadze z parą i osadem)
s = 2 + 2 - 3 = 1
prężność pary nad roztworem nasyconym określona przez temperaturę
WYKŁAD V
ENERGIA POWIERZCHNIOWA
Potencjał termodynamiczny fazy G:
G = μ1n1 + μ2n2 + ..............+ μini
W przypadku fazy rozdrobnionej należy uwzględnić pracę mechaniczna niezbędną do uzyskania rozwiniętej powierzchni (łupanie kryształu, rozpylanie cieczy).
G = μ1n1 + μ2n2 + .....................+ μini + γS
γ - praca niezbędna do wytworzenia jednostki powierzchni fazy - energia powierzchniowa.
Zmniejszenie energii układu może następować wyłącznie poprzez zmniejszenie członu γS.
Na drodze zmniejszenia powierzchni (tworzenie i łączenie kropli cieczy).
2. Na drodze zmniejszania energii powierzchniowej,
poprzez zmianę składu powierzchni.
Proces zagęszczania substancji na granicy faz:
Adsorpcja.
Adsorpcja fizyczna - siły działające pomiędzy cząsteczkami adsorbentu a cząsteczkami adsorbatu są siłami Van der Waalsa.
Ciepło adsorpcji fizycznej gazu na powierzchni ciała stałego jest zbliżone do energi skroplenia tegoż gazu.
Równowagi procesu ustalają się szybko.
Adsorpcja chemiczna (chemisorpcja) - siły działające mają charakter chemiczny.
Ciepło adsorpcji jest duże, rzędu ciepła reakcji chemicznej. Równowagi ustalają się wolno.
UKŁADY DYSPERSYJNE
Znaczne rozwinięcie powierzchni jednej z faz.
W każdym układzie dyspersyjnym możemy rozróżnić :
fazę rozproszoną oraz fazę rozpraszającą, otaczającą i oddzielającą cząsteczki fazy rozproszonej
Faza rozproszona Faza rozpraszająca
ciecz
ciało stałe gaz
ciało stałe
ciecz (niemieszająca )
ciecz gaz
ciało stałe
ciecz
gaz
ciało stałe
Układy o rozdrobnieniu molekularnym ( < 10 Å) Roztwory rzeczywiste. W tym przypadku nie można mówić o istnieniu fazy rozproszonej i granicy faz
Układy o rozdrobnieniu koloidalnym (10 - 2000 Å)
Granice pomiędzy układami o różnym rozdrobnieniu wybrano arbitralnie.
Układy grubodyspersyjne (> 2000 Å)
Cząsteczki fazy rozproszonej całkowicie izolowane - zol (roztwór koloidalny)
r > 2000 Å
zawiesina (ciało stałe w cieczy)
dym (ciało stałe w gazie)
emulsja (ciecz w cieczy)
mgła (ciecz w gazie)
Cząsteczki fazy rozproszonej tworzą układ sztywny - żel (układ spoisty)
Do właściwości kinetycznych układów koloidalnych należą:
ruchy Browna
dyfuzja
sedymentacja
lepkość
cisnienie osmotyczne
Do układów koloidalnych stosuje się te same prawa fizykochemiczne i podobne metody badawcze jak dla roztworów rzeczywistych.
Ruchy Browna
Ruchy Browna sa charakterystyczne szczególnie dla koloidów fazowych. Zostały zaobserwowane przez angielskiego botanika Browna (1827), który stwierdził za pomoca mikroskopu, że koloidalne cząstki znajdują się w nieustannym chaotycznym ruchu. Wyjaśnienie istoty ruchów Browna podali Einstein i Smoluchowski (1905). Stwierdzili oni, że obserwowane przesunięcia translacyjne cząstek koloidalnych stanowią wypadkową bardzo wielu przesunięć zachodzących w najrozmaitszych kierunkach .
Pod pojęciem dyfuzji rozumie się ruch cząsteczek substancji pod wpływem różnicy stężeń pomiędzy różnymi częściami roztworu
Metody dyspersyjne
Rozdrobnienie aż do uzyskania rozdrobnienia koloidalnego osiąga się albo mechanicznie (np. młyn koloidalny), albo elektrycznie (łuk elektryczny).
Ten ostani spoób szczególnie stosuje się do otrzymania zoli metali, tlenków metali, koloidalnego grafitu itp.
W metodach dyspersyjnych wykorzystuje się również ultradzwięki (drgania akustyczne o częstości rzędu 20000 Hz). Otrzymuje się w ten sposób m.in. zole barwników, krochmalu, gipsu itp.)
Do tej grupy metod można zaliczyć peptyzację. Stosuje się tutaj peptyzatory (substancje o silnych własnościach adsorbcyjnych), które rozdzielają złączone cząstki koloidalne.
Metody kondensacyjne
W metodach tej grupy rozdrobnienie koloidalne osiąga się w wyniku łączenia pojedyńczych cząsteczek chemicznych. Stosuje się w tym celu takie procesy chemiczne jak:
polimeryzacja
zmniejszenie rozpuszczalności (np. otrzymywanie koloidalnego roztworu siarki w wodzie przez wlewanie do wody nasyconego roztworu siarki w alkoholu)
redukcja
utlenianie (np. H2S --> S koloidalna)
wymiana (AgNO3 + KI --> AgI + AgNO3)
Koloidy liofobowe (hydrofobowe)
Koagulacja pod wpływem niewielkiej ilości elektrolitów.
Koloidy liofilowe (hydrofilowe)
Białka, oligosacharydy, barwniki. Koagulacja wymaga dodania znacznej ilości elektrolitów.
Micela składa się z jądra, w skład którego wchodzą obojętne cząsteczki. Na powierzchni jądra absorbowane są z roztworu wspólne jony w przypadku KI jony jodkowe I-. Warstwa ta nosi nazwę warstwy adsorbcyjnej i wiąże się ona luźno z warstwą rozmytą albo dyfuzyjną zawierającą jony K+.
Jadro razem z warstwą adsorpcyjną nosi nazwę granuli.
Na granicy faz jądro cząstki koloidalnej - roztwór, powstaje podwójna warstwa elektryczna.
Żele
Niektóre roztwory koloidalne np. roztwory wodne żelatyny, krochmalu, mydła, kauczuku w bezenie, itp. samorzutnie mogą przejść ze stanu ciekłego w stan zbliżony do ciała stałego. Osiąga sie go często przez obniżenie temperatury.
Ten stan układu koloidalnego od typowego przykładu - żelatyny - nosi nazwę żelu. Żele mogą być organiczne, są bardziej elastyczne i nieorganiczne, mniej elastyczne np. wodorotlenek żelaza, silikażel.
Elastyczny żel na skutek własności adsorpcyjnych może pochłaniać ośrodek dyspersyjny w wyniku czego zwiększa się objętość. Proces ten nosi nazwę pęcznienia żelu.
Żele charaktertyzują się różnymi zdolnościami do pęcznienia. Niektóre żele pęcznieją w sposób nieograniczony i mogą przechodzić w zol. Niektóre żele po pewnym czasie mogą wydzielić część ośrodka rozpraszającego w postaci osobnej fazy. Zjawisko to nosi nazwę synerazy (np. wydzielanie się serwatki z kwaśnego mleka).
WYKŁAD VI
Teoria Bronsteda.
Kwasami w/g Bronsteda nazywamy związki chemiczne lub jony zdolne do oddawania protonów, a zasadami związki chemiczne lub jony zdolne do przyłączania protonów.
Cząsteczka lub jon kwasu po oddaniu protonu staje się cząsteczką lub jonem zasady i odwrotnie - cząsteczka zasady po przyłączeniu protonu staje się cząsteczką lub jonem kwasu.
A B + H+
Zasada B sprzężona z kwasem A
A1 + B2 A2 + B1
Według protonowej teorii kwasów i zasad, kwas może wykazywać swoje własności kwasowe tylko wobec zasady, która przyjmuje proton i odwrotnie zasada może nią być tylko w obecności kwasu, który proton oddaje.
Według teorii Bronsteda rozpuszczalnik jest nie tylko ośrodkiem, w którym odbywa się dysocjacja kwasów lecz odgrywa on przede wszystkim role kwasu wobec rozpuszczonej zasady lub zasady wobec rozpuszczonego kwasu.
Teoria Lewisa.
Kwasem nazywamy związek lub jon, który przyjmując parę elektronową tworzy wiązanie kowalencyjne spolaryzowane, a zasadą związek lub jon, który dostarcza pary elektronowej do utworzenia tego wiązania.
Zgodnie z elektronową teorią kwasów i zasad kation wodorowy (proton) jest kwasem, a amoniak zasadą, ponieważ wolna para elektronowa atomu azotu przyjmowana jest przez kation wodorowy:
H+ + NH3 <=> NH4+
Woda może być kwasem i zasadą
(kwas)H+ + (zasada)HOH <=> H3O+
(kwas)HOH + (zasada)NH3 <=> NH4+ + OH-
Aktywność elektrolitów.
W przypadku elektrolitów mocnych ( a także o średniej
mocy) w roztworach o stężeniu większym od 0.001 m
obserwuje się odstępstwa od prawa działania mas.
Wprowadza się pojęcie aktywności jonu:
ai = fi ci
Dla roztworu silnie rozcieńczonego
ai ≈ ci
Odstępstwa wynikają z oddziaływań elektrostatycznych pomiędzy jonami w roztworze.
Dla równowagi:
AB A+ + B-
Roztwory buforowe
Są to roztwory, których wartość pH po dodaniu mocnych kwasów albo zasad, jak i po rozcieńczeniu wodą zmienia się nieznacznie. Roztworami buforowymi są najczęściej wodne roztwory słabych kwasów albo zasad i ich odpowiednich soli o zbliżonych stężeniach.
Rolę mieszanin buforowych spełniają również roztwory wodorosoli np. NaH2PO4 i Na2HPO4.
Według teorii Bronsteda i Lowry'ego buforami są zatem roztwory słabych kwasów i sprzężonych z nimi zasad (np. CH3COOH i CH3COO-, HCOOH i HCOO-, HCO3- i CO22-, H2PO4- i HPO42- lub HPO42- i PO43-) albo roztwory słabych zasad i sprzężonych z nimi kwasów (np. NH3 i NH4+).
Cechą charakterystyczną roztworów buforowych jest:
praktycznie stałe stężenie jonów wodorowych podczas rozcieńczania roztworu
niewielka zmiana stężenia jonów wodorowych po dodaniu do roztworu niewielkich ilości mocnego kwasu lub mocnej zasady - mniejszych niż stężenie składników buforu (kwasowość roztworu buforowego nie powinna zmienić się więcej niż o jednostkę pH).
Pojemność buforowa
Działanie buforujące roztworu buforowego jest ograniczone, a skuteczność tego działania zależy od stężenia substancji składowych. Miarą zdolności roztworu buforowego do przeciwdziałania wpływom zmieniającym jego pH jest zdolność buforowa, wyrażona zwykle liczbą moli mocnego kwasu lub zasady, która wprowadzona do 1 dm3 roztworu buforowego zmienia jego pH o jedność.
Pojemność buforowa jest wprost proporcjonalna do stężenia roztworu buforowego. Optymalne działanie buforujące wykazuje bufor, w którym stężenie kwasu (zasady) jest w przybliżeniu równe stężeniu soli. W takich warunkach bufory są najmniej wrażliwe na dodatek mocnego kwasu lub zasady.
pH = pKHA - lg(Ckw / Csoli)
pH = pKw - pKBOH + lg(Czasady / Csoli)
Rozpuszczalniki protonowe ( np. NH3 )
Rozpuszczalniki aprotonowe ( np. SO2 )
Rozpuszczalnik protonowy
kwasowy zasadowy amfiprotyczny
bezw. ciekły woda
CH3COOH NH3 alkohole
Rozpuszczalniki protonowe ulegają autodysocjacji:
2 H2O H3O+ + OH-
2 NH3 NH4+ + NH2-
3HF H2F+ + HF2-
2HCN H2CN- + CN-
Kwasy i zasady ulegają dysocjacji w roztworach protonowych w analogiczny sposób jak w wodzie:
CH3COOH + NH3 <=> CH3COO- + NH4+
Rozpuszczalniki aprotonowe
Ulegają w pewnym stopniu autodysocjacji:
2 BrF3 BrF2+ + BrF4-
2SO2 SO2+ + SO32-
N2O4 NO+ + NO3-
Rozpuszczanie zasady: AgF + BrF3 Ag+ + BrF4-
Rozpuszczanie kwasu: SbF5 + BrF3 BrF2+ + SbF6-
Reakcje utlenienia-redukcji.
Reakcją utlenienia-redukcji nazywamy proces, w którym następuje wymiana elektronów między substancją utleniającą a substancją redukującą, na skutek czego atomy pierwiastków biorących udział w reakcji zmieniają swój stopień utlenienia.
Utlenienie polega na oddawaniu elektronów przez atomy lub grupy atomów (proces deelektronizacji).
Odebranie elektronów możliwe jest tylko wówczas, gdy w układzie oprócz atomów, cząsteczek lub jonów oddających elektrony obecne są także atomy, cząsteczki lub jony zdolne do równoczesnego pobrania elektronów; toteż proces utlenienia przebiega zawsze równolegle z procesem redukcji i odwrotnie, redukcji towarzyszy utlenienie.
Procesy utleniania-redukcji nazywane są często procesami redoksowymi lub krótko - procesami redox.
Stopień utlenienia
W reakcji utleniania-redukcji przyjęte jest posługiwanie się pojęciem stopnia utlenienia albo liczby utlenienia.
Stopniem utlenienia pierwiastka wchodzącego w skład określonej substancji nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych jakie przypisalibyśmy atomom tego pierwiastka gdyby cząsteczki tej substancji miały budowę jonową.
Obliczanie stopnia utlenienia odbywa się według następujących reguł:
suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero, natomiast wchodzących w skład jonu równa się wartościowości jonu.
pierwiastkom w stanie wolnym przypisuje się stopień utlenienia O.
fluor we wszystkich swych połączeniach występuje w stopniu utlenienia -1.
tlen w swych połączeniach występuje w stopniu utlenienia -2. Wyjątek stanowią nadtlenki, np. BaO2, dla których przyjmuje się stopień utlenienia -1 oraz OF2, w którym tlen przyjmuje stopień utlenienia +2.
wodór przyjmuje w swych związkach stopien utlenienia +1. Wyjatek stanowią wodorki litowców i berylowców (np.LiH, CaH2), w których jego stopien utlenienia równy jest -1 oraz B2H6, AlH3, SiH4.
stopień utlenienia litowców wynosi +1 a berylowców +2.
WYKŁAD VII
Potencjał elektrochemiczny
Charakterystyczną właściwością chemiczną metali jest ich zdolność do oddawania elektronów w reakcjach chemicznych i tworzenia dodatnio naładowanych jonów.
Im łatwiej atomy metali przechodzą w stan jonowy tym energiczniej wchodzą w reakcję z innymi pierwiastkami a więc tym większa jest ich reaktywność chemiczna.
Metale bardziej reaktywne są w stanie wypierać ze związków chemicznych metale mniej reaktywne. Szczególnie jest to widoczne w roztworach.
Cu2+ + Zn0 --> Zn2+ + Cu0
Pod wpływem przyciągania wywołanego przez dipolowe cząsteczki wody, metal zależnie od reaktywności chemicznej, mniej lub bardziej intensywniej przechodzi w stan jonowy, tzn. wysyła do roztworu swoje jony. Na skutek tego metal ładuje się ujemnie.
Obecne w roztworze jony dodatnie metalu (kationy) są solwatowane (otoczone cząsteczkami rozpuszczalnika) wykazują dążność do gromadzenia się w pobliżu ujemnie naładowanej powierzchni metalu, zatem w pobliżu tej powierzchni tworzy się warstwa ładunku dodatniego. Część jonów ulega na powierzchni metalu rozładowaniu i przejściu w stan metaliczny.
Po pewnym czasie ustali się tzw. równowaga dynamiczna między fazami, polegająca na wyrównaniu szybkości przechodzenia jonów metalu do roztworu, a szybkością osadzania się jonów z roztworu na metalu. Przebieg równowagi można opisać równaniem.
Meo + nH2O <=> Mez+*nH2O + ze
Meo <=> Mez+ + ze
Meo <=> Mez+ + ze
Taki układ, gdzie metal (przewodnik I rodzaju) zanurzony jest w roztworze elektrolitu (przewodnik II rodzaju) nosi nazwę elektrody (półogniwa) metalicznego.
Ogniwo galwaniczne (elektrochemiczne)
Zn(s) --> Zn2+ + 2e Cu2+ + 2e --> Cu(s)
SEM ogniwa definiuje się jako różnicę potencjałów elektrody o wyższej wartości potencjału EMeI i elektrody o niższej wartości potencjału (EMeII) dla ogniwa otwartego, czyli takiego, w którym obwód elektryczny nie jest zamknięty, a opór miedzy biegunami ogniwa jest nieskończenie wielki.
SEM = EMe(I) - EMe(II) = E
Potencjał elektrody metalicznej
EMe = EoMe + RT/nF * lnaMez+
Dla roztworów rozcieńczonych aktywność jest równa stężeniu aMez+ = CMez+ wtedy możemy stosować wzór przybliżony;
EMe = EoMe + RT/nF * lnCMez+
Standardowa elektroda wodorowa
½ H2 + H2O H3O+ + e
EH = E0H + RT/F ln [H3O+]
Szereg napięciowy metali
Elektrody oksydacyjno-redukcyjne
Elektrody oksydacyjno-redukcyjne lub elektrody redoksowe, zawierają obojętny chemicznie metal (platyna lub złoto) zanurzony w roztworze substancji obecnej zarówno w formie utlenionej, jak i zredukowanej (oks) do zredukowanej (red) zgodnie z równaniem.
oks + ne <=> red
Potencjał elektrody platynowej w układzie oksydacyjno-redukcyjnym obliczamy z równania
E = Eo + RT/nF * ln(aoks / ared)
gdzie: aoks - aktywność formy utlenionej, ared - aktywność formy zredukowanej, Eo - normalny potencjał oksydacyjno-redukcyjny.
Pt | Roztwór | Roztwór | Roztwór
Fe2+, Fe3+ KCl MnO4 -, Mn2+,H3O+
5 Fe2+ 5Fe3+ +5e
MnO4 - + 8H3O+ + 5e Mn2+ + 12 H2O
MnO4 - + 8H3O+ + 5Fe2+ Mn2+ + 12H2O + 5Fe3+
Elektrody drugiego rodzaju
Elektrody drugiego rodzaju składają się z metalu, jego trudno rozpuszczalnej soli oraz elektrolitu zawierającego aniony wchodzące w skład trudno rozpuszczalnej soli.
Przykładem elektrody drugiego rodzaju jest elektroda kalomelowa.
Budowę elektrody kalomelowej można przedstawić następującym schematem.
Hg, Hg2Cl2(st) // KCl
a procesy na niej zachodzące wyraża równanie
2Hg + 2Cl- <=> Hg2Cl2 + 2e
O potencjale elektrody kalomelowej decyduje stężenie jonów chlorkowych, wobec których jest odwracalna. Stężenie jonów chlorkowych w roztworze KCl, którym elektroda jest wypełniona, wpływa na stężenie jonów rtęciowych z uwagi na to, że iloczyn rozpuszczalności kalomelu
LHg2Cl2(st) = CHg2+ * C2Cl-
Eszkl = A +
gdzie: A jest parametrem zależnym od budowy elektrody i może zmieniać się w czasie,
R - stała gazowa, T - temperatura w skali bezwzględnej, F - stała Faraday'a
Do pomiarów pH wykorzystuje się elektrodę zespoloną stanowiącą w sobie gotowe ogniwo pomiarowe złożone z elektrody szklanej i kalomelowej. Siła elektromotoryczna takiego ogniwa jest równa różnicy potencjałów obu elektrod kalomelowej i szklanej:
E = Ekal - Eszkl = Ekal - A -
= Ekal - A + 0,059 pH
w temperaturze 25oC iloraz 2,3
= 0,059, jeśli przyjmiemy ponadto, że:
b = Ekal - A, to
E = b + 0,059 pH
Zgodnie z podaną zależnością, siła elektromotoryczna E danego ogniwa jest liniową funkcją pH.
WYKŁAD VIII
Grupa I a - litowce Właściwości fizyczne litowców
Atomy wszystkich wymienionych pierwiastków mają w zewnętrznej powłoce elektronowej jeden elektron walencyjny zajmujący w stanie podstawowym orbitalu ns1 (dla litu n=2, dla sodu n=3, ...... dla fransu n=7);
elektron ten łatwo jest oddawany przez pierwiastki a atomy przechodzą w jony jednododatnie.
Z niewysokich potencjałów jonizacyjnych litowców (520kJ dla litu, 375 dla Cs) wynika iż metale te są najsilniejszymi reduktorami.
Dzięki temu pod działaniem promieniowania elektromagnetycznego w zakresie widzialnym (zastosowanie Cs w komórkach fotoelektrycznych), jak również w temperaturze palnika gazowego następuje wzbudzenie elektronów na wyższe poziomy energetyczne. Dlatego pierwiastki te dają charakterystyczne zabarwienie palnika:
Li-karminowe, Na-żółte, K- fioletowe, Rb- fioletowo -czerwone, Cs-niebieskie. Zjawisko to wykorzystuje się do jakościowego wykrywania litowców.
Wszystkie litowce są metalami.
Litowce, jak również ich tlenki, łatwo reagują z wodą tworząc mocne zasady.
Ze względu na dużą reaktywność chemiczną pierwiastki tej grupy nie występują w przyrodzie w stanie wolnym lecz wyłącznie w postaci związków najczęściej jako chlorki, siarczany, węglany, rzadziej azotany i fosforany.
Podczas spalania litowców w powietrzu lub tlenie tylko lit tworzy zwykły tlenek Li2O, pozostałe tworzą nadtlenki Na2O2, K2O2, a potas i cez także ponadtlenki KO2, RbO2, CsO2.
Nadtlenki i ponadtlenki, łatwo reagują z wodą: w reakcji powstaje odpowiednia zasada i tlen
2Na2O2 + 2H2O --> 4NaOH + O2
4KO2 + 2H2O --> 4KOH + 3O2
Litowce reagują bezpośrednio z fosforem, arsenem i antymonem, tworząc związki typu M3X.
W podwyższonych temperaturach łączą się bezpośrednio z wodorem tworząc wodorki MH; reagują również z chlorowcami z utworzeniem halogenków.
Lit podczas ogrzewania łączy się także bezpośrednio z azotem, tworząc azotek litu Li3N, który ogrzany w strumieniu wodoru redukuje się do wodorku litu LiH.
Azotków - sodowego Na3N i potasowego K3N - nie można otrzymać przez bezpośrednią syntezę metalu z azotem cząsteczkowym. Otrzymuje się je przez ogrzewanie mieszaniny azydku metalu i roztworu metalu w ciekłym amoniaku.
W reakcji wody z azotkiem sodu lub potasu wydziela się amoniak.
Wszystkie litowce wypierają wodór ze związków, które mają charakter kwasów Bronsteda:
2Na + 2H2O --> 2NaOH + H2
2Na + 2CH3OH --> 2CH3ONa + H2
2Na + 2NH3 --> 2NaNH2 + H2
Interesujące właściwości fizyczne i chemiczne wykazują wodorki litowców, mające charakter soli; wodór występuje w nich w postaci ujemnego jonu H-, tzw. jonu wodorkowego.
Pod względem właściwości fizycznych, wodorki podobne są do odpowiednich fluorowców, są jednak od nich bardziej reaktywne. Spośród reakcji wodorków najważniejsze znaczenie dla ich charakterystyki chemicznej mają reakcje z wodą, które przebiegają energicznie z wydzieleniem wodoru.
NaH + H2O --> NaOH + H2
Atomy litowców są dość duże, promienie wynoszą 1,23 Ao - 2,35 Ao, dlatego maja małą gęstość 0,54 - 1,87 g/cm3. Li, Na, K są lżejsze od wody.
Lit i sód, a także i potas polepszają własności mechaniczne jak i antykorozyjne magnezu, glinu i ołowiu, wypełniając między ich atomami luki sieciowe. Lit stosowany jest jako katalizator w reakcji polimeryzacji izoprenu. Stop litu z magnezem i niewielkim dodatkiem srebra o d < 1 g/cm3 wykazuje dobre własności antykorozyjne i wytrzymałościowe. Sód w stanie stopionym stosowany jest jako chłodziwo (reaktory atomowe).
Rubid stosowany jest do produkcji żarówek o świetle zbliżonym do dziennego, a cez do produkcji katod w fotokomórkach.
Najważniejszymi i najbardziej rozpowszechnionymi w przyrodzie pierwiastkami są sód i potas. Ze związków sodu największe znaczenie posiada chlorek sodowy NaCl, węglan sodowy (Na2CO3) zwany sodą kalcynowaną otrzymywany w reakcji.
NaCl + NH3 + H2O + CO2 --> NH4Cl + NaHCO3
2NaHCO3 ---> Na2CO3 + H2O + CO2
Druga reakcja przebiega w temperaturze 160-180 oC.
Wodorotlenek sodowy NaOH otrzymuje się na drodze elektrolizy NaCl i w reakcji
Na2CO3 + Ca(OH)2 --> CaCO3 + 2NaOH
Grupa IIa - berylowce
Do metali drugiej grupy układu okresowego berylowców należą: beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i promieniotwórczy rad (Ra). W stanie podstawowym wykazują konfigurację elektronów walencyjnych ns2, przy czym n=2 dla Be, 3 dla Mg,.....itd. Z powodu mniejszych promieni od litowców, berylowce posiadają nieco większą gęstość, twardość, mniejszą lotność i wyższe potencjały jonizacyjne.
Metale II grupy spotykane są w przyrodzie wyłącznie w związkach w których występują tylko w stopniu utlenienia +2, głównie jako dwudodatnie jony. Rozpuszczalność w wodzie maleje ze wzrostem masy atomowej. Ze wzrostem wielkości atomów maleje wartość potencjału jonizacyjnego oraz zwiększają się własności zasadowe.
Metale II grupy, podobnie jak litowce, otrzymuje się z ich związków, na drodze redukcji katodowej stopionych soli.
Do najpospolitszych pierwiastków II grupy, najczęściej spotykanych w przyrodzie należą wapń i magnez, występujące w postaci następujących związków:
wapieni CaCO3
magnezytów, których głównym składnikiem jest MgCO3
węglanu magnezowo-wapniowego
tzw. dolomitu MgCO3*CaCO3
siarczanu wapniowego CaSO4
fosforanu wapniowego Ca3(PO4)2
chlorku wapniowego CaCl2 i MgCl2.
Berylowce spalone w powietrzu lub w tlenie tworzą odpowiednie tlenki. Tlenki berylowców otrzymuje się również przez rozkład termiczny węglanów, azotanów, szczawianów lub wodorotlenków. Temperatura topnienia tlenków jest stosunkowo wysoka (MgO - 2800oC).
Wapń, stront i bar reagują już z zimną wodą, wydzielając z niej wodór
Ca + 2H2O --> Ca(OH)2 + H2
Beryl i magnez reagują w podobny sposób z wodą wrzącą lub przegrzaną parą wodną.
Beryl różni się zasadniczo od pozostałych pierwiastków II grupy głównie dlatego, że atomy jego maja mniejsze rozmiary, a ponadto jest wśród nich najbardziej elektroujemny.
Stopiony chlorek berylu, w przeciwieństwie do stopionych chlorków pozostałych metali II grupy nie przewodzi prądu elektrycznego. Jest to dowodem, że w związku tym nie występuje wiązanie jonowe jak w pozostałych chlorkach, lecz wiązanie atomowe spolaryzowane.
Beryl wypiera wodę z wodnego roztworu mocnych zasad tworząc berylany
Ba + NaOH + H2O --> NaHBeO2 + H2
Reakcja ta dowodzi, że tlenek berylu ma własności amfoteryczne.
Beryl jest to metal twardy i trudny w obróbce mechanicznej. Stosowany jest jako dodatek do stopów glinu, kobaltu, srebra, platyny, stali, niklu i miedzi. Podwyższa twardość i odporność na korozję oraz niewrażliwość na zmiany temperatury.
Stop beryl-nikiel jest bardziej wytrzymały niż najlepsza stal, a sprężyny praktycznie niezniszczalne (wytrzymują 20 miliardów zmian obciążeń).
Stop beryl-miedź (brąz berylowy) nie iskrzy w czasie pracy pod dużym obciążeniem (zastosowanie: fabryki materiałów wybuchowych, gazownie, kopalnie).
Tlenek berylu BeO o temperaturze topnienia 2585oC wchodzi w skład cermwtów (spieki metaloorganiczne) stosowane do budowy silników odrzutowych, które mogą pracować w temperaturze do 2000oC. Pary berylu wywołują schorzenia płuc i serca.
Magnez Mg jest czystym składnikiem stopów glinu, cynku, manganu, tworzy bardzo lekkie stopy (elektron o ciężarze właściwym 1,85g/cm3.
Berylowce z wyjatkiem berylu, ogrzewane z węglem tworzą węgliki MC2. Najbardziej znanym jest CaC2 (karbid).
CaC2 + 2H2O --> Ca(OH)2 + C2H2
Wapń jest metalem otrzymywanym przez elektrolizę stopionego chlorku wapnia CaCl2. Jest barwy srebrzystobiałej i nieco twardszy od ołowiu. reaguje z wodą i pali się na powietrzu po podpaleniu. Powstaje wtedy mieszanina tlenku wapnia CaO i azotku wapnia Ca3N2.
Wapń reaguje z zimną wodą tworząc wodorotlenek wapnia Ca(OH)2.
Wapń ma wiele praktycznych zastosowań, jako odtleniacz do żelaza, stali, miedzi i stopów miedzi i jako składnik stopów ołowiu (metali łożyskowych i powłok do kabli elektrycznych) i stopów glinu oraz jako środek redukujący do wytwarzania innych metali z ich tlenków.
Najważniejszym związkiem wapnia jest węglan wapnia CaCO3. W przyrodzie występuje jako minerał kalcyt. Mikrokrystaliczną postacią wapnia jest marmur, a skałą złożoną głównie z CaCO3 jest wapniak, czyli kamień wapienny. Znanymi minerałami zawierającymi wapń są poza tym gips CaSO4*2H2O i fosforyty Ca3(PO4)2 fosforan wapnia.
Bardzo ważnym połączeniem dla życia organizmów żywych na ziemi jest chlorofil (patrz rysunek), zielony barwnik roślinny. Jest to związek kompleksowy magnezu z pierścieniami porfirynowymi.
Barwnik ten umożliwia syntezę węglowodanów z dwutlenku węgla i wody według sumarycznego równania
6CO2 + 6H2O --> C6H12O6 + 6O2
Grupa IIIa - glinowce
Do grupy glinowców zalicza się następujące pierwiastki: glin (Al), gal(Ga), ind(In), tal(Tl). Do grupy III należy również bor, który jest niemetalem, a ściślej półmetalem. Pierwiastki III grupy mają trzy elektrony wartościowości, dwa sparowane w orbitalu s i jeden niesparowany w orbitalu p - (s2p).
Jednym z najbardziej rozpowszechnionych w przyrodzie metali III grupy jest glin.
Stanowi on 7,5% ogólnej masy pierwiastków wchodzących w skład skorupy ziemskiej zajmując trzecie miejsce po tlenie i krzemie, a pierwsze spośród metali. Glin występuje w przyrodzie jedynie w postaci różnych połączeń z innymi pierwiastkami, głównie jako składnik glinokrzemianów i tlenku glinowego.
Wyglądem swoim przypomina srebro. Czysty glin jest bardziej miękki od żelaza, ma znaczną wytrzymałość na zrywanie, zginanie i nie wykazuje przy tym kruchości. Rozpuszcza się dobrze w kwasie solnym dając chlorek glinowy AlCl3, słabiej w rozcieńczonym kwasie siarkowym, tworząc siarczan glinowy Al2(SO4)3.
2Al + 6HCl --> 2AlCl3 + 3H2
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Kwas azotowy stężony nie rozpuszcza glinu, toteż zbiorniki aluminiowe nadają się doskonale do transportu i przechowywania stężonego kwasu azotowego.
Glin reaguje z roztworami wodorotlenków litowców; w reakcji tworzą się gliniany oraz wydziela się wolny wodór
2Al + 2NaOH + H2 --> 2 NaAlO2 + 3H2
Rozpuszczanie się glinu zarówno w kwasach jak i zasadach wskazuje na charakter amfoteryczny jego tlenku.
Z kilku występujących w przyrodzie związków glinu znany jest boksyt Al2O3*2H2O używany do wyrobu glinu oraz korund - używany jako kamień ozdobny (kryształy niebieskie noszą nazwę szafirów, czerwone - rubinów).
Chemiczne własności galu i indu podobne są do własności glinu, chociaż istnieją także pewne różnice.
Ind w przeciwieństwie do glinu, nie reaguje z zasadami.
Tal różni się od pozostałych metali III grupy przede wszystkim tym, że łatwo tworzy jednododatnie jony (TlCl).
Bor stosowany jest jako dodatek do stopów (Ni, Mn i stali) - podwyższa wytrzymałość, posiada wysokie ciepło spalania 14000 kcal/kg (wodór - 28800 kcal/kg). Wysokie ciepło spalania mają także borowodory (17000 kcal/kg), które znalazły zastosowanie jako paliwo rakietowe.
Bor tworzy z wodorem dwa szeregi połączeń, które przez analogię do węglowodorów nazywane są borowodorami. Wzory ogólne określające skład związków pierwszego i drugiego szeregu sa następujące;
BnHn+4 oraz BnHn+6
przy czym n przyjmuje wartości całkowite począwszy od 2. Są to związki elektronodeficytowe, w których udowodniono występowanie struktury mostkowej a którą jest orbital molekularny (złożony z orbitalu sp3 jednego atomu boru,1s atomu H i sp3 drugiego atomu B (jest nad płaszczyzną reszty cząsteczki) a drugi jest poniżej tej płaszczyzny. Każdy z tych orbitali rozporządza jedną parą elektronów.
H2B:HH:BH2
WYKŁAD IX
Grupa IV a - węglowce
Do pierwiastków IV grupy układu okresowego należą: węgiel (C), krzem (Si), german (Ge), cyna (sn), ołów (Pb).
W stanie podstawowym wykazuje konfigurację s2p2. Wykazuje tendencje zarówno do oddania jak i pobrania elektronów.
Wszystkie węglowce mogą tworzyć wiązania kowalencyjne. W grupie ze wzrostem masy atomowej zmienia się charakter pierwiastków.
Węgiel jest typowym niemetalem, natomiast cyna i ołów są typowymi metalami.
Węgiel występuje w przyrodzie zarówno w stanie wolnym jak i w postaci najrozmaitszych związków nieorganicznych i organicznych.
Do nieorganicznych związków węgla należą przede wszystkim: dwutlenek węgla, węglany i węgliki. Węglan wapniowy - składnik wapieni, kredy, marmurów - tworzy masywy górskie.
W stanie wolnym węgiel występuje w przyrodzie w postaci minerałów - diamentu i grafitu. Są to dwie różne odmiany alotropowe tego pierwiastka.
Krzem jest pierwiastkiem bardzo rozpowszechnionym w przyrodzie. Udział krzemu w budowie skorupy ziemskiej oceniany jest na 25,3%. W stanie wolnym w przyrodzie nie występuje, natomiast znany jest w postaci różnych związków, głównie krzemianów i glinokrzemianów, występuje także w postaci wolnego dwutlenku krzemu SiO2. Związki krzemowe wchodzą w skład takich powszechnie znanych ciał, jak piasek, glina, większość skał i minerałów. Ze znanych postaci występowania SiO2 należy wymienić kwarc (przezroczyste noszą nazwę kryształu górskiego).
Jednym z ważniejszych sztucznie otrzymywanych związków krzemu jest szkło. Szkło otrzymuje się przez ogrzewanie w specjalnych piecach szamotowych mieszaniny piasku z wapniem CaCO3 i sodą Na2CO3 lub siarczanem sodowym Na2SO4 do temperatury 1400oC. Skład chemiczny powstającej w tych warunkach masy szklanej odpowiada w przybliżeniu wzorowi: Na2O*CaO*6SiO2 albo Na2CaSi6O14.
Krzem posiada zdolność łączenia się z wodorem. Związki krzemu z wodorem nazywają się silanami. Struktura ich jest analogiczna do struktury węglowodorów nasyconych, a skład
wyraża się wzorem SinH2n+2
German należy do pierwiastków rzadkich. Wolny german z minimalnymi domieszkami innych pierwiastków, np. arsenu, wykazuje własności półprzewodnikowe, dlatego znalazł szeokie zastosowanie w elektronice; buduje się z niego elementy półprzewodnikowe. Związki germanu podobne są pod względem składu chemicznego do związków węgla.
Cyna jest metalem znanym od bardzo dawna. Najważniejszym minerałem cyny wystepującym w przyrodzie jest tlenek cyny(IV), zwany kasyterytem. Z niego po usunięciu siarki i arsenu (drogą prażenia) otrzymuje się cynę metaliczną. Proces przebiega zgodnie z równaniem.
SnO2 + 2C --> Sn + 2CO
Cyna występuje w dwóch odmianach alotropowych, jako cyna biała i cyna szara. Stop cyny z miedzią zawierający 4-20% cyny oraz miedź nazywany jest brązem. Odegrał on doniosłą rolę w rozwoju kultury monetarnej ludzkości.
W związkach cyna występuje jako dwu- lub czterododatnia.
Ołów występuje w przyrodzie głównie jako minerał zwany galeną PbS oraz jako cerusyt PbCO3. W stanie czystym otrzymuje się go w procesie:
2PbS + 3O2 --> 2PbO + 2SO2
2PbO + PbS --> 3Pb + SO2
Tlenek ołowiu(II) można również redukować koksem
Grupa V a - azotowce
Do piątej grupy układu okresowego, tzw. azotowców należą: azot (N), fosfor (P), arsen (As), antymon (Sb) i bizmut (Bi).
W stanie podstawowym atomy pierwiastków grupy V posiadają w zewnętrznej powłoce po pięć elektronów o konfiguracji s2p3. Mogą więc przyłączać trzy elektrony i tworzyć związki, w których występują na -3 stopniu utlenienia lub w reakcjach z bardziej od siebie elektroujemnymi pierwiastkami angażować w wiązania pewną liczbę elektronów i uzyskiwać dodatnie stopnie utlenienia (do +5).
W miarę wzrostu liczb atomowych pierwiastków tej grupy obserwujemy zmianę ich charakteru chemicznego od niemetalicznego do metalicznego.
Azot i fosfor są typowymi niemetalami, gdyż tworzą tylko tlenki kwasowe. Arsen i antymon są pierwiastkami półmetalicznymi, natomiast bizmut jest typowym metalem i tworzy tylko tlenki zasadowe.
W stanie wolnym pierwiastki V grupy posiadają stosunkowo małą reaktywność chemiczną. W związkach występują na stopniu utlenienia +5 (z wyjątkiem fosforowych) mają charakter średnich lub silnych utleniaczy.
Azot występuje w przyrodzie w stanie wolnym jak i związanym. Azot wolny jest głównym składnikiem powietrza (ok. 78% objętościowych). W postaci związków występuje przeważnie w organizmach żywych; jest jednym z ważniejszych pierwiastków wchodzących w skład białek roślinnych i zwierzęcych.
Do najczęściej spotykanych w przyrodzie nieorganicznych związków azotu należą: saletra sodowa NaNO3 (chilijska), saletra potasowa KNO3 (indyjska), saletra wapniowa Ca(NO3)2, amoniak i sole amonowe.
Najważniejszym połączeniem azotu i wodoru jest amoniak NH3 otrzymywany na drodze syntezy azotu i wodoru oraz jako produkt roboczy podczas prażenia węgla w gazowniach i koksowniach.
Reakcja syntezy przebiega w temperaturze T=500oC, ciśnieniu p=2*107Pa.
Z tlenem azot tworzy kilka związków: tlenek azotu(I) N2, tlenek azotu(II) NO, tlenek azotu(III) N2O3, tlenek azotu(IV) NO2 i tlenek azotu(V) N2O5. Tlenek azotu(V) jest bezwodnikiem kwasu azotowego(V) HNO3. Gorący i stężony kwas jest silnym utleniaczem. Kwas azotowy otrzymuje się metodą Habera-Boscha.
Reakcja przebiega w tmp. 500oC, p=200 atm i z udziałem katalizatora
N2 + 3H2 --> 2NH3
Kolejny etap to utlenianie otrzymanego amoniaku do tlenku z którego otrzymuje sie kwas azotowy(V).
Fosfor podobnie jak azot jest ważnym pierwiastkiem biogennym, tzn. warunkującym wzrost i rozwój organizmów żywych. Wchodzi on w postaci związanej w skład plazmy i jąder komórkowych. Fosfor nie występuje w przyrodzie w stanie wolnym. Spotykany jest głównie w postaci minerałów, takich jak: fosforyty i apatyty. W stanie stałym występuje w kilku odmianach alotropowych, jako fosfor biały, czerwony, fioletowy, szkarłatny i fosfor czarny.
Fosfor tworzy wiele kwasów tlenowych. Najważniejszym kwasem jest H3PO4 - kwas fosforowy(V) (ortofosforowy). można go otrzymać przez całkowitą hydrolizę P4O10 albo przez działanie stężonego HNO3 na fosfor.
P4O10 + H2O --> H3PO4
dalej ogrzewając kwas H3PO4 otrzymamy
H3PO4 --> H4P2O7 (kwas pirofosforowy)
H4P2O7 (kwas pirofosforowy) --> (HPO3)n (kwas metafosforowy)
Arsen w przyrodzie wystepuje głównie w postaci arsenków różnych metali oraz arsenosiarczków, np. arsenopirytu FeAsS. Arsen i jego związki są stosunkowo lotne. Wykorzystano to do otrzymywania arsenu w stanie wolnym za pomocą prażenia arsenopirytu bez dostępu powietrza.
FeAsS --> FeS + As
Arsen tworzy związki przypominające składem chemicznym związki fosforu, różnią się one jednak pewnymi właściwościami chemicznymi od połączeń fosforowych.
Podczas spalania arsenu powstaje tlenek arsenu(III) zwany arszenikiem, który jest bardzo silna trucizną.
Antymon i bizmut występują głównie w postaci siarczków Sb2S3 i Bi2S3. T siarczku Antymonu(III) przez ogrzewanie z opiłkami żelaza można otrzymać antymon metaliczny.
Sb2S3 = 3Fe --> 3FeS + 2Sb
Bizmut otrzymywany jest jako produkt uboczny przy rafinacji miedzi. Metaliczny bizmut stosowany jest głównie do produkcji różnych stopów, np. stop Wooda, który zawiera 50%Bi, 25%Pb, 13%Sn, 12%Cd.
Grupa VI a - tlenowce
Do VI grupy układu okresowego tzw. grupy tlenowców należą: tlen (O), siarka (S), selen (Se), tellur (Te) oraz polon (Po). Atomy pierwiastków tej grupy mają na zewnętrznej powłoce 6 elektronów o kofiguracji s2p4. W reakcjach chemicznych tlenowce uzupełniają zatem walencyjną powłokę elektronową do oktetu przyjmując dwa elektrony "uwspólniają" z atomami innych pierwiastków własne elektrony, tworząc spolaryzowane wiązania atomowe. Wszystkie pierwiastki grupy tlenowców z wyjątkiem tlenu, tworzą w roztworach wodnych samodzielnie istniejące aniony dwuujemne X2-, natomiast nie tworzą ( z wyjątkiem telluru i polonu) jonów dodatnich.
Najbardziej elektroujemny pierwiastek tej grupy - tlen, może posiadać najwyższy stopień utlenienia +2 (w związkach z fluorem), natomiast pozostałe pierwiastki grupy mogą mieć dodatnie stopnie utlenienia od +2 do +6.
Charakterystyczną cechą tlenowców, a zwłaszcza siarki i selenu, jest zdolność tworzenia różnych krystalicznych odmian alotropowych.
Tlen należy on do najbardziej rozpowszechnionych pierwiastków w przyrodzie. Zawartość tlenu w atmosferze, wodach i skorupie ziemskiej (do 16 km głębokości) stanowi prawie 50% ich składu chemicznego.
Główne ilości tlenu występują w przyrodzie w postaci związanej. Na przykład woda zawiera ok. 89% tlenu, piasek - 53%, a organizm ludzki ok. 65%.
Występuje w dwóch odmianach alotropowych - O2 tlen i O3 ozon. Tlen jest bezbarwnym, bez zapachu i smaku gazem występującym w cząsteczkach dwuatomowych.
Ciekły tlen jest barwy niebieskiej. Tlen tworzy połączenia z większością pierwiastków. Znajduje zastosowanie w lecznictwie i w technice przy wykonywaniu wielu procesów (palnik acetylenowo-tlenowy, hutnictwo, itp.)
Ozon O3 jest gazem o temperaturze wrzenia -112,3oC i temperaturze topnienia -249,6oC.
W temperaturze 300oC O3 natychmiast rozkłada się do tlenu O2 i tlenu atomowego O. Rozkład ten biegnie nawet w 100oC.
Ozon otrzymuje się następująco:
przepuszczanie przez tlen cichych wyładowań elektrycznych
naświetlanie tlenu promieniami nadfioletowymi
reakcje chemiczne, w których wydziela się tlen np. rozkład H2O2
działanie fluoru na wodę
Ozon O3 jest silnym utleniaczem. Ozon gazowy jest diamagnetyczny, a ciekły wykazuje własności paramagnetyczne, niezależne od temperatury.
Znany jest np. ozonek potasu KO3. Notowany jest również O4
Siarka jest ciałem stałym, barwy żółtej, kruchym. W wodzie praktycznie nie rozpuszcza się, dobrze natomiast rozpuszcza się w niektórych rozpuszczalnikach niewodnych, np. w dwusiarczku wegla CS2.
Czysta siarka w stanie stałym występuje w kilku odmianach alotropowych. Do najważniejszych odmian należą: siarka rombowa, jednoskośna i plastyczna. Najtrwalsza jest odmiana rombowa, wszystkie inne przechodzą w nią pod wpływem temperatury albo na skutek starzenia się. W stanie związanym siarka występuje pod postacią gipsu CaSO4*2H2O, pirytu FeS2, blendy cynkowej ZnS, galeny PbS i innych.
Siarka jest pierwiastkiem znacznie mniej reaktywnym niż tlen. Z wodorem tworzy kilka połączeń, z których najważniejszym jest siarkowodór. jest to gaz łatwo skraplający się, o charakterystycznym zapachu. Otrzymuje się go w wyniku bezpośredniej syntezy.
S + H2 --> H2S
W laboratorium gazowy siarkowodór otrzymuje się w reakcji kwasu solnego lub siarkowego z odpowiednimi siarczkami metali.
FeS + H2SO4 --> FeSO4 + H2S
Siarkowodór jest gazem silnie trującym. Wchodzi on w połączenia z hemoglobiną wypierając z niej tlen, co przy większych stężeniach gazu powoduje uduszenie. Roztwór w wodzie H2S nosi nazwę wody siarkowodorowej i ma słabokwaśny charakter.
H2S <=> H+ + HS-
HS- <=> H+ + S2-
Siarkowodór tworzy sole obojętne i kwaśne siarczki, które otrzymuje się przez wysycenie zasad lub soli odpowiedniego metalu gazowym siarkowodorem.
H2S + 2NaOH <=> Na2S + 2H2O
Roztwory siarczków metali I grupy lub amonu rozpuszczają znaczne ilości siarki, tworząc przy tym związki o barwach od żółtej do brunatnej, o wzorze ogólnym M2Sx, gdzie x = 2, 3, ...,6.
Siarka z tlenem tworzy kilka różnych związków, w których jako mniej elektroujemna od tlenu występuje na dodatnich stopniach utlenienia.
Wzór tlenku : SO, S2O3, SO2, SO3
Odpowiednio każdy z tlenków w reakcji z wodą tworzy kwas:
SO - H2SO2 (sulfoksylowy), H2S2O3 (tiosiarkowy)
S2O3 - H2S2O4 (podsiarkowy)
SO2 - H2SO3 (siarkowyIV), H2S2O5 (dwusiarkowy)
SO3 - H2SO4 (siarkowyVI), H2S2O7 (dwusiarkowy)
Ponadto znane są kwasy H2S2O6 (podsiarkowy), HSO5 (nadtlenosiarkowy, kwas Caro), H2S2O8 (nadtlenodwusiarkowy)
Reakcje siarki z tlenem zachodzą w podwyższonej temperaturze.
S + O2 --> SO2
Tlenek siarki(IV) SO2 jest gazem bezbarwnym o przenikliwym zapachu, skraplającym się w temperaturze -10oC>
Tlenek siarki(VI) SO3 otrzymuje się przez katalityczne (V2O5) utlenianie SO2
SO2 + 1/2O2 --> SO3
Jest on bezwodnikiem kwasu siarkowego(VI), tzn. łączy się z wodą tworząc kwas siarkowy(VI).
SO3 + H2O --> H2SO4
Chemicznie czysty kwas siarkowy(VI) jest bezbarwną oleistą cieczą, zastygającą w temperaturze 10oC w postaci krystalicznej masy.
Selen, tellur stanowią najczęściej domieszkę rud siarczkowych. Otrzymywane są w postaci koncentratów ze szlamu anodowego powstającego przy elektrolitycznym oczyszczaniu miedzi oraz z pyłu powstającego przy prażeniu FeS2.
Selen znany jest w postaci niemetalicznej o barwie czerwonej oraz metalicznej o barwie szarej. W przypadku telluru odmiana metaliczna jest znacznie trwalsza od odmiany niemetalicznej.
Polon istnieje jedynie w dwóch odmianach metalicznych (alfa) i (beta). Z powyższego łatwo zauważyć wzrost charakteru metalicznego w ramach omawianej grupy.
Grupa VIIa - fluorowce
Do grupy fluorowców zalicza się następujące p[ierwiastki: Fluor (F), chlor (Cl), brom (Br), Jod (I), astat (At). Pierwiastki VII grupy mają w powłoce walencyjnej konfigurację elektronową s2p5. Fluor występuje jedynie na -1 stopniu utlenienia. Pozostałe fluorowce mają zdolność do tworzenia wiązań z wykorzystaniem orbitala typu d. Dlatego w połączeniach występują na stopniu utlenienia od -1 do +7.
Ogólne własności fluorowców.
Temperatury topnienia i wrzenia rosną ze wzrostem liczby atomowej.
Fluor i chlor są gazami, brom jest cieczą, jod ciałem stałym. Wszystkie tworzą cząsteczki dwuatomowe. Wartość energii wiązania w cząsteczce fluoru jest bardzo niska, około 38 kcal/mol. Przyczyną tego jest odpychanie pomiędzy elektronami niewiążącymi.
Fluorowce są utleniaczami. Najsilniejszym jest fluor, a nasłabszym jod. Fluor utlenia wodę do wolnego tlenu. Reakcja jest samorzutna i silnie egzotermiczna.
F2 + H2O --> 2H+ + 2F- + 1/2O2 H= -190 kcal/mol
Analogiczna reakcja z chlorem ze względu na wysoką energię aktywacji nie daje utlenienia wody a ma miejsce tutaj reakcja dysproporcjonowania
Cl2 + H2O --> HCl + HClO
Wszystkie fluorowce reagują z metalami, a także i z wieloma niemetalami. Najbardziej aktywny jest fluor, aktywność maleje ze wzrostem liczby atomowej.
Wszystkie fluorowce tworzą z wodorem fluorowcowodory typu HX. HCl, HBr i HI - są gazami. HF jest cieczą o temperaturze wrzenia 19oC. Uwarunkowane to jest tworzeniem wiązań wodorowych pomiędzy cząsteczkami HF.
Ciekłe fluorowodory nie przewodzą prądu elektrycznego, nie są więc elektrolitami. W roztworach wodnych ulegają dysocjacji i z wyjątkiem fluorowodoru, który jest słabym kwasem (Ka = 7,2*10-4), pozostałe są mocnymi elektrolitami.
Wszystkie fluorowce tworzą połączenia z tlenem a chlor tworzy szereg kwasów tlenowych.
związki fluoru z tlenem: F2O
związki chloru z tlenem: (HClO, Cl2O), HClO2, ClO2, HClO3, (HClO4, Cl2O7)
związki bromu z tlenem: HBrO, HBrO3
związki jodu z tlenem: HIO, (HIO3, I2O5), H5IO6
Podchloryn sodowy NaClO stosowany jest jako środek wybielający i utleniający. Do dezynfekcji stosuje się tzw. wapno chlorowane. Jest to produkt otrzymany przez działanie chloru na wodorotlenek wapnia.
Kwasy tlenowe chloru mają własności utleniające, przy czym ze wzrostem stopnia utlenienia chloru maleją własności utleniające, a wzrasta moc kwasu.
Grupa VIII a - helowce
Do VIII grupy układu okresowego należą gazy szlachetne; hel (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe), radon (Rn).
Helowce w najbardziej zewnętrznej powłoce elektronowej posiadają całkowicie zapełniony poziom s i p. Powłoka walencyjna tym samym posiada układ s2p6. Dlatego helowce są chemicznie bardzo mało aktywne.
Helowce na ziemi występują w małych ilościach w atmosferze otaczającej naszą planetę. Dość duże ilości helu (do 1%) występują w niektórych źródłach gazu ziemnego (Polska, Ameryka Pn).
Gazy szlachetne znajdują szerokie zastosowanie praktyczne. Między innymi stosowane są do chłodzenia urządzeń nadprzewodnikowych i do prac w temperaturach bliskich zeru absolutnemu, do utrzymywania obojętnej atmosfery, np. beztlenowej oraz do napełniania wnętrz żarówek o dużej mocy.
Helowce wskutek całkowitego zapełnienia powłok s i p nie są zdolne do tworzenia cząsteczek dwuatomowych. Również ze względu na wysokie potencjały jonizacji (tablica 11.8) nie tworzą wiązań jonowych.
Helowce mają niskie temperatury topnienia i wrzenia. Dopiero w bardzo niskich temperaturach ich energia kinetyczna ulega tak dużemu zmniejszeniu, że słabe siły van der Waalsa powodują, że następuje skroplenie i zestalenie się gazów szlachetnych.
Połączenia helowców znane są dopiero od 1962 r., kiedy to Bertett i Lohman wykonali syntezę związku ksenonu z sześciofluorkiem platyny.
Xe + PtF6 --> XePtF6
Jest to substancja stała barwy żółtej.
Znane są również połączenia kryptonu i radonu.
Wodór
Wodór podobnie jak tlen należy do pierwiastków bardzo rozpowszechnionych w przyrodzie. Na ziemi wodór w stanie wolnym występuje bardzo rzadko, natomiast spotykany jest bardzo często w postaci związków (woda, kwasy, zasady, wszystkie związki organiczne, itp.).
We wszechświecie wodór jest jednym z najbardziej rozpowszechnionych pierwiastków. Stanowi ok. 80% atmosfery słońca, a również w atmosferze gwiazd ma znaczną przewagę ilościową nad innymi pierwiastkami.
Jest gazem bezbarwnym, bez zapachu i smaku o temperaturze wrzenia -252,78oC i temperaturze krzepnięcia - 259,2 oC.
Jest gazem bardzo aktywnym, dlatego występuje w postaci połączeń chemicznych.
Znany jest w postaci trzech izotopów 11H, 21D, 31T.
W laboratoriach wodór otrzymuje się w reakcji kwasów lub zasad z metalami.
Zn + H2SO4 --> ZnSO4 + H2
2Al + 6NaOH --> 2Na2AlO3 + 3 H2
Na skale przemysłową otrzymuje się go
z gazu wodnego
C + H2O --> CO + H2
z gazu koksowniczego, który zawiera 47% H2. Wodór wyodrębnia się przez wykraplanie pozostałych składników gazu.
przez przepuszczenie pary wodnej nad sproszkowanym i ogrzanym do 600oC żelazem
3Fe + 4H2O -->Fe3O4 + 4H2
regeneracja Fe3O4 + 4CO --> 3Fe + 4CO2
Wodór tworzy połączenia z większością pierwiastków.
Wodór tworzy jony H+ o promieniu 10-13 cm oraz jon H- - jon wodorkowy o promieniu 1,95*10-8 cm. Jon H+ ma własności kwasowe, jest akceptorem pary elektronowej, a jon H- ma własności zasadowe - jest donorem pary elektronowej.
Jon H+ ze względu na wytworzone duże pole elektryczne nie może istnieć samodzielnie. W obecności cząsteczek, w których występują atomy z wolnymi parami elektronowymi tworzy układy.
H2O + H+ --> H3O+
NH3 + H+ --> NH4+
Wodór z pierwiastkami metalicznymi tworzy wodorki.
I i II grupa MH i MH2 - połączenia typu soli o wiązaniu jonowym o wysokich temperaturach wrzenia i topnienia przewodzące prąd w stanie stopionym
III i IV grupa - związki o wiązaniu kowalencyjnym. Przykład BH3 - bor ma nie obsadzony orbital 2p, może przyłączyć wodór H-, powstaje wtedy BH4- stabilizowany kationem, np. Li+ - LiBH4 lub Al3+ - Al(BH3)3. Są to wodorki kompleksowe
IV grupa - węglowodory, silany
V, VI, VII grupa - związki o wiązaniu spolaryzowanym. Wodór występuje w postaci H+, wiązania są spolaryzowane w kierunku atomów o dużej elektroujemności
Nadtlenek wodoru. Znany jest związek tlenu i wodoru, w którym na jeden atom tlenu przypada jeden atom wodoru. Związek ten o wzorze chemicznym H2O2 nosi nazwę nadtlenku wodoru.
Roztwór wodny nadtlenku wodoru znany jest pod nazwą wody utlenionej. Roztwór 3% - woda utleniona - środek dezynfekujący i łagodny środek utleniający. Roztwór 30% -perhydrol - silny utleniacz stosowany w przemyśle jako czynnik utleniający.
Roztwory o stężeniach poniżej 35% są trwałe, a stężeniu powyżej 65% sa niebezpieczne ponieważ H2O2 o tym stężeniu przy zetknięciu z wieloma związkami organicznymi wybucha. Ponadto H2O2 stosowany jest jako utleniacz w paliwach rakietowych.
na skalę laboratoryjną nadtlenek wodoru można otrzymać w reakcji nadtlenku sodowego lub barowego z kwasem siarkowym lub fosforowym po oddestylowaniu produktu pod zmniejszonym ciśnieniem.
Na2O2 + H2SO4 --> Na2SO4 + H2O2
BaO2 + H2SO4 --> BaSO4 + H2O2
Na skalę przemysłową H2O2 otrzymuje się przez anodowe utlenianie kwasu siarkowego do kwasu nadtlenodwusiarkowego.
Reakcja katodowa
2H+ + 2e --> H2
Reakcja anodowa
2H2SO4 --> H2S2O8 + 2H+ + 2e
Tworzący się w mieszaninie reagującej H2S2O8 w czasie ogrzewania przekształca się w kwas nadtlenojednosiarkowy, tzw. kwas caro.
WYKŁAD X
Pierwiastki bloku d
Pierwiastki przejściowe. Metale rodzin pobocznych - charakteryzują się innymi cechami niż metale rodzin głównych.
Posiadają inne rozmieszczenie elektronów wartościowych. Elektrony te występują nie tylko w powłoce zewnętrznej, lecz część znajduje się w powłokach głębszych, w których liczba elektronów może dochodzić do 18 lub 32. Elektrony niekompletnych powłok wewnętrznych również biorą udział w wiązaniach chemicznych, dlatego w VIII grupie mamy wartościowość +8. Powłoki wewnętrzne uzupełnione do liczby 18 lub 32 elektronów nie oddają ich w reakcjach z innymi atomami i wtedy reagują tylko 2 elektrony powłoki walencyjnej np. atomy cynkowców są tylko dwuwartościowe. Zawsze jednak łączna liczba elektronów walencyjnych jest zgodna z kolejną numeracją grupy.
Wszystkie pierwiastki przejściowe są metalami. Zależnie jednak od podgrupy, do której należą, różnią się właściwościami. Energie jonizacji pierwiastków przejściowych mają wartości pośrednie pomiędzy wartościami energii jonizacji pierwiastków bloku s .
Charakterystyczną cechą pierwiastków przejściowych jest ich zmienna wartościowość, która może przyjmować wszystkie wartości od +2 (lub +1) do maksymalnej w danej podgrupie.
Biorąc pod uwagę własności pierwiastków grup głównych i pobocznych stwierdzamy, że różnią się one znacznie od siebie.
Jeżeli porównamy reaktywność litowców i miedziowców to stwierdzamy, że o ile litowce są najbardziej reaktywnym spośród wszystkich metali, to miedziowce stanowią wspólnie z platynowcami (VIII podgrupa) grupę tzw. metali szlachetnych, to znaczy mniej reaktywnych chemicznie.
Podobne różnice cech fizycznych i chemicznych spotykamy w następnych grupach i podgrupach układu okresowego.
W połączeniach z tlenem i wodorem metale grup pobocznych tworzą zasady, związki amfoteryczne albo kwasy. Zależy to od stopnia utlenienia atomu danego metalu.
Przy rzadko występującym wśród metali grup pobocznych stopniu utlenienia +1 i stopniu utlenienia +2 mamy do czynienia ze związkami typu zasad, a przy stopniu utlenienia +3, +4 związki mają charakter amfoterów, a przy stopniu utlenienia +5, +6, +7 - kwasów.
Zasady zawierające metal grup pobocznych na stopniu utlenienia +1, o ogólnym wzorze MOH, są związkami nietrwałymi, rzadkimi i są z reguły mocnymi elektrolitami, chociaż na ogół trudno rozpuszczalnymi w wodzie (np. AgOH). Bardziej trwałymi są słabe zasady o wzorze ogólnym M(OH)2.
Przy trój- i cztero dodatnim stopniu utlenienia metalu związki mają charakter amfoteryczny, przy czym mogą mieć strukturę ortozwiązków, np. M(OH)3, M(OH)4, H3MO3, H4MO4, albo meta związków - HMO2 i H2MO3.
W przypadku gdy metale grup pobocznych występują na +6 i +7 stopniu utlenienia, tworzą się nietrwałe dość mocne kwasy o wzorach ogólnych H2MO4, HMO4.
Ważną również cechą metali przejściowych, rzadziej spotykaną u metali grup głównych jest zdolność tworzenia związków zabarwionych. Sole miedzi mają zwykle barwę zieloną lub niebieską, kobaltu różową, niklu zieloną, nadmanganianu fioletową, sole chromu od niebieskiej poprzez zieloną do żółtej.
Grupa Ib - miedziowce
Pierwszą podgrupę układu okresowego pierwiastków stanowią trzy metale: miedź (Cu), srebro (Ag) i złoto (Au). Konfigurację elektronową dwóch pierwszych powłok atomów tych pierwiastków można przedstawić w sposób następujący: (n-1)d10ns1 gdzie n wynosi: dla Cu - 4, dla Ag - 5 a dla Au - 6. Obecność tylko jednego elektronu w najbardziej zewnętrznej powłoce elektronowej jest przyczyną, że pierwiastki te występują w związkach głównie na +1 stopniu utlenienia i tworzą jony M+.
Zatem istnieją jony Ag+, Cu+ i Au+, jednak utleniają się do jonu Cu2+ i Au3+. Jon srebra Ag+ jest w roztworze wodnym trwały.
Miedź. Występuje w przyrodzie zarówno w stanie rodzimym jako wolny metal, jak i w postaci związków, głównie siarczków, tlenków i węglanów.
Miedź posiada szereg cennych własności. Ze względu na wysokie przewodnictwo elektryczne i cieplne, a także korzystne własności mechaniczne, ma bardzo liczne zastosowania. Stosuje się przede wszystkim w przemyśle elektrochemicznym i elektrotechnicznym. Z miedzi produkuje się przewody elektryczne, uzwojenia transformatorów, prądnic i motorów elektrycznych.
Na powietrzu miedź utlenia się słabo i powoli. W wilgoci pokrywa się zieloną, dobrze przylegającą powłoką hydroksylenu miedziowego Cu2(OH)2CO3 zwaną patyną.
Miedź znajduje również zastosowanie jako metal stopowy. Ze znanych stopów należy wymienić brąz (stop miedzi z cyną), mosiądz (stop miedzi z cynkiem).
Srebro niekiedy występuje w przyrodzie jako wolny pierwiastek, częściej jednak w postaci związków, głównie jako siarczek Ag2S i chlorek AgCl. Srebro jest metalem srebrzystobiałym o dużym połysku, dość miękkim, kowalnym i ciągliwym. Jest najlepszym przewodnikiem elektryczności spośród metali, a także dobrym przewodnikiem ciepła. Jest odporne na działanie kwasów i zasad, ulega tylko działaniu kwasu azotowego i gorącego kwasu siarkowego.
Zastosowanie srebra jest duże. W stopach z miedzią służy do wyrobu monet, ozdobnych przedmiotów, nakryć stołowych. itp. Związki srebra stosuje się do otrzymywania materiałów światłoczułych. Najważniejszym związkiem srebra jest azotan srebra AgNO3.
Złoto występuje w przyrodzie głównie w stanie wolnym. Od domieszek, czyli od tzw. złoża, oddzielane jest w sposób mechaniczny (płukanie złota). Do najtrwalszych i najważniejszych połączeń złota należą jego chlorki, bromki i jodki.
Grupa II b - cynkowce
Cynk (Zn), kadm (Cd), rtęć (Hg) tworzą II podgrupę tzw. cynkowców
Konfiguracja elektronowa dwóch zewnętrznych powłok atomów cynkowców jest następująca:
(n-1)d10ns2 gdzie; n dla cynku wynosi 4, dla kadmu 5, dla rtęci 6. Ze względu na obecność trwałego 18 elektronowego układu w powłoce pod zewnętrznej oraz dwóch elektronów w zewnętrznej powłoce s, cynkowce występują w związkach tylko na dwu dodatnim stopniu utlenienia.
Najważniejszym spośród metali II podgrupy jest cynk. Zajmuje on w światowej produkcji metali trzecie miejsce za żelazem i miedzią.
Cynk występuje w przyrodzie tylko w postaci związków. Do najważniejszych minerałów cynku należy blenda cynkowa ZnS oraz galman zawierający głównie ZnCO3. Minerały te są podstawowymi surowcami do produkcji cynku.
Cynk jest metalem srebrzystoszarym o gęstości 7,13 g/cm3, temperatura topnienia 419oC i temperatura wrzenia 907oC. Na powietrzu cynk pokrywa się ściśle przylegającą warstwą tlenku, albo hydroksywęglanu cynkowego, które chronią go przed korozją. Zastosowanie cynku jest różnorodne. Służy do wyrobu blachy cynkowej, do wykonania odlewów, do stopów oraz do cynkowania.
Cynk jest metalem dość aktywnym chemicznie, wypiera wodór z kwasów, a na gorąco z wody.
Kadm występuje w przyrodzie w postaci minerału CdS, nie tworzy on samodzielnych złóż, występuje natomiast w większości złóż minerałów cynkowych. Kadm otrzymywany jako produkt uboczny przy produkcji cynku. Ma zastosowanie bardziej ograniczone niż cynk. Używa się jego do wytwarzania stopów np. topiący się w temperaturze 65,6oC stop Wooda składa się z 50% Bi, 25% Pb, 12,5% Sn i 12,5% Cd.
Właściwości chemiczne związków kadmu podobne są do związków cynku. Podobnie jak cynk, kadm występuje w związkach na +2 stopniu utlenienia.
Rtęć występuje w przyrodzie głównie w postaci siarczku HgS (cynober). Złoża cynobru zawierają niekiedy niewielkie ilości rtęci w stanie wolnym.
Wolna rtęć ma dość szerokie zastosowanie praktyczne i laboratoryjne, ponieważ jest metalem o najniższej temperaturze topnienia i w temperaturze pokojowej jest cieczą. Ze względu na bierność chemiczną, płynność, dużą gęstość i dobre przewodnictwo elektryczne stosuje się ją w produkcji kontaktów elektrycznych, termometrów, barometrów i wielu specjalnych aparatów naukowych.
Rtęć rozpuszcza wiele metali tworząc odpowiednie stopy zwane amalgamatami.
W związkach rtęć występuje głównie na +2 stopniu utlenienia. Związki dwu dodatniej rtęci różnią się nieco własnościami od analogicznych związków cynku i kadmu, głównie dlatego, że jony rtęciowe mają tendencję do tworzenia wiązań atomowych spolaryzowanych. Wszystkie rozpuszczalne związki rtęci są silnie trujące. HgCl2 - sublimat, nierozpuszczalny żółty tlenek HgO, stosowany jest w różnych maściach.
Grupa III b - skandowce
Skand (Sc), itr (Y), lantan (La), aktyn (Ac) mają konfigurację elektronową (n-1)d1ns2 posiadają zatem trzy elektrony walencyjne, z których dwa znajdują się na orbitalu s ostatniej powłoki elektronowej, a jeden na orbitalu d powłoki przedostatniej. Pierwsze trzy skandowce, występują w przyrodzie w postaci związków na +3 stopniu utlenienia. Tworzą one tlenki o wzorze ogólnym M2O3, z których wywodzą się wodorotlenki Sc(OH)3, Y(OH)3, La(OH)3. Zarówno skandowce, jak ich związki są bardzo rzadko spotykane w przyrodzie i w postaci bardzo rozproszonej.
W stanie wolnym otrzymuje się je metodą elektrolizy stopionych chlorków, albo przez redukcję chlorków magnezem.
Grupa IV b - tytanowce
Tytan (Ti), cyrkon (Zr) i hafn (Hf) mają konfigurację elektronową typu (n-1)d2ns2 a zatem posiadają cztery elektrony walencyjne, z których dwa znajdują się na orbitalu s ostatniej powłoki elektronowej, a pozostałe dwa na orbitalu d powłoki przedostatniej.
Pierwiastki grupy tytanu występują w związkach na +2, +3, +4 stopniu utlenienia tworząc odpowiednie połączenia z tlenem i z chlorem. Najbardziej rozpowszechnionym pierwiastkiem tej grupy jest tytan; stanowi on około 0,63% składu chemicznego skorupy ziemskiej. Najważniejszymi rudami tytanu są TiO2 i FeTiO3.
Tytan jest metalem twardym, stosunkowo lekkim, o gęstości 4,5 g/cm3 odpornym na korozję i wysokie temperatury. W stopach z innymi metalami używany jest do produkcji kotłów, chłodnic w reaktorach jądrowych, części podwodnych okrętów, części samolotów, itp.
Dwutlenek tytanu TiO2, tzw. biel tytanowa jest trudno rozpuszczalnym w wodzie, białym proszkiem, stosowanym do wyrobu białych farb, białej gumy itp.
Czterochlorek tytanu TiCl4 hydrolizuje samorzutnie w wilgotnym powietrzu, stąd jego zastosowanie do wytwarzania zasłon dymnych.
Cyrkon i hafn występują razem, zwykle w postaci krzemianów i tlenków. Należą do pierwiastków rzadkich. Tlenek cyrkonu z uwagi na jego wysoką temperaturę topnienia (2700oC), stosowany jest do wyrobu tygli i wnętrz pieców odpornych na wysokie temperatury.
Grupa V b - wanadowce
Wanad (V), niob (Nb) i tantal (Ta) posiadają po pięć elektronów walencyjnych, 3 elektrony na orbitalu d i 2 na orbitalu s, mogą więc w związkach występować na +2, +3, +4 i +5 stopniu utlenienia. Związki wanadowe zawierają V2+, sa związkami jonowymi, podobnie jak związki żelazowe są silnymi reduktorami, a ich wodorotlenki maja charakter zasadowy.
Tlenek wanadowy VO jest dość twardym ciemnoszarym ciałem stałym. Rozpuszcza się w rozcieńczonym kwasie solnym, kwasie fluorowodorowym i azotowym, zabarwiając roztwór na kolor fioletowy.
Związki zawierające atomy wanadu na +3 stopniu utlenienia własnościami swymi przypominają związki żelazowe.
Związki zawierające wanad na +4 i +5 stopniu utlenienia mają charakter kowalencyjny jak np. VCl4. Są też amfoteryczne jak np. VO2. Kwasy wanadowców HVO3, HNbO3, HTaO3 sa podobne do kwasów azotowców.
Wanad stosuje się jako jeden ze składników stali stopowych.
Niob używany jest do wyrobu nierdzewnej stali chromoniklowej. Tantal ze względu na bardzo małą reaktywność chemiczną stosowany jest do wyrobu narzędzi chirurgicznych. Ponadto tlenek wanadu(V) V2O5 jest jednym z ważniejszych katalizatorów, między innymi w reakcji utleniania SO2 do SO3 w metodzie kontaktowej produkcji kwasu siarkowego.
Grupa VI b - chromowce
Chrom (Cr), molibden (Mo) i wolfram (W) stanowią VI podgrupę w układzie okresowym zwaną podgrupą chromowców. Konfiguracja elektronowa tych pierwiastków jest następująca
W - 5d46s2, Mo - 4d55s1 , Cr - 3d54s1.
Podobnie jak atomy pierwiastków innych grup pobocznych, atomy chromowców mogą w reakcjach chemicznych oddawać lub angażować w wiązania elektrony nie tylko z ostatniej, lecz i z przedostatniej powłoki elektronowej. To tłumaczy różne stopnie utlenienia chromowców (od +1 do +6).
Największe rozpowszechnienie spośród pierwiastków chromowców wykazuje chrom; występuje w przyrodzie głównie w postaci minerału chromitu FeO*Cr2O3 lub FeCr2O4. Inne minerały zawierające chrom nie mają większego znaczenia technicznego.
Wolny chrom otrzymuje się w reakcji
Cr2O3 + 2Al --> Al2O3 + Cr
Czysty chrom jest metalem barwy stalowoszarej o silnym połysku, topiącym się w temperaturze około 1900oC. Chrom, podobnie jak mangan, odgrywa ważną rolę w produkcji wysokowartościowych stali. Przykładem tego typu stali może być stal nierdzewna, która jest stopem żelaza z chromem i węglem (12% Cr, 0,3% C)
Stale stopowe zawierające chrom odznaczają się dużą twardością i odpornością na działanie zarówno czynników mechanicznych jak i chemicznych.
Chrom używa się do elektrolitycznego pokrywania metali i stopów mało odpornych na korozję. Proces ten nazywa się chromowaniem. W związkach chemicznych chrom występuje jako pierwiastek +1, +2, +3, +4, +5, +6 dodatni. Związki chromu mają również duże znaczenie. Chromiany np. Na2CrO4 są inhibitorami korozji, ałun chromowo-potasowy K2CrO4*Cr2(SO4)3*24H2O ma znaczenie w przemyśle farbiarskim i garbarskim.
Chromian ołowiu(II) PbCrO4 - żółcień chromowa i tlenek chromu(III) Cr2O3 - zieleń chromowa stosowane są jako pigmenty.
Chromiany maja własności utleniające, szczególnie w roztworach zakwaszonych. Utleniają one siarkowodór do wolnej siarki, węgiel do dwutlenku węgla, itp., przy czym chrom ze stopnia utlenienia +6 redukuje się do chromu +3
Cr2O72- + 3H2S + 8H3O+ --> 2Cr3+ + 3S + 15H2O
2Cr2O72- + 3C + 16H3O+ --> 4Cr3+ + 3CO2 + 24H2O
Molibden występuje w przyrodzie jako dwusiarczek MoS2 w minerale zwanym molibdenem. Minerał ten tworzy ciemne, błyszczące blaszki, bardzo podobne do grafitu. Ma on zastosowanie w przemyśle elektrycznym i elektronowym. Molibden o czystości wyższej niż 99,9% używany jest do wyrobu siatek i anod w lampach elektronowych oraz włókien w lampach żarowych. Stale szybkotnące zawierają ponad 8% Mo.
Wolfram występuje w przyrodzie w postaci minerałów - szelitu CaWO4 i wolframitu (Fe, Mn)WO4. Z powodu bardzo wysokiej temperatury topnienia (3370oC), wolfram podobnie jak molibden, używany jest do produkcji sprali żarówek elektrycznych, kontaktów specjalnych, tarcz elektronowych w lampach rentgenowskich, itp. stosowany jest również do wyrobu stali wolframowej, zachowującej twardość nawet w bardzo wysokich temperaturach.
Grupa VII b - manganowce
Do VII podgrupy układu okresowego należą; mangan (Mn), otrzymywany sztucznie technet (Tc) i ren (Re). Jedynie mangan występuje w przyrodzie w większych ilościach i w związku z tym jest lepiej poznany oraz znajduje szersze zastosowanie.
Konfiguracja elektronowa pierwiastków VII podgrupy jest następująca: (n-1)d5ns2.
Dlatego też mangan występuje w związkach jako pierwiastek 2+, 3+. 4+, 6+, 7+ dodatni.
Głównym minerałem, z którego otrzymuje się mangan i jego połączenie jest tlenek manganu(IV) zwany piraluzytem lub brausztynem.
Otrzymywanie manganu z piroluzytu polega na redukcji MnO2 za pomocą węgla lub glinu metalicznego.
Mangan jest metalem srebrzystoszarym, dość twardym i kruchym. jego gęstość wynosi 7,3 g/cm,sup>3, a temperatura topnienia 1243oC. W kwasach rozcieńczonych rozpuszcza się z wytworzeniem soli manganowych, zawierających Mn2+.
Mangan stosowany jest przede wszystkim do wyrobu stopów twardych, jako ferromangan, manganian, stal manganowa i inne. Najpospolitszymi związkami manganu są; siarczan(VI)manganu(II) MnSO4, tlenek manganu(IV) MnO2 i nadmanganian potasowy KMnO4.
Mangan tworzy kilka tlenków. MnO tlenek manganu, Mn2O3 braunit, MnO2 brausztyn, Mn3O4 hausmanit, Mn2O7 - ten ostatni jest cieczą barwy brązowej.
Inne związki to; wodorotlenek manganu Mn(OH)2, kwas manganawy Mn(OH)4, H4MnO4, kwas manganowy H2MnO4, kwas nadmanganowy HMnO4
Kwas nadmanganowy wystepuje tylko w postaci soli. Najbardziej znana sól to KMnO4, znana jako środek antyseptyczny i dobry utleniacz.
2KMnO4 --> K2MnO4 + MnO2 + O2
Ren jest pierwiastkiem bardzo rzadkim. Swoimi własnościami przypomina wolfram. podobnie jak wolfram posiada wysoką temperaturę topnienia (3200oC), dużą gęstość (21 g/cm3) i małą reaktywność chemiczną. Ponadto ren posiada specyficzne zdolności katalitycznego przyspieszania niektórych reakcji uwodornienia.
Technet jest pierwiastkiem bardzo mało znanym. Żadnego z ok. 20 jego izotopów nie wykryto na kuli ziemskiej.
Grupa VIII b - żelazowce, palladowce, platynowce
Do podgrupy VIII układu okresowego należą trzy triady:
żelazo Fe, kobalt Co, nikiel Ni
ruten Ru, rod Rh, pallad Pd
osm Os, iryd Ir, platyna Pt
Atomy tych pierwiastków posiadają różną liczbę elektronów na powłokach walencyjnych. Elektrony walencyjne żelaza mają konfigurację 3d64s2, kobaltu 3d74s2 a niklu 3d84s2. Na podstawie konfiguracji elektronowej można przewidzieć stopnie utlenienia tych metali w związkach.
Przyjmują one wartościowości
żelazo Fe +3, +2, +4, +6
kobalt Co +2, +3, +4
nikiel Ni +2, +3, +4
ruten Ru +4, +6, +8
rod Rh +3
pallad Pd +2, +4
osm Os +4, +6, +8
iryd Ir +1, +3, +4, +6
platyna Pt +2, +4
Najważniejszymi pod względem użytkowym i najbardziej rozpowszechnionym w przyrodzie pierwiastkami podgrupy VIII są: żelazo, kobalt i nikiel
Żelazo jest najbardziej rozpowszechnionym metale. W zewnętrznej skorupie ziemskiej zawartość Fe ocenia się na 4,7%, rdzeń skorupy ziemskiej prawdopodobnie zawiera przede wszystkim Fe i Ni.
Czyste żelazo jest stosunkowo miękkie, plastyczne, srebrzystoszare, dość odporne na korozję w powietrzu ze względu na pasywacje powierzchni.
Żelazo w postaci surowej otrzymuje się na skale techniczną z jego rud, na drodze redukcji tych związków za pomocą koksu lub tlenku węgla.
Fe2O3 + 2C --> FeO + Fe + 2CO
FeO + CO --> Fe + CO2
Fe2O3 + 3CO --> 2Fe + 3CO2
Fe2O3 + 3C --> 2Fe + 3CO
Do produkcji specjalnych gatunków stali stosuje się najczęściej żelazo kowalne, do którego dodaje się określonych ilości różnych składników polepszających jakość stali (Cr, Ni, Ir, Mn, Mo, Co).
Palladowce i platynowce należą do metali szlachetnych i najszlachetniejszych. Występują w stanie rodzimym, ale są bardzo rzadkimi pierwiastkami. Są dobrymi tworzywami technicznymi, ale bardzo drogimi.
Najbardziej rozpowszechniona jest platyna, metal bardzo ciężki, stalowo-srebrzysty , bardzo plastyczny, stosowany do wyrobu tygli i innych urządzeń ogniotrwałych i odpornych na działanie kwasów. Bardzo ważne znaczenie posiada jako katalizator różnych procesów chemicznych (synteza amoniaku).
Stop platyna - rod stosuje się do wyrobu drutu do wysokotemperaturowych termoogniw (termopary)
Stop platyna - iryd jest bardzo twardy i odporniejszy chemicznie od czystej platyny - wzorzec metra i kilograma
Stop osm - iryd jest jeszcze twardszy i stosuje się do wyrobu precyzyjnych mechanizmów.
Platyna i pallad mają zdolność rozpuszczania wodoru. Jedna objętość palladu pochłania 700 objętości wodoru.
Lantanowce
Konfiguracja elektronowa
Pierwiastek |
Symbol |
Z |
Konfiguracja elektronowa |
Stopień utlenienia |
Lantan |
La |
57 |
2, 8, 18, 18, 5s25p65d16s2 |
+3 |
Cer |
Ce |
58 |
4f26s2 |
+3, +4 |
Prazeodyn |
Pr |
59 |
4f36s2 |
+3 |
Neodyn |
Nd |
60 |
4f46s2 |
+3 |
Promet |
Pm |
61 |
4f56s2 |
+2, +3 |
Samar |
Sm |
62 |
4f66s2 |
+2, +3 |
Europ |
Eu |
63 |
4f76s2 |
+3 |
Gadolin |
Gd |
64 |
4f75d16s2 |
+3, +4 |
Terb |
Tb |
65 |
4f96s2 |
+3 |
Dysproz |
Dy |
66 |
4f106s2 |
+3 |
Holm |
Ho |
67 |
4f116s2 |
+3 |
Erb |
Er |
68 |
4f126s2 |
+3 |
Tul |
Tm |
69 |
4f136s2 |
+3 |
Iterb |
Yb |
70 |
4f146s2 |
+3 |
Lutet |
Lu |
71 |
4f145d16s2 |
+3 |
Ze względu na bliskość poziomów energetycznych 4f i 5d istnieje duża niepewność w ustaleniu niektórych konfiguracji elektronowych. Nie we wszystkich przypadkach konfiguracje elektronowe są oczywiste lecz wszystkie lantanowce tworzą głównie jony +3. Jeżeli chodzi o mechanizm powstawania tych jonów, to ogólnie przyjęto, że następuje utrata elektronów 6s2 równocześnie z elektronem 5d1 (jeśli jest obecny) lub jednego z elektronów 4f gdy brak elektronu 5d1.
Rozkład gęstości elektronowej orbitali 4f jest bardzo złożony.
Wszystkie lantanowce na ogół występują razem z wyjątkiem prometu, który ma nietrwałe jądro. Najbogatszym ich źródłem jest minerał monacyt.
Lantanowce nie są bardzo rozpowszechnione - najbardziej pospolitym lantanowcem jest cer, którego zawartość w skorupie ziemskiej wynosi
3 - 10 -4% wagowych.
Ze względu na wielkie podobieństwo własności chemicznych, lantanowce trudno jest dokładnie rozdzielić. Rozdzielenia można dokonać przez ostrożną, powtarzaną wielokrotnie krystalizację frakcyjną, a bardziej nowoczesne - przez zastosowanie techniki wymiany jonowej. Obie techniki rozdzielenia są oparte na niewielkich różnicach własności (jak np. rozpuszczalność, tworzenie jonów kompleksowych oraz uwodnienia) wynikających z różnic wymiarów jonów +3.
Przechodząc od La3+ do Lu3+ promień jonowy zmniejsza się z 0,106 do 0,085 nm. To zmniejszanie się, które nazywa się kontrakcją lantanowców, wynika ze wzrostu ładunku jądra podczas stopniowego wypełniania pod powłoki wewnętrznej.
Lantanowce są miękkimi szarymi metalami, które wymagają ochrony przed dostępem powietrza, ponieważ gwałtownie reagują z wilgocią i tlenem. Czyste metale, które można uzyskać o stosunkowo dużej czystości 99,9% i wyżej, są bardzo kosztowne. W sprzedaży znajdują się na ogół w zamkniętych komorach, wypełnionych gazem obojętnym, szczególnie gdy są stosowane do produkcji specjalnych urządzeń elektronicznych i optycznych. Pierwiastki ziem rzadkich stosowane są jako materiały laserowe. Europ i gadolin stosowane są w reaktorach atomowych do wychwytu neutronów termicznych.
Aktynowce
Wszystkie te jądra są nietrwałe na skutek emisji cząstek. Istnieją pewne prawdopodobieństwa, że dane jądro będzie samorzutnie emitować cząstki (alfa) tworząc tym samym nowe jądro o ładunku Z mniejszym o 2 jednostki.
Jeżeli chodzi o aktynowce takie jak tor i uran, to mają one raczej długi okres półtrwania (1,39*1010 lat dla 23260Th i 4,5*109 lat dla 23892U). Tak więc ich szybkości rozpadu są bardzo małe i jądra, obecne w chwili powstania Ziemi, istnieją nadal.
Aktynowce położone za uranem (tzw. pierwiastki transuranowe) nie mają długo żyjących prekursorów, tak więc nie występują w przyrodzie w ilościach mierzalnych, lecz muszą być otrzymywane sztucznie przy zastosowaniu akceleratorów cząstek lub reaktorów jądrowych.
Aktynowce są pierwiastkami metalicznymi. Podobne do lantanowców mają na ogół wysokie potencjały elektrodowe (ok. -2V) między pierwszym jonem trwałym w roztworze z metalem. W przeciwieństwie do lantanowców aktynowce wykazują różne stopnie utlenienia. (patrz tablica 11.10 - przykład U). W roztworze wodnym U3+ redukuje wodę z wydzieleniem H2, przy czym tworzy się U4+, który powoli utlenia się na powietrzu do UO22+ (tzw. jon uranylowy).
WYKŁAD XI
Jądro atomu
Oznaczenia i symbole
Jądro składa się z Z protonów i N neutronów. Proton i neutron mają w przybliżeniu takie same względne masy atomowe, równe 1.
Wobec tego liczba nukleonów, będzie odpowiadać zaokrąglonej względnej masie atomowej M, ponieważ liczba masowa
M = Z +N.
Proton pod względem wartości bezwzględnej ma taki sam ładunek elementarny jak elektron, zatem Z jest liczbą ładunkową jądra,
albo liczbą porządkową atomu, który jako neutralny twór ma Z elektronów w powłoce.
Jako symbol jądra wykorzystuje się skrótowe oznaczenia pierwiastka chemicznego i dopisuje się wskaźnik dolny z lewej strony
liczbę ładunkową Z a jako wskaźnik górny - liczbę masową M.
Liczbę neutronów otrzymuje się jako różnicę
N = M - Z
Przykład zapisu:
Hel: 24He Uran: 23892U
Węgiel
Wszystkie atomy węgla (C) mają 6 protonów i 6 elektronów. Liczbę protonów w atomie węgla zapisujemy jako wskaźnik dolny z lewej strony symbolu pierwiastka: 6C
Wartość ta nosi nazwę liczby atomowej i dla węgla zawsze ma wartość 6.
Inna liczba nazywana, "liczbą masową" jest zapisywana z lewej strony jako górny wskaźnik. Jest ona sumą ilości protonów i neutronów i jest różna dla różnych izotopów (definicja poniżej). Na przykład: 612C
Następny izotop węgla ma 6 protonów (liczba atomowa) i 8 neutronów (8=14-6). Te izotopy znane są jako "węgiel-14" i "węgiel-12" 614C
Określenie izotop oznacza zawsze jądra, które należą do tego samego pierwiastka, czyli mają taką samą liczbę atomową a różnią się liczbą masową.
Zbiór atomów o tej samej wartości liczby atomowej i masowej (o tej samej liczbie nukleonów w jądrze) nazywa się nuklidem.
Jądra o tej samej liczbie masowej nazywa się izobarami, np. jądro H-3 i He-3.
Modele i trwałość jądra atomowego
W trakcie prowadzonych badań przez Rutherforda, obserwacji procesów promieniotwórczych wyciągnięto wnioski, że jądra są tworami złożonymi, w których występują silne i skomplikowane oddziaływania nie znane w fizyce makroskopowej. Zbudowano zatem różne modele jądrowe, z których każdy może opisać niektóre, ale żaden nie może objąć wszystkich właściwości i reakcji jąder atomowych. Znane modele to:
kroplowy, powłokowy i kolektywny.
Model kroplowy. Model ten porównuje jądro do kropli cieczy i rozpatruje jako zbiór gęsto ze sobą związanych, sztywnych i kulistych nukleonów. Na podstawie tego modelu może być wyjaśniana trwałość średnio ciężkich jąder.
Model powłokowy. W modelu powłokowym przyjmuje się, że nukleony w jądrze poruszają się po stacjonarnych orbitach, którym odpowiadają dyskretne energie. Z modelu powłokowego wynika, że jądra o małych liczbach masowych z mniej więcej jednakową liczbą neutronów i protonów są najbardziej trwałe. Potwierdzeniem tego jest występowanie szczególnie trwałych układów, gdzie liczba protonów albo neutronów jest równa 2, 8, 20, 28, 50, 82 i 126. Noszą one nazwę liczb magicznych. Przykładem są pierwiastki
42He, 168O, 20882Pb.
Model kolektywny uwzględnia powstawanie kolektywnych stanów wszystkich nukleonów w jądrze. Wyjaśnia częściowo przebieg reakcji jądrowych.
Stabilność jąder atomowych
Jądra atomowe są nadzwyczaj trwałymi tworami, które nie rozkładają się na części składowe ani pod wpływem wysokich temperatur, ani pod wpływem najwyższych osiągalnych ciśnień. Energia wiązania nukleonów musi być zatem bardzo duża.
Trwałość jąder atomowych jest w znacznym stopniu określona przez liczbę i stosunek ilości różnych nukleonów. Dla trwałych, lekkich jąder jest słuszna zależność Z = N. Jądra z Z > 83 nie są już trwałe, ponieważ wszystkie pierwiastki za bizmutem mają tylko izotopy promieniotwórcze.
W przyrodzie spotyka się oprócz jąder trwałych także nuklidy o tak długim czasie życia, że od czasu wytworzenia materii ziemskiej /ok. 6 mld lat/ jeszcze do tej pory nie rozpadły się zupełnie jak to jest np. w przypadku jąder uranu i toru.
Defekt masy
Według Einsteina, każdej masie m odpowiada energia określona wzorem:
E = mc2
Gdzie: m- masa, c - predkość światła = 300000 km/s
Według tej równoważności każda zmiana energii musi być związana ze zmianą masy. Na przykład przy połączeniu atomów w molekuły masa maleje ze względu na oddaną energię wiązania. Z drugiej strony, chemiczna energia wiązania jest o wiele za mała, aby wywołać zauważalne zmiany masy.
Natomiast w zakresie jąder atomowych wyzwolona przez połączenie nukleonów energia wiązania jest równoważna zmianie masy rzędu 1 %. I dlatego może być określana przez porównanie masy jądra z masą nukleonów.
Należałoby oczekiwać, że masa jądra jest równa sumie mas zawartych w jądrze nukleonów. W rzeczywistości jest ona mniejsza i ten defekt masy /ubytek/ jest równoważny energii wiązania.
Oznaczając przez M - masę jądra, przez Mp - masę protonu, Mn - masę neutronu, Z - liczbą ładunkową,
N - liczbę neutronów, można defekt masy wyrazić zależnością:
Przykład obliczenia defektu masy dla 42He
Nazwa Masa
Masa protonu Mp 1,007825
Masa neutronu Mn 1,008665
2 * Mp dla helu 2,015650
2 * Mn dla helu 2,017330
Suma mas protonów i neutronów 4.032980
Masa atomowa helu 4.002600
Defekt masy 0,030380
Wyzwala się przy tym 28,27 MeV energii tj. gdy 4 nukleony połączą się w jądra helu. Z tego da się oszacować energię, która wyzwoliłaby się przy wiązaniu 1 kg helu z jego elementów składowych. Wyzwolona energia wynosi tyle ile otrzymamy ze spalenia 25 000 ton węgla kamiennego.
Defekt masy przypadający na jeden nukleon (delta) M/M i przeliczony na jednostkę energii E = mc2 nosi nazwę energii wiązania i jest cechą danego jądra. Im wyższa wartość energii wiązania, tym jądro jest trwalsze. Najwyższe energie wiązań mają jądra o liczbach atomowych od 40 do 60.
Kwarki górne i kwarki dolne
Kwarki górne u (up) i kwarki dolne d (down) są powiązane w protony oraz neutrony, a te z kolei są składnikami jąder atomowych. Kwarki są tak silnie związane, że dotychczas nie udało się eksperymentatorom "zaobserwować" pojedynczego kwarka.
Oddziaływanie silne, przenoszone przez gluony, wiąże kwarki w protony i neutrony.
Oddziaływania elektromagnetyczne i słabe
Oddziaływania elektromagnetyczne i słabe są przejawami jednego oddziaływania elektrosłabego.
Siły elektromagnetyczne utrzymują elektrony na orbitach atomowych. Są odpowiedzialne również za łączenie się atomów w cząsteczki (molekuły), które są obiektem badań chemii.
Dzięki oddziaływaniom słabym gwiazdy świecą. Pewien rodzaj naturalnego promieniowania (beta) jest również słabym procesem.
Sheldon Glashow, Stephen Weinberg i Abdus Salam otrzymali nagrodę Nobla za stworzenie teorii jednoczącej oddziaływania elektromagnetyczne i słabe. Nagrodą Nobla zostali uhonorowani również Carlo Rubbia i Simon van der Meer za eksperymentalne potwierdzenie w CERN-ie poprawności tej teorii.
Naturalne i sztuczne przemiany jądrowe
Podstawowe znaczenie dla ustalenia współczesnych wyobrażeń o strukturze atomu i budowie jądra miało odkrycie promieniotwóczości przez Becguerela (1896) i wydzielenie pierwszych dwóch naturalnych pierwiastków promieniotwórczych, tj. radu i polonu przez Marię Skłodowską-Curie i Piotra Curie.
Zjawisko promieniotwórczości jest związane z przemianą atomu pierwiastka promieniotwórczego w
atom innego pierwiastka. Atom ten może być albo stabilny albo też nie. W tym drugim przypadku przemienia się on po raz kolejny. Łańcuch takich przemian nazywamy szeregiem promieniotwórczym. Ostatnim pierwiastkiem szeregu promieniotwórczego jest zawsze pierwiastek stabilny - nie podlegający rozpadowi.
Samorzutnemu rozpadowi jąder pierwiastków towarzyszy emisja cząstek (alfa) (są to jądra helu 42He), cząstek beta (elektrony o dużej prędkości) i promieni gamma (fale elektromagnetyczne o długości mniejszej niż 0,1 mm/.
Niestabilne jądro emituje cząsteczkę alfa lub beta zamieniając się w inne jądro. Oznaczmy odpowiednio jako A i Z liczbę masową i liczbę atomową atomu przed rozpadem.
Jądro helu (cząsteczka alfa) składa się z dwóch protonów i dwóch neutronów. Jeżeli więc rozpadający się atom emituje cząsteczkę alfa, to liczba masowa atomu pochodnego wyniesie A-4, a liczba atomowa Z-2. Przemianę tą można zapisać schematycznie:
ZAX→Z-2A-4Y + 24He
Drugim typem przemian są przemiany beta związane z emisją elektronu przez jądro atomowe. Można zapisać to schematycznie:
ZAX→Z+1AY + -10e
W. Pauli stwierdził iż w czasie przemiany beta w jądrze jeden z neutronów zmienia się w proton, elektron i neutrino (dziś zwane antyneutrinem). Neutrino, podobnie jak foton, nie posiada masy. Nie posiada ono również ładunku. Elektron i neutrino opuszczają jądro podczas, gdy proton w nim zostaje.
Niektóre jądra mogą dokonać wychwytu elektronu z najbliższej mu wewnętrznej powłoki elektronowej K. Zachodzi wtedy przemiana protonu w neutron i neutrino.
11p + e -> 10n + v
Zazwyczaj opuszczane miejsce w powłoce K jest zajmowane przez elektron wyższego poziomu energetycznego i przemianie towarzyszy jednocześnie emisja promieni (gamma).
Okres półtrwania
Proces samorzutnego rozpadu jąder pierwiastków radioaktywnych przebiega z szybkością, którego nie umiemy żadnym działaniem fizycznym ani chemicznym zmienić. Dla każdego pierwiastka promieniotwórczego szybkość rozpadu radioaktywnego jest w każdej chwili jedynie proporcjonalna do liczby N obecnych jąder. Jest ona określona równaniem.
- dN/dt = kN gdzie k - stała rozpadu
Jeżeli powyższe równanie przekształcimy do postaci
- dN/N = kdt
i scałkujemy w granicach od No w czasie t=0 do N po czasie t, to otrzymamy
t = 1/k*ln(No/N)
Dla każdego pierwiastka promieniotwórczego charakterystyczny jest tzw. okres półtrwania (t1/2), czyli przedział czasu, w którym pierwotna liczba jąder No maleje do połowy, tj. gdy: N = No/2
Zatem okres półtrwania wynosi:
t1/2 = 1/k * ln(2*No/N) = ln2/k = 0,693/k
Dla naturalnych pierwiastków okres półtrwania zawarty jest między 10-11 sekundy a 1,3 x 1010 lat.
Aktywnością preparatu promieniotwórczego nazywa się liczbę rozpadów jąder w jednostce czasu.
Wcześniej wprowadzoną jednostką aktywności promieniowania jest kiur, symbol Ci. Aktywność 1 Ci ma taki preparat promieniotwórczy, który w ciągu jednej sekundy wykazuje 3,7 x 1010 rozpadów. Odpowiada to w przybliżeniu aktywności 1 g radu.
W układzie SI jednostką aktywności ciała promieniotwórczego jest bekerel (symbol Bg): wykazuje ją preparat promieniotwórczy, w którym jedna samorzutna przemiana jądrowa zachodzi w czasie 1 sekundy, czyli 1 Bg = 1 s-1, natomiast 1Ci = 3,7 x 1010 Bg.
Tradycyjną jednostką dawki pochłoniętego promieniowania (gamma) lub promieniowania rentgenowskiego jest rentgen (symbol R).
Jest to dawka promieniowania, które wytwarza w 1 dm3 suchego powietrza w warunkach normalnych taką liczbę par jonów (dodatnich i ujemnych), która odpowiada jednostce elektrostatycznej ładunku j .ES ).
Bezwzględna wartość ładunku pojedynczego jonu wynosi 1,60 x 10-19 C, co odpowiada 4,80 x 10 -10 j. ES. A zatem, ładunek równy 1 j. ES jest związany z pojawieniem się 1:4,8 x 10-10, czyli 2,08 x 109 par jonów. Ponieważ suche powietrze w warunkach normalnych ma gęstość 0,001293 g/cm-3, więc 1R = 1,6 x 1012 par jonów na 1g powietrza.
Empirycznie wykazano, że wytworzenie jednej pary jonów w powietrzu w warunkach normalnych wymaga dostarczenia energii wynoszącej 5,2 x 10-18 J. Stąd wynika, że 1R = 8,3 x 10-6 J na 1g powietrza.
Inną tradycyjną jednostką dawki pochłoniętego promieniowania przez dowolne środowisko jest rad, który odpowiada 10-2Jkg-1.
Układ SI wprowadził w to miejsce jednostkę o nazwie grej (symbol Gy), która jest dawką promieniowania, przy jakiej energia 1J zostaje przekazana ciału o masie 1kg. A zatem 1 Gy = 1Jkg-1,
natomiast 1 rad = 10-2 Gy.
W celu porównania efektów oddziaływania promieniowania jonizacyjnego na organizm ludzki używa się jednostki o nazwie rem.
Definiuje się ją jako dawkę promieniowania wywołującego taki sam efekt biologiczny w organizmie człowieka jaki powoduje dawka 1R promieni (gamma) lub promieni Roentgena.
Sztuczne przemiany jądrowe.
Jądra izotopów nie promieniotwórczych mogą ulegać przemianom pod działaniem bombardujących je cząstek o dostatecznie dużej energii. Do takich celów stosowane bywają protony 11H, deuterony 21H,
cząsteczki alfa, neutrony, a także promienie gamma, których strumieniowi nadaje się odpowiednią energię w cyklotronie.
Jeżeli cząstka bombardująca trafia w atakowane jądro, to wywołuje reakcję jądrową. Produktem takiej reakcji może być jądro zdolne następnie do samorzutnego rozpadu, tj. jądro izotopu promieniotwórczego. Na przykład bombardowanie jąder nie promieniotwórczego izotopu fosforu 3115P deuteronami 21H wywołuje reakcję:
3115P + 21H -> 3215P + 11H
Produktem tej przemiany jądrowej jest promieniotwórczy izotop fosforu 3215P o okresie półtrwania 14,3 dni oraz proton 11H.
Inne przykłady
147N + 10n -> 146C + 11H
5927Co + 10n -> 6027Co + gamma
Powyższe przykłady mają ogromne znaczenie praktyczne, służą między innymi do produkcji izotopów promieniotwórczych. Znajdują one zastosowanie w wielu gałęziach nauki i techniki.
Rozszczepienie jądra atomowego
Bombardowanie 235U strumieniem elektronów:
10n + 92235U → 92236U●→ 56144Ba + 3689Kr + 301n + Q
Jądro może rozszczepić się także na inne sposoby. Ważne jednak, by po prawej i po lewej stronie równania było tyle samo nukleonów (protonów i neutronów).
Okazało się jednak, że masa jąder pochodnych plus masa emitowanych nukleonów jest mniejsza od masy jądra, które uległo rozszczepieniu 23692U. Jak to możliwe? Co dzieje się z ową zgubioną masą?
Odpowiedź dostarczyło sławne równanie Einsteina wiążące ze sobą energię i masę:
E = mc2
Część masy zostaje po prostu zamieniona w energię. Jak wielkie są to ilości energii. Otóż w momencie rozszczepienia jednego jądra uranu zostaje wydzielone energia około 3*10-17 Joula. Czy jest to dużo czy mało? Nie wydaje się to dużo, jednak jeżeli doprowadzimy do rozszczepienia ogromnej liczby jąder uranu otrzymamy ogromną ilość energii.
Dla porównania jeżeli rozszczepimy jeden kilogram uranu wydzieli się energia około 3,000,000,000 razy większa niż przy spalaniu 1 kilograma węgla!!!
Zasada działania bomby atomowej opiera się na rozszczepianiu uranu.
Bombardując jądro uranu neutronami doprowadza się do jego rozszczepienia z emisją energii i kilku neutronów.
Neutrony te mogą albo uciec z próbki uranu, albo spowodować rozszczepienie kolejnych jąder. Jeżeli mamy za mało uranu, to przeważa pierwszy przypadek. Mówimy wtedy, że mamy masę podkrytyczną.
Przy pewnej ilości uranu zaczyna przeważać ten drugi przypadek. Minimalną masa przy, której zaczyna
rozwijać się jądrowa reakcja łańcuchowa nazywamy masę krytyczną. Powyżej masy krytycznej więcej neutronów powoduje rozpad kolejnych jąder niż ich ucieka z próbki. Reakcja więc rozwija się lawinowo. Na przykład: najpierw jedno rozszczepienie, później dwa, cztery, osiem, szesnaście itd. Każde rozszczepienie wyzwala kolejną dawkę energii.
Neutron wyłapywany przez jądro 23592U powoduje jego rozszczepienie na dwa lżejsze jądra. Rozszczepieniu temu towarzyszy wyzwolenie znacznej energii i wyemitowanie pewnej liczby neutronów. Średnio każdy neutron zaabsorbowany przez jądro uwalnia 2,5 następnych neutronów.
Neutrony te mogłyby być zaabsorbowane przez kolejne jądra uranu i doprowadzić do kolejnego rozszczepienia i emisji nowych neutronów.
Emitowane w czasie rozpadu neutrony są neutronami o dość wysokich energiach i mają zbyt dużą szybkość, aby wystarczająca ich ilość do podtrzymania reakcji jądrowej, została zaabsorbowanych przez jądra uranu.
Zaledwie kilka procent może spowodować kolejne rozszczepienia.
Aby spowolnić produkowane w reakcji rozszczepiania szybkie neutrony stosuje się specjalne substancje nazywane moderatorami.
Szybkie neutrony mogą zderzać się z cząsteczkami moderatora wytracając przy tym część energii - zwalniając. Jednocześnie dobry moderator nie może sam absorbować neutronów. Jako moderatorów w reaktorach jądrowych używa się grafitu, zwykłej wody, ciężkiej wody, berylu.
Spowolnione neutrony mogą teraz powodować rozszczepienie uranu. Jeżeli liczba neutronów, które są tracone bądź absorbowane w innych reakcjach niż rozszczepianie jest większa niż liczba neutronów absorbowanych w reakcji rozszczepienia, wtedy reakcja rozszczepiania nie podtrzymuje się i
ustaje. Reaktor znajduje się w stanie podkrytycznym.
Odwrotnie, w momencie, gdy za każdym kolejnym rozszczepieniem zwiększa się liczba neutronów zdolnych do wywołania kolejnych rozszczepień, to wtedy ilość rozszczepień wzrasta, wzrasta energia wytwarzana przez reaktor. Reaktor jest w stanie nadkrytycznym.
Jeśli utrzymuje się stała liczba rozszczepień (jeden neutron z każdego rozszczepienia wywołuje jedno kolejne rozszczepienie) reaktor jądrowy znajduje się w stanie krytycznym
Aby móc regulować ilość rozszczepień w reaktorze, używa się specjalnego mechanizmu - prętów regulacyjnych. Pręty te mają za zadanie absorbować neutrony. Mogą być one wsuwane do reaktora lub wysuwane z niego.
Zależnie od tego jaka część prętów jest wsunięta, absorbowana jest różna liczba neutronów. Można więc wyłączyć reaktor wsuwając pręty tak, aby osiągnąć stan podkrytyczny lub tak je wysuwając, że osiągnięty zostanie stan nadkrytyczny.
Po osiągnięciu stanu nadkrytycznego czeka się, aż moc reaktora osiągnie pożądaną wielkość. Następnie wsuwa się pręty tak, aby osiągnąć stan równowagi - stan krytyczny. Reaktor pracuje w stanie
krytycznym dając określoną, stałą w czasie energię.
WYKŁAD XII
Efekty cieplne reakcji chemicznych
Pierwsza zasada termodynamiki znana jest także pod nazwą zasady zachowania energii.
Jeżeli przyjmiemy, że masa reagującego układu praktycznie nie ulega zmianie w czasie zachodzących w nim procesów fizycznych i chemicznych to pierwsza zasada termodynamiki mówi nam, że
zmiana energii wewnętrznej układu U będzie wynikiem wymiany energii przez układ na sposób ciepła Q oraz przekazania energii przez układ otoczeniu, bądź dostarczeniu energii do układu z otoczenia na sposób pracy W.
Wiąże to następująca zależność:
∆U = Q + W
gdzie:
delta U - zmiana energii wewnętrznej układu, tj. zmiana całkowitej zawartości energii wszystkich atomów i cząsteczek układu,
Q - energia wymieniona przez układ z otoczeniem na sposób ciepła,
W - energia przekazana przez układ otoczeniu bądź dostarczona do układu z otoczenia na sposób pracy.
Dla przypadku, kiedy proces zachodzi w stałej objętości (przemiana izochoryczna), czyli gdy objętość układu reagującego nie ulega zmianie i nie ma w związku z tym wymiany pracy między układem a otoczeniem (W=0) wtedy:
∆U = Q
Równanie to oznacza, że ciepło przemiany zachodzącej w stałej objętości jest równe zmianie energii wewnętrznej układu.
Jeżeli przez cv oznaczymy ciepło molowe w stałej objętości, czyli ciepło potrzebne do ogrzania 1 mola substancji o 1oK w stałej objętości, to wtedy dla jednego mola otrzymujemy zależność:
U = Cv * ∆T
Jeżeli układ w czasie przemiany zmienia objętość, to wówczas energia wewnętrzna tego układu zmienia się zarówno na skutek wymiany ciepła jak i pracy z otoczeniem.
Gdy zmiana objętości odbywa się izobarycznie, pod stałym ciśnieniem zewnętrznym p, wtedy:
W = -p ∆ T
Dla zmian nieskończenie małych pracę wykonaną można wyrazić równaniem:
W = -v1∫ v2 pdV
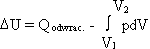
jeżeli ponadto praca objętościowa jest jedynym rodzajem pracy towarzyszącej przemianie, to wtedy równanie pierwszej zasady termodynamiki można zapisać w postaci:
Zgodnie z równaniem stanu gazu doskonałego mamy:
p = (n * R * T)/V
i dalej:
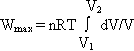
Po scałkowaniu w granicach od V1 do V2 uzyskujemy:
Wmaks = nRT lnV2/V1
Ponieważ zgodnie z prawem Boyle'a w stałej temperaturze p1V1 = p2V2, możemy zapisać:
Wmaks = nRT lnp1/p2
Większość procesów chemicznych przebiega w czasie przemiany chemicznej pod stałym ciśnieniem atmosferycznym. Wtedy równanie wyrażające I zasadę termodynamiki przyjmie prostszą postać:
czyli:
gdzie: Qp - oznacza ilość ciepła wymienioną przez układ z otoczeniem w procesie izobarycznym.
Prawą stronę równania można przedstawić jako różnicę dwóch wyrażeń:
Qp = (U2 + pV2) - (U1 - pV1)
z których pierwsze zależy od stanu końcowego (2) układu reagującego, a drugie od stanu początkowego (1).
Wyrażenie U + pV jest więc funkcją stanu. Funkcję tę nazywamy entalpią (symbol H) lub zawartością cieplną układu:
U + pV = H
Dla stanu początkowego przed przemianą mamy więc:
U1 + pV1 = H1
a dla stanu końcowego:
U2 + pV2 = H2
Zatem równanie możemy napisać w postaci
![]()
Równanie to oznacza, że ciepło reakcji zachodzącej pod stałym ciśnieniem jest równe zmianie entalpii.
Zmiany entalpii zależą od temperatury. Jeżeli przez cp oznaczymy ciepło molowe pod stałym ciśnieniem, czyli ciepła potrzebną do ogrzania 1 mola substancji o 1oK przy p = const, to dla jednego mola otrzymamy:
Bezwzględne wartości entalpii, podobnie jak energii wewnętrznej, nie są mierzalne bezpośrednio.
Termodynamika zresztą zajmuje się jedynie określaniem zmian jakim te wielkości ulegają w toku procesów zachodzących w układzie, odnosząc te zmiany najczęściej względem tzw. stanu standardowego (temperatura 25oC = 298oK, ciśnienie normalne) jako stanu odniesienia. Zakłada się, że molowe entalpie standardowe pierwiastków są równe zeru.
Molowe ciepło tworzenia związku chemicznego jest to ciepło tworzenia 1 mola tego związku z pierwiastków w stanie standardowym.
Na przykład molowe ciepło tworzenia dwutlenku węgla będzie równe:
Cgrafit + O2(gaz) --> CO2(gaz) H298 = - 393,42 kJ/mol
Wartość ta wyraża jednocześnie molowe ciepło spalania węgla w warunkach standardowych.
Prawa termochemiczne.
Pierwsze prawo termochemiczne (prawo Laplace'a):
Molowa entalpia reakcji rozkładu związku chemicznego na pierwiastki jest równa molowej entalpii reakcji tworzenia się tego związku, wziętej ze znakiem przeciwnym.
Innymi słowami wyrażając ogólnie, gdy reakcje przebiegają w obydwu kierunkach, to przy zmianie kierunku wielkości entalpii H liczbowo nie ulegają zmianie, jedynie przyjmują znaki przeciwne. Na przykład reakcja:
COg + H2O(g) --> CO2(g) + H2(g) zmiana entalpi H = -41,59kJ/mol
jest egzotermiczna, natomiast reakcja odwrotna
CO2(g) + H2(g) --> CO(g) + H2O(g) zmiana entalpii = +41,59 kJ/mol
jest endotermiczną: liczbowe wartości efektów cieplnych obydwu reakcji są takie same, a jedynie ich znaki są przeciwne.
Efekty cieplne reakcji obliczamy korzystając z danych zawartych w tablicy. W tym celu od sumy standardowych entalpii produktów reakcji należy odjąć sumę standardowych entalpii substratów
![]()
Drugie prawo termochemiczne (prawo Hessa)
Molowa entalpia przemiany zależy jedynie od stanu początkowego i końcowego reagującego układu, a nie zależy od drogi przemiany.
Z prawa Hessa bezpośrednio wynika, że ciepło dowolnej reakcji Q równa się sumie ciepeł tworzenia substratów (z uwzględnieniem liczby moli n każdego produktu i substratu).
![]()
W warunkach standardowych entalpię reakcji Hr wyraża wzór
Metoda I
NH3(g) + HCl(g) --> NH4Cl(s)
zmiana entalpii H = -176,15 kJ/mol
NH4Cl(s) + H2O -->NH4Cl(aq)
zmiana entalpii H = +16,32 kJ/mol
ogólny efekt cieplny H = -159,83 kJ/mol
Metoda II
NH3(g) + H2O --> NH3(aq)
zmiana entalpii H = -35,15 kJ/mol
HCl(g) + H2O --> HCl(aq)
zmiana entalpii H = -72,38 kj/mol
NH3(aq) + HCl(aq) --> NH4Cl(aq)
![]()
zmiana entalpii H = -52,30 kJ/mol
ogólny efekt cieplny H = -159,83 kJ/mol
Entropia. Entropia, podobnie jak energia wewnętrzna U i entalpia H, jest funkcją stanu, tzn, jej zmiany wyznacza jedynie stan poczatkowy i końcowy układu, a nie zależą one od drogi przemiany.
Wielkość tę wprowadził R.Clausius w 1854 r dla okreslenia kierunku przebiegających przemian.
Zmianę entropii S zdefiniowana jest następującym równaniem:
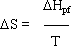
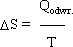
w którym Qodwr. oznacza ilość ciepła wymienioną w procesie odwracalnym zachodzącym w temperaturze T. wartość entropii oraz wartość jej zmian wyraża się w J/mol*K.
Dla procesów izotermiczno-izobarycznych (topnienie, krzepnięcie, parowanie, przemiany alotropowe) entropię wyraża równanie:
gdzie: Hpf oznacza ciepło przemiany fazowej.
Zmiana entropii określa kierunek przemian zachodzących w układzie. Formułuje to druga zasada termodynamiki, której treść jest następująca:
w układzie izolowanym przemianie samorzutnej, tj. nieodwracalnej, towarzyszy wzrost entropii, entropia układu izolowanego dąży do maksimum, aż ustali się równowaga termodynamiczna między wszystkimi składnikami tego układu. W stanie równowagi jakakolwiek przemiana w układzie ma charakter odwracalny, zmiana entropii w tym stanie równa się zeru.
Przykład Rozważmy przykład odwracalnego i nieodwracalnego topnienia lodu, przy czym pierwszy proces prowadzimy w temperaturze 0o, a drugi w temperaturze 100oC. Ilość lodu, którą bedziemy topili wynosi 1g a ciepło topnienia lodu 333,5 J. Zmiana entropii lodu i naczynia w którym topimy lód wyniesie:
Dla temperatury 0oC
zmiana Slodu = + 333,5/273 zmiana Snacz. = - 335,5/273
Lód topiąc się pobrał ciepło od naczynia. Łączna zmiana entropii lodu i zbiornika w tym procesie będzie równa.
zmiana SI = zmiana Slodu + zmiana Snacz. = 335,5/273 - 335/273 = 0
Woda uzyskane ze stopionego lodu zawarta w naczyniu o temp. 0oC, może ponownie ulec zestaleniu oddając 333,5J ciepła do naczynia. Zmiany entropii krzepnącej wody i zmiany entropii naczynia będą wynosiły:
zmiana Swody = - 333,5/273 zmiana Snacz. = + 335,5/273
Łączna zmiana entropii wody i zbiornika będzie określona w następujący sposób:
zmiana SII = zmiana Swody + zmiana Snacz. = -333,5/273 + 333,5/273 = 0
W ostatecznym bilansie całego procesu odwracalnego w układzie izolowanym, zmiana entropii będzie wynosiła zmiana S = zmiana SI + zmiana SII = 0
Dla temperatury 100oC
Zmiana entropii lodu i naczynia będzie wynosiła:
zmiana Slodu = + 333,5/273 zmiana Snacz. = - 335,5/373
Łączna zmiana entropii lodu i zbiornika z wrzącą wodą będzie miała wartość:
zmiana S = zmiana Slodu + zmiana Snacz. = 333,5/273 - 333,5/373 = 0
Naturalnie proces odwrotny, zamarzanie wody w naczyniu o temperaturze 100oC, nie jest możliwy. Woda krzepnąc musiałaby oddać ciepło naczyniu, które ma temperaturę wyższą niż ona sama.
Dla tego przypadku możemy stwierdzić, że w układzie izolowanym przemianie samorzutnej czyli nieodwracalnej towarzyszy wzrost entropii.
Wyszukiwarka
Podobne podstrony:
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia Wykład 6
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Chemia Wyklad 4 id 111675
chemia wykłady (6)
Chemia Wykład 9
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
chemia wykład
(CHEMIA WYKŁAD 7)
chemia wyklady wskrzynka(1), BUDOWNICTWO PŁ, Semestr I, chemia wykład
10.dysocjacja wykład, AGH różne, chemia wykłady
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
chemia wykład 2
3 chemiaogolna wyklad 061009
chemia wykłady (2)
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
więcej podobnych podstron