Ciśnienie osmotyczne
Ciśnienie osmotyczne dla nieelektrolitów określa się wzorem:
π = c ∙ R ∙ T (1)
gdzie: c jest stężeniem molowym, R - stałą gazową, równą 8.314 J/mol K, T - temperaturą w stopniach Kelwina, π - ciśnieniem osmotycznym w atmosferach.
Zadanie 1.
W 1 litrze roztworu znajduje się 9 g glukozy. Obliczyć ciśnienie osmotyczne tego roztworu w temp. 20o C. R = 8.314 J/mol K.
Rozwiązanie
Temperaturę podano w stopniach Celsjusza, dlatego należy ją przeliczyć na kelwiny:
T/K = 20 oC/oC + 273 = 293
T = 293 K
oraz wyliczyć stężenie molowe. Liczba moli n jest równa:
![]()
gdzie: m - masa substancji w gramach, M - masa cząsteczkowa w g/mol. Stąd:
n = 9 g / 180 g/mol = 0.05 moli glukozy
a stężenie molowe:
![]()
Teraz można wyliczyć ciśnienie osmotyczne:
![]()
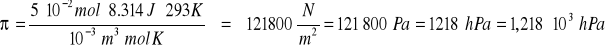
π = 1,218 ∙ 103 hPa
Zadanie 2
Jaka jest masa cząsteczkowa M substancji, jeżeli roztwór zawierający 17.1 g substancji
w 1 litrze roztworu wykazuje w temp. 20o C ciśnienie osmotyczne π = 121 590 Pa.
Rozwiązanie
Dane:
M = 17.1 g
R = 8.314 J/mol K
T/K = 20 oC/oC + 273 = 293 K
π = 121 590 Pa = 121 590 [N/m2]
Przekształcimy równanie (1):
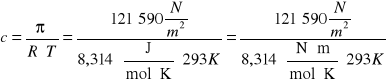
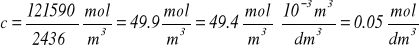
Ponieważ:
![]()
stąd:
n = 0,05 mol/dm3 ∙ dm3 = 0,05 moli
Wiadomo, że:
![]()
stąd ![]()
Taką masę cząsteczkową ma np. sacharoza.
Ciśnienie osmotyczne elektrolitów
Roztwory elektrolitów wykazują wyższe ciśnie osmotyczne niż roztwory nieelektrolitów o tym samym stężeniu. Wynika to z faktu, że roztwory elektrolitów ulegają dysocjacji na jony. W wodnym 0.1 M/l roztworze NaCl znajduje się 0,1 mola jonów Na+ i 0,1 mola jonów Cl-. Razem 0,2 mola jonów. Dlatego wzór na ciśnienie osmotyczne elektrolitów ma postać:
π = i ∙f ∙ c ∙ R ∙ T (2)
gdzie:
i - liczba jonów powstałych w wyniku dysocjacji cząsteczki elektrolitu (dla NaCl = 2, Na2SO4 = 3) i jest współczynnikiem izotonicznym,
f - współczynnik aktywności,
c - stężenie molowe (poprawniej molalne, ale dla prostoty obliczeń będziemy stosować stężenie molowe).
W roztworach rozcieńczonych elektrolitów c < 0,001 mol/l, współczynnik aktywności f dąży do 1,0, dlatego zostanie w równaniu (2) pominięty. Przyjmiemy, że f = 1,0. Jeżeli stężenie jest większe, należy stosować współczynnik aktywności.
Zadanie 3
Proszę wyliczyć ciśnienie 0,03 mol/l roztworu NaCl w temp. 25o C.
Rozwiązanie
Mol NaCl dysocjuje wg równania:
NaCl → Na+ + Cl-
dając 1 mol jonów Na+ i 1 mol jonów Cl-. Podobnie 0,03 molowy roztwór NaCl będzie dysocjować dając 0,03 mola jonów Na+ i 0,03 mola jonów Cl-, razem 0,03 + 0,03 = 0,06 mola. Dlatego dla rozcieńczonego roztworu NaCl współczynnik izotoniczny i = 2.
Dane:
I = 2, f = 1.0
R = 8,314 J/mol K
T/K = 25oC + 273 = 298 K
c = 0,03 mol/dm3
![]()
Zadanie 4
Osocze krwi w temp. 36.6o C wywołuje ciśnienie osmotyczne względem wody równe 7,6 atm. Jakie jest stężenie procentowe roztworu NaCl, który zrównoważy ciśnienie osmotyczne osocza krwi ? Wstępne obliczenia wykazały, że c NaCl > 0,10 mol/l i z tego względu należy przyjąć, że f = 0,9 oraz, że d = 1 g/cm3
Rozwiązanie
Dane:
f = 0,9
π = 770 077 Pa
R = 8,314 J/mol K
I = 2
T/K = 36,6oC + 273 = 309,6 K
Aby wyliczyć stężenie należy przekształcić wzór (2):
π = i ∙f ∙ c ∙ R ∙ T stąd ![]()
.
stąd:
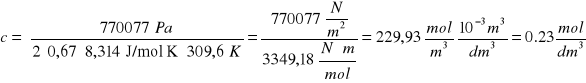
Stężenie molowe c = 0.23 mol/l, a więc w 1 litrze roztworu znajduje się 0.23 mola NaCl. Stąd masa NaCl (c.cz. = 58 g/mol) wynosi:
![]()
stąd m = 0.23 mola ∙ 58 g/mol = 13.34 g NaCl
Ponieważ gęstość, d, roztworu wynosi 1 g/cm3, oznacza to, że:
1000 cm3 = 1000 g
stąd:
![]()
4
Wyszukiwarka
Podobne podstrony:
Rownowaga chem 3, Farmacja, Chemia Fizyczna, zadania
Program wykladow 07 - 08, Farmacja, Chemia Fizyczna, zadania
Ekstrakcja 2, Farmacja, Chemia Fizyczna, zadania
Destylacja, Farmacja, Chemia Fizyczna, zadania
Rownowaga chem 1, Farmacja, Chemia Fizyczna, zadania
Aniony I-III(1), Farmacja, Farmacja, - Chemia Fizyczna
chemia fizyczna zadania
chemia fizyczna zadania
zadania fizyczna ćw. 4, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
laborki 3, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
Zadania sem.2, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Zadania sem.4, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
Termochemia- proste zadania- wydrukowane- wydrukowane, studia, IV semestr, chemia fizyczna
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
Chemia fizyczna ekoła, Obliczyć standardową entalpię tworzenia (stałego) w temperaturze znając efe
zadanie 11, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron