![]()
Nr ćwicz. |
Politechnika Radomska im. Kazimierza Pułaskiego |
Wydział MiTO |
|
Data ćwicz. |
|
|
|
Nazwisko: |
Temat ćwiczenia |
|
|
Zasada Sobiesław |
|
|
|
Numer grupy ćwiczeniowej |
Sprawozdanie oddano dnia |
OCENA |
Prowadzący |
|
|
|
|
I Cel ćwiczenia
Celem ćwiczenia jest doświadczalne wyznaczenie współczynnika podziału kwasu octowego pomiędzy wodę a organiczny rozpuszczalnik (toluen).
II Część teoretyczna
Jeżeli do roztworu dwóch nie mieszających się cieczy wprowadzić substancję, która rozpuszcza się w obydwu warstwach to już po ustaleniu się stanu równowagi stosunek stężeń tej substancji w obydwu ciekłych fazach jest w danej temperaturze wielkością stałą. Własność tę, odkrytą przez Nernsta, nazywamy prawem podziału i opisujemy wzorem:
![]()
Prawo to jest nieźle spełnione gdy nie ulega zmianie wielkość cząsteczek rozdzielanego składnika. W przypadku elektrolitów mocnych, które w roztworze wodnym są całkowicie zdysocjowane, a w rozpuszczalnikach organicznych o niskiej stałej dielektrycznej wykazują przewodnictwo znacznie mniejsze, ,
możemy mieć do czynienia ze zjawiskiem asocjacji. Asocjacji na tzw. pary lub dwójki, czyli łączeniu w pary jonowe, sprzyjają także niewielkie rozmiary jonów i duża ich wartościowość. W przypadku dużej asocjacji substancji prawo podziału Nernsta przyjmuje postać:
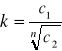
gdzie: n- liczba cząsteczek substancji asocjujących w rozpuszczalniku 2.
Wzór ten ma zastosowanie w przypadku substancji, która w rozpuszczalniku 1 ulega bardzo nieznacznej dysocjacji. W przypadku dużego stopnia dysocjacji wzór na współczynnik podziału przyjmuje postać:
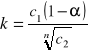
gdzie: α - stopień dysocjacji substancji w rozpuszczalniku 1
n - liczba cząsteczek --> [Author:MŁ] substancji asocjujących w rozpuszczalniku 2
Podział trzeciego składnika między dwie fazy ciekłe znajduje ważne zastosowanie praktyczne w procesie ekstrakcji. Bardzo często stosuje się ją do usuwania rozpuszczonych w wodzie substancji organicznych, źle mieszających się z wodą. Jeżeli przez n oznaczymy liczbę moli substancji zawartej w objętości v rozpuszczalnika 1, którą ekstrahuje się kolejno porcjami o objętości z rozpuszczalnika 2, rozpuszczającego substancję x znacznie lepiej od rozpuszczalnika 1, to po pierwszej ekstrakcji w rozpuszczalniku 1 pozostanie n1 moli substancji x. Stosując prawo podziału można zapisać:
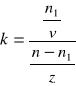
![]()
Natomiast po i-tej ekstrakcji będziemy mieć:
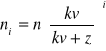
moli substancji x w rozpuszczalniku 1.
III Wykonanie ćwiczenia
Etap 1)
Z każdego z roztworów kwasu octowego 0,5 molowego i 0,25 molowego pobieram próbki po 2 cm3 i przelewam do dwóch kolbek stożkowych. Rozcieńczam je następnie wodą destylowaną do ok. 20 cm3. do każdej z próbek dodaję kilka kropel fenoloftaleiny i miareczkuję 0,1 molowym roztworem wodorotlenku sodu dla oznaczenia całkowitej początkowej ilości kwasu (c0, wyrażonej w cm3 0,1 M NaOH).
Etap 2)
Do dwóch rozdzielaczy wlewam po 20 cm3roztworu: do I - 0,5 M CH3COOH, do II - 0,25 M CH3COOH. Następnie do każdego rozdzielacza dolewam po 20 cm3 toluenu. Po zamkięciu rozdzielaczy korkami wstrząsam nimi przez kilka minut, a następnie pozostawiam je na ok. 20 min do rozdzielenia i wyklarowania się faz.
Etap 3)
Po tym czasie pobieram próbki po 2 cm3 z dolnych (wodnych) faz z rozdzielaczy i postępuję podobnie jak w etapie pierwszym tzn. umieszczam te próbki w dwóch kolbach stożkowych, rozcieńczam wodą destylowaną do ok. 20 cm3 i miareczkuję 0,1 M NaOH wobec fenoloftaleiny oznaczając stężenie kwasu octowego w fazie wodnej (c1, wyrażone w cm3 0,1 M NaOH ).
IV Wyniki
Reakcja zobojętniania kwasu octowego wodorotlenkiem sodu przebiega następująco:
CH3COOH + NaOH CH3COONa + H2O
Etap 1)
Do zobojętnienia 20 cm3 rozcieńczonego roztworu 0,5 M kwasu octowego zużyłem 12,5 cm3 NaOH (0,1 M).
Do zobojętnienia 20 cm3 rozcieńczonego roztworu 0,25 M kwasu octowego zużyłem 6,25 cm3 0,1 M roztworu NaOH
Etap 3)
Po ekstrakcji kwasu octowego toluenem stężenia CH3COOH wyrażone w cm3 NaOH wynoszą odpowiednio:
Do zobojętnienia 20 cm3 roztworu kwasu octowego z dolnej fazy 0,5 M CH3COOH zużyłem 11,5 cm3 NaOH.
Do zobojętnienia 20 cm3 roztworu kwasu octowego z dolnej fazy 0,25 M CH3COOH zużyłem 6 cm3 NaOH.
Obliczam stężenia kwasu octowego w fazie toluenowej z różnicy całkowitej początkowej ilości kwasu oraz ilości tego kwasu zawartej w fazie wodnej:
C2=C0-C1
Dla roztworu 0,5 M kwasu wynosi ono:
C2=(12,5-11,5)cm3=1cm3 0,1M NaOH
Dla roztworu 0,25 M kwasu wynosi ono:
C2=(6,25-6)cm3=0,25cm3 0,1M NaOH
Aby sprawdzić czy prawo podziału ma zastosowanie w podanym doświadczeniu rysuję tabelę i wpisuję otrzymane wyniki
Nr. Kolbki |
Ilość cm3 0,1M NaOH |
|
log c 1 |
log c 2 |
||
|
c 0 |
c 1 |
c 2 |
|
|
|
1 |
12,5 |
11,5 |
1 |
11,5 |
1,06 |
0 |
2 |
6,25 |
6 |
0,25 |
24 |
0,78 |
-0,6 |
Jak wynika z tabeli współczynniki podziału różnią się znacznie od siebie, a więc prawo podziału nie ma tu zastosowania. Należy zatem wartość k wyznaczyć graficznie z równania dla cząsteczek asocjujących (niewielką dysocjację kwasu octowego w wodzie pomijamy).
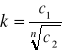
![]()
![]()
Jak wynika z rysunku zależności logc1=f(logc2) wartość k jest równa rzędnej punktu przecięcia prostej z osią rzędnych, a tangens nachylenia prostej do osi odciętych = 1/n.
Szukasz gotowej pracy ?
To pewna droga do poważnych kłopotów.
Plagiat jest przestępstwem !
Nie ryzykuj ! Nie warto !
Powierz swoje sprawy profesjonalistom.