Opracowanie wyników pomiarów Michał Michalak
1. Obliczam stężenie roztworów kwasu octowego przed podziałem ci i po podziale ciα w warstwie wodnej korzystając ze wzoru:
![]()
gdzie:
ck - stężenie roztworu kwasu octowego
cz - stężenie NaOH
Vk - objętość kwasu octowego wzięta do miareczkowania
Vz - objętość roztworu NaOH zużyta na zmiareczkowanie kwasu octowego.
Obliczenia podaję dla stężenia kwasu octowego 0,3 mol/dm3. Pozostałe wyniki obliczeń umieściłem w tabeli poniżej
- przed podziałem
![]()
- po podziale
![]()
2. Obliczam stężenie kwasu octowego w warstwie chloroformowej ciβ:
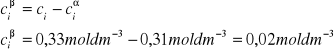
3. Obliczam stopień dysocjacji kwasu octowego w warstwie wodnej dla poszczególnych stężeń, korzystając z równania:
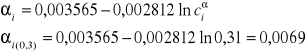
gdzie:
αi - stopień dysocjacji
ciα - stężenie kwasu octowego w wodzie
4. Korzystając z równania ![]()
sporządzam wykres zależności liniowej ![]()
.
5. Wyznaczam współczynnik podziału Kc i stałą n wykorzystując powyższe równanie i wykres naszkicowany na jego podstawie:
- metodą graficzną
Współczynnik podziału Kc jest równy: ![]()
, gdzie lgKc odczytuję z wykresu. Jest to wartość liczbowa przecięcia prostej z osią y. wartość lgKc jaką odczytałem z wykresu wynosi: 0,796.
![]()
Stała n powiązana jest ze współczynnikiem nachylenia prostej i równa jej odwrotności.
![]()
![]()
- metodą najmniejszych kwadratów
Równanie linii prostej wyznaczam przy pomocy funkcji REGLINP w edytorze Microsoft Excel. Równanie, które otrzymałem ma postać: y = 0,7506x + 0,7917. Współczynnik podziału Kc jest równy: ![]()
, gdzie lgKc wyrazowi wolnemu równania, czyli lgKc = 0,7917.
![]()
Stała n powiązana jest ze współczynnikiem nachylenia prostej i równa jej odwrotności.
![]()
![]()
Tabela wyników obliczeń:
ci [mol dm-3] |
ciα [mol dm-3] |
ciβ [mol dm-3] |
αi |
ciα(1-αi) [mol dm-3] |
lg[ciα(1-αi)] |
lgciβ |
0,33 |
0,31 |
0,02 |
0,0069 |
0,304 |
-0,5173 |
-1,6990 |
0,55 |
0,52 |
0,03 |
0,0054 |
0,515 |
-0,2884 |
-1,4881 |
0,65 |
0,60 |
0,05 |
0,0050 |
0,599 |
-0,2222 |
-1,3010 |
0,76 |
0,71 |
0,05 |
0,0045 |
0,707 |
-0,1507 |
-1,3310 |
0,86 |
0,80 |
0,07 |
0,0042 |
0,793 |
-0,1006 |
-1,1761 |
1,13 |
1,03 |
0,10 |
0,0035 |
1,026 |
0,0113 |
-1,0223 |
Współczynnik podzaiłu Kc i stała n |
Kc |
1/n |
n |
|||
Metoda graficzna |
6,252 |
0,751 |
1,332 |
|||
Metoda najmniejszych kwadratów |
6,190 |
0,751 |
1,332 |
|||
Celem ćwiczenia było wyznaczenie współczynnika podziału kwasu octowego pomiędzy wodę i chloroform Kc oraz stałej n.
Do sprawozdania dołączyłem wykres wykonany na papierze milimetrowym.
Po wykonaniu ćwiczenia stwierdzam, że współczynnik podziału wynosi w metodzie graficznej 6,252, a najmniejszych kwadratów 6,190. Wartości te zbliżone są do siebie, a wręcz są prawie identyczne. Wiedząc, że wyrażenie na współczynnik podziału wynosi: 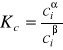
(gdzie: ciα, ciβ - stężenie kwasu octowego w warstwie wodnej i chloroformowej po podziale) stwierdzam iż woda dużo lepiej rozpuszcza kwas octowy niż chloroform podczas rozdzielania kwasu pomiędzy te dwie ciecze. Stwierdzam także, że kwas octowy występuje w warstwie organicznej pod postacią cząsteczek asocjowanych, gdyż n>1 (n = 1,332).
2
Wyszukiwarka
Podobne podstrony:
29 Wyznaczanie współczynnika podziału Nernsta metodą potenc
29 Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną
29 Wyznaczanie współczynnika rozszerzalności cieplnej metodą elektryczną
29 Wyznaczanie współczynnika rozszerzalności cieplnej metodą elektryczną
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta2
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta1
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
,Laboratorium podstaw fizyki, WYZNACZANIE WSPÓŁCZYNNIKA ROZSZERZALNOŚCI LINIOWEJ METODĄ
Wyznaczanie współczynnika lepkości cieczy metodą Ostwalda, Fizyka
cw3 wyznaczanie współczynnika tarcia czopowego metodą drgań samowzbudnych
Wyznaczanie współczynnika załamania światła metodą najmniejszego odchylenia w pryzmacie sprawkox
OI04 Wyznaczanie wspolczynnika lepkosci cieczy metoda Stokesa
Wyznaczanie współczynnika rozszerzalności liniowej metodą elektryczną 1 (2)
Współczynnik załamania szkła, Ć 73B moje, Wyznacznie współczynnika załamania szkła metodą kąta najmn
301 Wyznaczanie współczynnika załamania światła metodą najmniejszego odchylenia w pryzmacie
Wyznaczanie współczynnika lepkości dynamicznej metodą Stokes'a v2, I Pracownia Zak˙adu Fizyki PL
Współczynnik załamania szkła, ĆW 73, WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA SZKŁA METODĄ KĄTA NAJMNIEJS
Wyznaczanie współczynnika lepkości dynamicznej metodą Stokes'a v2, I Pracownia Zak˙adu Fizyki PL
więcej podobnych podstron