Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE 15
EKSCES OBJĘTOŚCI MOLOWEJ W UKŁADZIE WODA - METANOL
Wyposażenie ćwiczenia
Aparatura i urządzenia :
waga analityczna
suszarka
ultratermostat
2 piknometry
2 pipety o poj. 25 ml
Odczynniki :
roztwory metanol - woda o zawartości metanolu :
0.2, 0.4, 0.6 i 0.8 ułamka molowego
aceton cz. (do przemywania piknometrów)
Ćwiczenie wykonali :
Jacek Cebulski
Bartłomiej Biba
Inż.Ch. rok II gr. I
Wstęp :
Roztwory rzeczywiste, we wszystkich stanach skupienia, nie spełniają równań słusznych dla układów rzeczywistych. aby tę trudność usunąć, wprowadza się pojęcie aktywności zaproponowane przez Lewisa i Randalla.
Aktywność pewnej substancji, w określonych warunkach, będzie to liczba, która podstawiona do dowolnego równania stanu doskonałego, zamiast wartości liczbowej jakiejś, dającej się zmierzyć własności danej substancji, spełni wraz z pozostałymi parametrami to równanie.
Jedną z najważniejszych funkcji w termodynamice chemicznej jest entalpia swobodna (potencjał termodynamiczny).
Potencjał chemiczny roztworu doskonałego wyraża się wzorem :
μdi = μ0i (T,p) + RTlnxi
gdzie : μdi - potencjał chemiczny składnika i w roztworze doskonałym
μ0i - potencjał standardowy ( potencjał chemiczny czystego składnika i)
xi - ułamek molowy
R - stała gazowa
T - temperatura bezwzględna
Równanie to można przystosować do mieszanin rzeczywistych wprowadzając zamiast xi aktywność składnika - ai, nazywaną aktywnością ułamkową lub aktywnością wyprowadzoną z ułamka molowego.
μi = μ0i (T,p) + Rtlnai
Równanie to definiuje aktywność :
lnai = μi - μ0i (T,p) / RT
Aktywność jest wielkością bezwymiarowa, jest ona funkcją temperatury, ciśnienia i składu roztworu.
Wygodnie jest wprowadzić współczynnik aktywności γ zdefiniowany równaniem :
γi = ai / xi
Związek współczynnika aktywności z potencjałem chemicznym w roztworze rzeczywistym μi i doskonałym μdi jest następujący :
RTlnγi = μi - μid
Funkcje termodynamiczne dla całego roztworu możemy uzyskać z ogólnej zależności :
z = Σ ni Zi
gdzie z - jest jedną z funkcji ekstensywnych
Funkcje mieszania dla roztworu definiujemy ogólnym równaniem :
zm = z - Σ ni Zio T,p = const.
Oprócz termodynamicznych funkcji mieszania opisujących własności roztworów ciekłych, wyróżniamy dużą grupę funkcji termodynamicznych, które nazywamy funkcjami nadmiaru (ekscesu).
Nadmiar danej funkcji z oznaczamy jako zE i określamy następująco :
zE = zm - zm,d
gdzie : zm - termodynamiczna funkcja mieszania danego roztworu
zm,d - funkcja mieszania tego roztworu traktowanego jako roztwór doskonały
Jeżeli roztwór jest doskonały, wtedy :
zE = 0
Jak więc widać, funkcje nadmiaru charakteryzują odchylenia danego roztworu od roztworu doskonałego. Możemy je stosować zarówno do roztworów doskonałych rozcieńczonych jak i do roztworów doskonałych stężonych.
Funkcja nadmiaru objętości w odniesieniu do roztworów doskonałych w całym zakresie stężeń dla jednego mola roztworu jest równa :
VE = V - Vd
Cel ćwiczenia :
Wyznaczenie ekscesu objętości molowej z pomiarów gęstości roztworów wodnych metanolu.
Wyniki pomiarów:
Ułamek molowy CH3OH w roztworze x2 |
Masa piknometru z roztworem |
|
|
pom. I |
pom. II |
_ |
g |
|
0,0 |
32.6781 |
32.2424 |
0,2 |
32.0504 |
31.6843 |
0,4 |
31.6862 |
31.2854 |
0,5 |
31.2941 |
30.8811 |
0,6 |
31.1595 |
30.7824 |
0,8 |
30.6350 |
30.2463 |
m0- |
20.9064 |
20.5185 |
mw1=32,6781g mw2=32,2424g
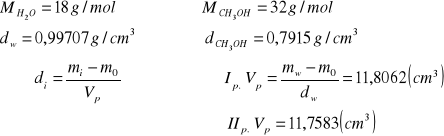
Ip. d`0,0 = 0,9970(g/cm3)
IIp. d`0,0 = 0,9970(g/cm3)
Ip. d`0,2 = 0,9439(g/cm3)
IIp. d`0,2 = 0,9496(g/cm3)
Ip. d`0,4 = 0,9130(g/cm3)
IIp. d`0,4 = 0,9156(g/cm3)
Ip. d`0,5 = 0,8798(g/cm3)
IIp. d`0,5 = 0,8813(g/cm3)
Ip. d`0,6 =0,8684(g/cm3)
IIp. d`0,6 = 0,8729(g/cm3)
Ip. d`0,8 = 0,8240(g/cm3)
IIp. d`0,8 = 0,8273(g/cm3)
Gęstość ta obarczona jest błędem systematycznym wynikającym z nieuwzględnienia wyporu powietrza . Należy ją przeliczyć według wzoru:
di = d`i+0,0012(1 - d`i/dw)
Objętości molowe obliczmy :
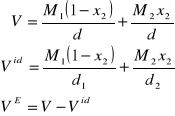
Obliczenia :
Ułamek molowy CH3OH w roztworze xmet |
Gęstość roztworu di [g/cm3]
|
Gęstość roztworu średnia droz [g/cm3] |
Objętość molowa roztworu V [cm3/mol] |
Objętość molowa roztworu doskonałego Vd [cm3/mol] |
Eksces objętości molowej VE [cm3/mol] |
|
|
pom. 1 |
pom. 2 |
|
|
|
|
0,2
0,4
0,5
0,6
0,8 |
0,9439
0,9130
0,8798
0,8729
0,8240 |
0,9496 0,9156 0,8813 0,8729 0,8273
|
0,9467
0,9143
0,8805
0,8729
0,8256 |
21,9710
25,8120
28,3929
30,2440
35,3682 |
22,5312
27,0096
29,2488
31,4880
35.9664 |
-0,5602
-1,1976
-0,8559
-1,2440
-0.5982
|
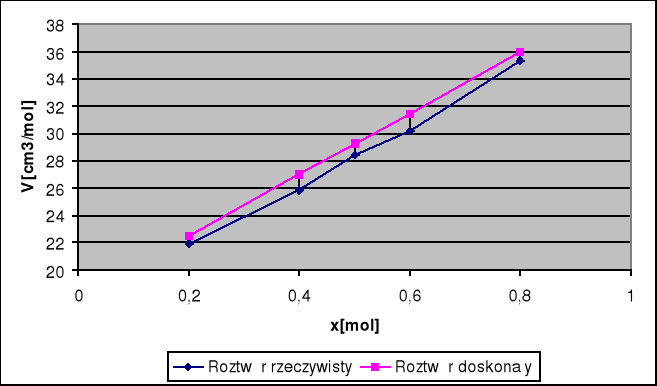
Wykres V=f(x) obrazujący odchylenie od roztworu doskonałego w układzie woda-metanol:
M1=18 mol/cm3
M2=32 mol/cm3
d1 =0,99707 g/cm3
d2 =0,7912 g/cm3
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE nr 15, Studia, Politechnika
SPRAWOZDANIE nr 21, Studia, Politechnika
SPRAWOZDANIE nr 18(2), Studia, Politechnika
SPRAWOZDANIE nr 26, Studia, Politechnika
SPRAWOZDANIE nr 18(1), Studia, Politechnika
SPRAWOZDANIE nr 23(1), Studia, Politechnika
SPRAWOZDANIE nr 10, Studia, Politechnika
Sprawozdanie nr 24, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, sprawozdania fiza
Sprawozdanie nr 71, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, sprawozdania fiza
Sprawozdanie nr 27, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, sprawozdania fiza
sprawozdanie nr 2 leb, Studia budownictwo pollub, sem IV
Sprawozdanie nr 3 - zaprawa, Studia Budownictwo polsl, II semestr, Materiały budowlane, Sprawko 7
Sprawozdanie nr 1 - NoM, Studia materiały, NoM
Chemia fizyczn - nr 10, Studia, Politechnika
więcej podobnych podstron