Wyniki pomiarów:
Lp. |
U [V] |
T1 [˚C] [K] |
T2 [˚C][K] |
VW [cm3] |
VT [cm3] |
1. |
150 |
90,9 [364,05] |
86,0 [359,15] |
16 |
84 |
2. |
170 |
94,5 [367,65] |
87,0 [360,15] |
15 |
85 |
Wartości konieczne do obliczeń:
gęstość wody δW=1000 [kg/m3]
ciśnienie zewnętrzne p= Pc= 101325 [Pa]
gęstość toluenu δA=873 [kg/m3]
przyspieszenie ziemskie g = 9,81 [m/s2]
stała gazowa R = 8314 [J/kmol*K]
średnica dyszy d0= 0,0015 [m]
liczba dysz n = 5
średnica aparatu D = 0,125 [m]
wysokość słupa cieczy nad bełkotką h = 0,062 [m]
masa cząsteczkowa toluenu MA= 92,13 [kg/kmol]
masa cząsteczkowa pary wodnej MW= 18 [kg/kmol]
Tabela zależności T do P:
|
T [۫C] |
T [K] |
P [mmHg] |
P [Pa] |
a |
90 |
363,15 |
407,38 |
54311,90 |
b |
95 |
368,15 |
478,63 |
63657,79 |
c |
100 |
373,15 |
562,34 |
74791,22 |
Obliczenia:
1. Obliczenie δpw- gęstości pary wodnej w kolbie destylacyjnej:
![]()
2. Obliczenie f- pola powierzchni przekroju dyszy:
![]()
3. Obliczenie mA- masa toluenu i mW- masa pary wodnej:
![]()
![]()
4. Obliczenie w- prędkości wypływu pary z dyszy bełkotki:
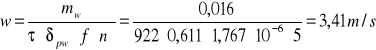
5. Obliczenie A- pola powierzchni przekroju aparatu:
![]()
6. Obliczenie Fr- liczby Frouda:
![]()
7. Obliczenie PA- prężności pary nasyconej toluenu w temp. destylacji z tabeli
Obliczenie PA- prężności pary nasyconej toluenu w temp. destylacji z tabeli (interpolacja) i przeliczenie [mmHg na Pa]:
(Tb-Ta) - (Pb-Pa) => PA= [{(T2-T1)* (Pb-Pa)}/ (Tb-Ta)] + Pa
(T3-Ta) - (PA-Pa)
PA= [{(359,15-364,05)*(74791,22-54311,90)}/(373,15-363,15)]+54311,90= 44277
8. Obliczenie Pw- prężność pary nasyconej wody w temp. destylacji: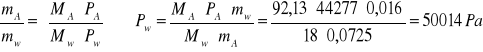
9. Obliczenie liczby C- liczby C:
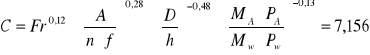
10. Obliczenie Eteor.- obliczeniowego stopnia nasycenia:
a) przepływ pojedynczy dla C>0,84
Eteor=1 ;
b) przepływ pianowy dla 0,84>c>0,735
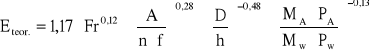
c) przepływ strumieniowy dla C<0,735
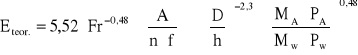
11. Obliczenie yA- ułamka molowego toluenu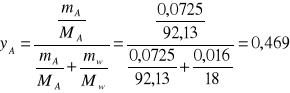
12. Obliczenie pA- prężności cząstkowej toluenu w fazie gazowej:![]()
13. Obliczenie Edosw- doświadczalnego stopienia nasycenia:
![]()
Nr pomiaru |
T2 [K] |
T1 [K] |
VH2O [m3] |
VA [m3] |
τ [s] |
mw |
mA |
yA |
pA |
PA |
Edosw |
1 |
359.15 |
364,05 |
0.000016 |
0.000084 |
922 |
0.016 |
0.0725 |
0.469 |
47521 |
44277 |
0.998 |
2 |
360,15 |
367,65 |
0.000015 |
0.000085 |
542 |
0.015 |
0.0742 |
0.491 |
49750 |
69671 |
0,714 |
3 |
362.15 |
369.15 |
0.000018 |
0.000082 |
377 |
0.018 |
0.0716 |
0.437 |
44279 |
77993 |
0,568 |
Nr pomiaru |
δpw |
w |
f |
A |
Fr |
C |
Pw |
|
Eteor. |
|
1 |
0.611 |
3,41 |
0.000001767 |
0.01227 |
9,48 |
1,31 |
50014 |
|
1 |
|
2 |
0.609 |
5,83 |
0.000001767 |
0.01227 |
27,72 |
1,50 |
78698 |
|
1 |
|
3 |
0.606 |
8,42 |
0.000001767 |
0.01227 |
57,82 |
1,63 |
88098 |
|
1 |
|
Wnioski:
Obserwując wyniki pomiarów można zauważyć, iż wraz ze wzrostem mocy dostarczanej do układu (wzrostem napięcia na grzałce) maleje czas odbierania 100 ml cieczy. Zawartość wody w stosunku do toluenu zmienia się nieznacznie, wzrastając lekko przy spadku dostarczanej mocy.
Wartości współczynników nasycenia pary wodnej toluenem wyznaczone doświadczalnie są bardzo podobne, wynoszą w przybliżeniu 1. Można zauważyć, że dla największej prędkości wypływu pary wodnej stopień nasycenia wyznaczony doświadczalnie jest największy, więc można przypuszczać, że wraz ze wzrostem prędkości rośnie Edośw. Niewielkie odchyłki wartości rzeczywistych od teoretycznych mogą wynikać z niewielkiej skali prowadzenia procesu, co zwiększa jego podatność na czynniki zewnętrzne. Dodatkowo wpływ mogą mieć niektóre założenia i uproszczenia jak np. p=101325Pa. Niemniej jednak obliczony teoretyczny współczynnik nasycenia dobrze przybliża wartość rzeczywistą, zatem można go z powodzeniem stosować. Wszelkie błędy wynikają z błędnych odczytów podczas prowadzenia procesu, bądź też wadliwej aparatury.
Wyszukiwarka
Podobne podstrony:
Destylacja z parą wodną, Studia, Inżynieria Chemiczna
prędkości płynu, Studia, inżynieria chemiczna sprawozdania, wyznaczanie profilu prędkości płynu w ru
Destylacja z parą wodną(1), Studia, Inżynieria Chemiczna
Wyznaczanie profilu prdkoci płynu w rurociągu o przekroju kołowym, Studia, inżynieria chemiczna spra
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
Zagadnienia do kolokwium zaliczeniowego 2014, studia PWr, wprowadzenie do inżynierii chemicznej
Przykładowy egzamin po I sem, MATERIAŁY NA STUDIA, INŻYNIERIA PROCESOWA, LABOLATORIUM INŻYNIERIA PRO
Laboratorium 2 i 3 Reakcje chemiczne, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna
Dokument, MATERIAŁY NA STUDIA, INŻYNIERIA PROCESOWA, LABOLATORIUM INŻYNIERIA PROCESOWA, do wydruku i
pyt egz calosc moje, Studia Inżynierskie - Geodezja AGH, Teledetekcja i fotogrametria, Wykłady
InzynieriaEkologiczna.x(1), Moje, Studia, Inżynieria Ekologiczna
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
inzynieria chemicza 1 17
Zagadnienia do kolokwium zaliczeniowego 2013-2014, Inżynieria materiałowa pwr, Inżynieria chemiczna
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
spektrofotomeria - sprawozdanie, studia, studia I rok, chemiczna analiza instrumentalna, spr
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
więcej podobnych podstron