Nr i tytuł ćwiczenia:
Ćwiczenie 1-1. Wyznaczanie ciepła rozpuszczania
|
|||||
Imię i nazwisko osoby prowadzącej ćwiczenia:
Bożena Parczewska Plesnar |
|||||
Data wykonania ćwiczenia |
Godz. |
Nr grupy studenckiej
|
Zespół
|
Nazwiska osób wykonujących ćw.
|
Pkt za spr |
19.03.2013 |
11-14 |
1 |
b |
Elżbieta Bernaś
Dorota Biernat |
|
Uwagi prowadzącego: |
|
||||
1.Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z metodą wyznaczania ciepła rozpuszczania substancji stałych(kwasu benzoesowego) z pomiarów ich rozpuszczalności w różnych temperaturach.
2.Wstęp teoretyczny:
Ciepło rozpuszczania- jest to efekt energetyczny towarzyszący procesowi rozpuszczania. Rozpuszczanie różni się od reakcji chemicznej tym, że w odróżnieniu do reakcji chemicznej ilość substancji biorących udział w procesie rozpuszczania nie musi spełniać ściśle określonych stosunków masowych. Efekt energetyczny towarzyszący procesowi rozpuszczania zależy nie tylko od rodzaju substancji rozpuszczanej i rozpuszczalnika, ale także od tego czy dana substancja jest wprowadzana do czystego roztworu bądź do roztworu o określonym stężeniu oraz ponadto od wartości początkowego i końcowego stężenia roztworu. Tak więc rozróżnia się kilka rodzajów ciepła rozpuszczania, a mianowicie:
molowe ciepło rozpuszczania - efekt energetyczny związany z rozpuszczaniem jednego mola danej substancji w określonej liczbie moli czystego rozpuszczalnika
pierwsze ciepło rozpuszczania - efekt energetyczny związany z rozpuszczeniem jednego mola danej substancji w bardzo dużej ilości rozpuszczalnika, gdy liczba moli rozpuszczalnika dąży do nieskończoności
pełne ciepło rozpuszczania - efekty energetyczny związany z rozpuszczeniem jednego mola danej substancji w takiej ilości rozpuszczalnika że powstaje roztwór nasycony(o ile taki może się utworzyć).
cząstkowe ciepło rozpuszczania - efekt energetyczny związany z rozpuszczaniem jednego mola danej substancji w bardzo dużej ilości roztworu o określonym stężeniu tej substancji w tym roztworze.
ostatnie ciepło rozpuszczania - efekt energetyczny związany z rozpuszczaniem jednego mola danej substancji w bardzo dużej ilości praktycznie nasyconego roztworu względem tej substancji.
Warto dodać, że w tablicach najczęściej podawane są wartości pierwszego ciepła rozpuszczania.
Wartość ciepła rozpuszczania pod stałym ciśnieniem (entalpię rozpuszczania ΔHr) można wyznaczyć w bezpośrednich pomiarach kalorymetrycznych lub obliczyć z równania izobary van't Hoffa na podstawie danych o rozpuszczalności substancji w danym rozpuszczalniku w różnych temperaturach.
Rozpuszczalność (Rs) to stosunek masy substancji rozpuszczonej do masy rozpuszczalnika:
Najczęściej podawana jest rozpuszczalność substancji w 100g rozpuszczalnika, a więc obliczana z zależności:
![]()
Oznacznenia:
ms - to masa substancji rozpuszczonej
mr - to masa rozpuszczalnika
Eksperymentalnie rozpuszczalność wyznacza się, wprowadzając do rozpuszczalnika nadmiar substancji rozpuszczanej i wytrząsając lub mieszając roztwór w stałej temperaturze doprowadzając go w ten sposób do stanu równowagi. Następnie po odsączeniu osadu określa się jedną z metod analitycznych stężenie substancji w roztworze nasyconym.
Stałą równowagi (K) procesu oblicza:
(AB)s↔(AB)c
Oznaczenia:
(AB)s - to substancja rozpuszczana występująca w fazie stałej
(AB)c - to substancja rozpuszczana występująca w roztworze nasyconym,
Z danej zależności:
![]()
Ze względu na to że w powyższym wyrażeniu wielkość [AB]s ma stałą wartość, zależną jedynie od powierzchni fazy stałej która praktycznie jest stała, więc stałą równowagi (K) oblicza się z danego rówania
K=[AB]c
Gdzie [AB]c jest równa rozpuszczalności badanej substancji, czyli Rs
Wpływ temperatury na tę równowagę opisuje równanie izobary van't Hoffa:
![]()
![]()
Oznaczenia:
K - stała równowagi, równa rozpuszczalności (Rs) w temperaturze T
ΔH - entalpia rozpuszczania, czyli efekt energetyczny związany z procesem rozpuszczania substancji w danej temperaturze i pod stałym ciśnieniem (prowadzący do otrzymania roztworu nasyconego).
Całkując równanie ![]()
2 w przedziale temperatur T1-T2 - przy założeniu, że ΔH nie zmienia się w tym zakresie temperatury, otrzymuje się wyrażenie na entalpię rozpuszczania:
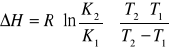
Oznaczenia:
K2 i K1 - rozpuszczalność substancji odpowiednio w temperaturze T2 i T1
R - stała gazowa równa 8,313 J∙mol-1∙K-1
3. Wykonanie ćwiczenia
Na wadze technicznej odważamy mniej więcej po 2 g kwasu benzoesowego i przenosimy go do 4 ponumerowanych kolb stożkowych z korkiem na szlif o pojemności 100 cm3. Do każdej kolby dodajemy po 80 cm3 wody destylowanej, która została odmierzona cylindrem oraz podgrzana do temperatury około 60°C. Dwie kolby wkładamy do wytrząsarki na około 30 minut, a pozostałe wytrząsamy ręcznie i wkładamy do łaźni parowej o temperaturze 40°C. Ważymy na wadze technicznej 4 puste kolby stożkowe o pojemności 250 cm3. Następnie bez wyjmowania kolb z termostatów pobiera się kolejno, pipetą o objętości 25 cm3 (z nasuniętym na jej koniec wężykiem gumowym, zawierającym zatyczkę z waty w charakterze sączka) i 50 cm3 z kolb wytrząsanych na wytrząsarce, nasycony roztwór badanej substancji. Pobrane roztwory przenosi się do zważonych kolb stożkowych. Kolby wraz z roztworem ważymy się na wadze analitycznej. Zważając na to, ze mamy do czynienia z kwasem benzoesowym, przeprowadzamy miareczkowanie mianowanym roztworem NaOH wobec fenoloftaleiny.
4.Opracowanie wyników
obliczanie Δm z różnicy mas kolby z nasyconym roztworem kwasu benzoesowego i kolby pustej
Nr. kolby |
Masa pustej kolby stożkowej[g] |
Masa kolby z roztworem [g] |
Δm [g] |
1 |
133,18 |
183,90 |
50,72 |
3 |
109,02 |
133,98 |
24,96 |
4 |
128,64 |
153,63 |
24,99 |
obliczanie gęstości roztworów stosując wzór
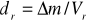
,
gdzie: Vr - objętość kwasu przed miareczkowaniem
Nr. kolby |
Δm [g] |
Vr [cm3] |
dr [g/cm3] |
1 |
50,72 |
50 |
1,0144 |
3 |
24,96 |
25 |
0,9984 |
4 |
24,99 |
25 |
0,9996 |
obliczanie stężenia molowego kwasu benzoesowego ze wzoru:
![]()
gdzie Vkwasu - objętość roztworu przed miareczkowaniem, ckwasu - stężenie molowe kwasu benzoesowego w roztworze, VNaOH - objętość mianowanego roztworu NaOH użyta podczas miareczkowania, cNaOH - stężenie mianowanego roztworu NaOH (0,1003 mol/dm3)
Nr. kolby |
VNaOH [cm3] |
cNaOH [mol/dm3] |
Vkwasu [cm3] |
ckwasu [mol/dm3] |
1 |
16,5 |
0,1003 |
50 |
0,0331 |
3 |
9,4 |
0,1003 |
25 |
0,03771 |
4 |
9,6 |
0,1003 |
25 |
0,03852 |
Kolba numer 1 - ckwasu=0,1003mol∙dm-3∙16,5cm3/50cm3=0,0331 mol∙dm-3
Kolba numer 3 - ckwasu=0,1003mol∙dm-3∙9,4/25cm3=0,03771 mol∙dm-3
Kolba numer 4 - ckwasu=0,1003mol∙dm-3∙9,6/25cm3=0,03852 mol∙dm-3
d) obliczenie rozpuszczalności z zależności:
K=![]()
gdzie: cr - stężenie molowe wyznaczone metodą miareczkowania alkacymetrycznego roztworu nasyconego w danej temperaturze [mol/dm3], Ms - masa molowa substancji (dla kwasu benzoesowego = 122,12 g/mol), dr - gęstość roztworu nasyconego danej substancji [g/dm3].
Nr. kolby |
cr [mol/dm3] |
dr [g/dm3] |
Rs [g/100 cm3 H2O] |
1 |
0,0331 |
1014,4 |
0,3984 |
3 |
0,03771 |
998,4 |
0,46125 |
4 |
0,03852 |
999,6 |
0,4705 |
Kolba numer 1-Rs=(0,0331mol∙dm-3∙122,12g∙mol-1/1014,4g∙dm-3)∙100 =0,3984g/100 g H2O
Kolba numer 3-Rs=(0,03771mol∙dm-3∙122,12g∙mol-1/998,4g∙dm-3)∙100 =0,46125g/100 g H2O
Kolba numer 4-Rs=(0,03852mol∙dm-3∙122,12g∙mol-1/999,6g∙dm-3)∙100 =0,4705g/100 g H2O
e) wyznaczenie entalpii procesu rozpuszczania,
T1 K1 = R1 = 0,3984/100g H2O
![]()
![]()
K![]()
=(R3+R4)/2=(0,46125g+0,4705g)/2=0,465875g/100g H2O
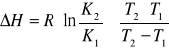
gdzie: K2 i K1 - rozpuszczalność substancji w temperaturach T2 i T1,
R - stała gazowa = 8,313[![]()
], T1 - 296,0 K, T2 - 313,0K.
Podstawiając dane do wzoru otrzymujemy:
∆H=8,313J∙mol-1∙K-1(ln 0,465875/0,3984)∙[313,0 K∙296,0 K/(313,0K−296,0K)]=7088,4379J∙mol-1
Wyznaczanie entalpii rozpuszczania biorąc pod uwagę kąt nachylenia prostej:
a=-ΔH/R
ΔH=-aR= -(-507,37K∙ 8,313J/mol∙K=4217,767 J/mol
5.Wnioski
Rozpuszczalność kwasu wzrasta wraz ze wzrostem temperatury.
Porównując metodę teoretyczną………. z metodą algebraiczna…….. można wywnioskować iż uzyskujemy zbliżone wyniki co mówi nam o prawidłowości zastosowanej metodzie . Zapoznałyśmy się z metodą wyznaczania ciepła rozpuszczania substancji w stanie stałym z pomiarów jej rozpuszczalności w różnych temperaturach. Wszelkie wartości, które różnią się od siebie na wykresie mogą być spowodowane błędami podczas miareczkowania, błędami pomiarowymi, ochłodzeniem się roztworu, oraz wytrąceniem części kwasu. Nie zrobiłyśmy miareczkowania jednej kolby z powodu skrystalizowania się roztworu w pipecie co wynika z tego, że ciepło rozpuszczania substancji było zbyt wysokie gdyż ogrzałyśmy pipetę wodą o zbyt niskiej temperaturze.
Wyszukiwarka
Podobne podstrony:
4910 1 Hover Scout
4910
04 03 Konfliktyid 4910 ppt
praca-licencjacka-b7-4910, Dokumenty(8)
4910
4910
4910 1 Hover Scout
04 03 Konfliktyid 4910 ppt
4910 1 Hover Scout
więcej podobnych podstron