Szybkość reakcji i równania chemiczne.
Wszelkie reakcje chemiczne zachodzą z różną szybkością. Jedne trwają ułamki sekund, a inne nawet kilkanaście lat. Ich szybkość zależy od rodzaju reakcji, od warunków w jakich przebiega, jak również od stężenia substancji reagujących, temperatury, obecności katalizatorów i wielu innych czynników.
Aby reakcja mogła zaistnieć cząsteczki reagujące muszą się ze sobą zderzać. Jednak przereagowują tylko te cząsteczki które w momencie zderzenia mają dostatecznie dużą energię (cząsteczki aktywne).Wartość energii jaką cząsteczki muszą przekroczyć aby przereagować nazywa się energią aktywacji. Ilość zderzeń jest proporcjonalna do stężenia reagentów.
Szybkość reakcji jest proporcjonalna do iloczynu stężeń cząsteczkowych substratów i wynosi:
V = k * [A] * [B]
Gdzie: V - szybkość reakcji
[A] , [B] - stężenie cząsteczkowe
k - stała szybkości reakcji
Szybkość reakcji chemicznej wyrażamy liczbą moli substancji w litrze, które w jednostce czasu uległy przemianie, czyli zmianą stężenia w jednostce czasu.
Gdy temperatura wzrośnie, zwiększa się również energia cząsteczek, co powoduje wzrost szybkości ich ruchu. Konsekwencją tego jest większa ilość zderzeń skutecznych prowadzących do zwiększenia szybkości reakcji. Na ogół zwiększenie temperatury o 10 oC powoduje 2-krotny wzrost szybkości reakcji.
Na szybkość reakcji wpływają również substancje zwane katalizatorami. Nie biorą one udziału w reakcji, ale jeżeli ich obecność przyspiesza reakcję mówi się o zjawisku katalizy dodatniej, a jeżeli opóźniają reakcję - katalizie ujemnej. Katalizatorami mogą być substancje w różnych stanach skupienia i o różnych własnościach. Jeżeli rolę katalizatora spełnia jeden z produktów mówimy o tzw. autokatalizie. Katalizatory mogą oddziaływać na całą reakcję jak i oddziaływać wybiórczo na jeden z procesów jeżeli przebiega równocześnie ich kilka. Jest to tzw. działanie selektywne.
Reakcje odwracalne i równowaga chemiczna.
Reakcje przebiegające w obydwu kierunkach nazywa się reakcjami odwracalnymi. Jeżeli w chwili początkowej szybkość reakcji V1 między substratami ma wartość maksymalną i w miarę reagowania maleje, to szybkość V2 (reakcja odwrotna) rośnie od zera wskutek nagromadzenia się produktów. Ponieważ V1 maleje a V2 rośnie to dochodzi do zrównania szybkości i ustalenia się stanu równowagi dynamicznej. Stan ten charakteryzuje się m.in. zanikiem efektów cieplnych (wydzielanie, pochłanianie) i obecnością substratów i produktów w jednakowych stężeniach.
W przypadku reakcji odwracalnych, czyli
mA + nB ↔ pC + rD
szybkości reakcji „w prawo” i „w lewo” wynoszą odpowiednio:
V1 = k1 [A]m [B]n
V2 = k2 [C]p [D]r
skoro w stanie równowagi V1 = V2 to:
k1 [A]m [B]n = k2 [C]p [D]r
stąd po przekształceniu otrzymujemy stałą równowagi chemicznej K
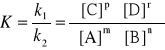
Stała ta podaje w jakim stopniu ta reakcja przebiegnie i ile otrzymamy produktu reakcji ale nie wskazuje jak szybko ta reakcja przebiegnie.
Stan równowagi zależy od temperatury, stężenia i ciśnienia. Przy zmianie nawet jednego z tych parametrów następuje naruszenie stanu równowagi i stężenia substancji ulegają zmianie. Trwa to tak długo aż stosunek iloczynów substratów i produktów nie osiągnie wartości stałej równowagi chemicznej. Kierunek zmian pozwala przewidzieć zasada przekory lub przeciwdziałania:
„Jeżeli układ znajdujący się w stanie równowagi poddamy działaniu zewnętrznemu, wówczas zmiana stanu równowagi nastąpi w kierunku zmniejszenia skutków tego działania.”
Zasada ta umożliwia analizę wpływu trzech rodzajów działań zewnętrznych:
zmiany temperatury
zmiany stężenia
zmiany ciśnienia
Jeżeli przy zmianie stężeń, temperatury lub ciśnienia szybkości reakcji zachodzących w obu kierunkach zmieniają się jednakowo, to przesunięcie równowagi nie nastąpi, ale jeżeli któryś z parametrów zmieni się w jednym kierunku to wówczas równowaga zostanie naruszona i ulegnie przesunięciu.
Ćwiczenie 1
Zależność szybkości reakcji od stężenia substancji reagujących
Ćwiczenie oparło się na reakcji kwasu siarkowego z tiosiarczanem sodu w której wynikiem jest wydzielanie się wolnej siarki powodującej zmętnienie roztworu wg. reakcji:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S
najpierw wyznaczono miarę szybkości tej reakcji, przez dodanie do 3-4 cm3 r-ru tiosiarczanu sodu taką samą ilość kwasu. Czas jaki upłynął od chwili dodania kwasu do pojawienia się zmętnienia r-ru określił tę miarę która wyniosła 21 sekund.
następnie do czterech probówek odmierzono po 6 cm3 roztworu kwasu. Do czterech następnych odmierzono roztwory tiosiarczanu sodu i wody destylowanej w ilościach ujętych w poniższej tabeli. Potem do probówek zawierających roztwór Na2S2O3 o różnych stężeniach wlano odmierzony kwas. Za każdym razem mierzono czas trwania reakcji. Wyniki pomiarów zamieszczono w tabeli.
NUMER PROBÓWKI |
OBJĘTOŚĆ W cm3 |
STĘŻENIE Na2S2O3
|
CZAS TRWANIA REAKCJI W SEK. - t - |
SZYBKOŚĆ REAKCJI
|
|
|
Na2S2O3 a
|
H2O b |
|
|
|
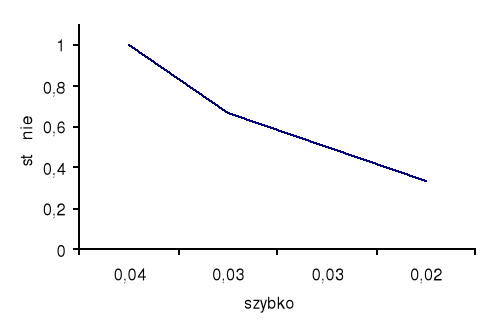
1. 2. 3. 4. |
6 4 3 2 |
0 2 3 4 |
1 0,66 0,5 0,33 |
28 29 33 1,03 |
0,0357 0,0344 0,0303 0,7692 |
Wnioski, czyli zależność między początkowym stężeniem roztworu i szybkością reakcji przedstawiono graficznie jako wykres funkcji
![]()
Ćwiczenie 2
Zależność szybkości reakcji od temperatury
Do czterech ponumerowanych probówek odmierzono po 4 cm3 roztworu H2SO4, a do czterech innych taką samą objętość Na2S2O3. Wszystkie probówki umieszczono w zlewce z wodą o zmierzonej temperaturze. Do probówki oznaczonej 1 dodano roztwór kwasu siarkowego i zmierzono czas po jakim pojawiło się zmętnienie. Zlewkę z probówkami ogrzano o 10oC i powtórzono doświadczenie z probówką 2. Analogicznie postąpiono z probówkami 3 i 4 za każdym razem podwyższając temperaturę o 10oC. Wyniki doświadczenia ujęto w tabeli.
NR. PROBÓWKI |
TEMPERATURA POMIARU W oC |
CZAS TRWANIA REAKCJI W SEK. - t -
|
SZYBKOŚĆ REAKCJI
|
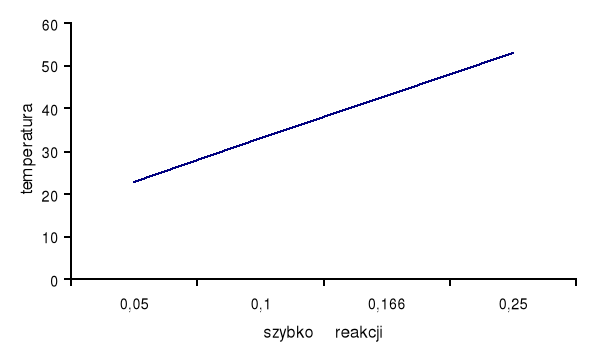
1. 2. 3. 4. |
23 33 43 53 |
20 10 6 4 |
0,05 0,1 0,166 0,25 |
Wnioski:
Zgodnie z teorią podniesienie temperatury o 10oC powoduje 2-krotne zwiększenie szybkości reakcji. Otrzymane wyniki pokrywają się z teorią z tolerancją do ±1 sekundy.
Wpływ temperatury na szybkość reakcji przedstawiono graficznie.
1
Wyszukiwarka
Podobne podstrony:
8085
praca magisterska wa c 8085
8085
8085
8080 8085 Assembly Language Programming (1977)(Intel)(Pdf)
8080 8085 Assembly Language Programming (1977)(Intel)(Pdf)
więcej podobnych podstron