POLITECHNIKA WROCŁAWSKA INSTYTUT FIZYKI
|
Sprawozdanie z ćwiczenia nr 24 |
TOMASZ ZALEWA DARIUSZ DULINIEC
|
TEMAT: Wyznaczanie ciepła topnienia lodu. |
Wydział: PPT Rok: 2
|
DATA: 12.10.1994 OCENA: |
Cel ćwiczenia:
Zapoznanie się z techniką pomiarów kalometrycznych oraz ocena dokładności tych pomiarów.
Część teoretyczna ( opis zjawiska fizycznego ).
Mierzeniem ilości ciepła zajmuje się dział nauki o cieple, zwany kalorymetrią. Kalorymetria opiera się na kilku zasadach, które można wyrazić następująco:
- ilość ciepła ![]()
oddana przez ciało badane jest równa ilości ciepła ![]()
pobranej przez ciała otaczające;
- ilość ciepła pobrana przez ciało podczas ogrzewania jest równa ilości ciepła oddanej podczas ostygania w tym samym zakresie temperatur jeśli ciało przechodzi w odwrotnym porządku przez te same stany pośrednie;
- ilość ciepła Q oddana bądź pobrana przez ciało jednorodne jest proporcjonalna do jego masy, a przy niewielkich zmianach temperatury - do przyrostu temperatury ![]()
.
Ciepłem topnienia nazywamy ilość ciepła potrzebną do zamiany 1 kg ciała stałego
o temperaturze topnienia na ciecz o tej samej temperaturze.
Ilość ciepła Q potrzebna do stopienia masy m ciała o temperaturze topnienia wyraża się wzorem ![]()
, gdzie ![]()
- ciepło topnienia.
Temperatura topnienia T zależy od ciśnienia, przy ktorym zachodzi przemiana ciała stałego
w ciecz.
Część doświadczalna (pomiary dokonano 2x):
Kalorymetr wodny:
- Po zważeniu na wadze laboratoryjnej pustego suchego naczynia kalorymetrycznego wraz
z mieszadłem, napełniono 2/3 obj. wodą destylowaną i ponownie zważono.
- Po wstawieniu naczynia do kalorymetru i zanurzeniu termometru, przez ok. 5min odczytywano temperaturę.
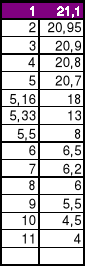
TABELA 1 (pomiar1)
czas[min] |
temp.[C] |
1 |
21.1 |
2 |
20.95 |
3 |
20.9 |
4 |
20.8 |
5 |
20.8 |
- Po otworzeniu kalorymetru, wsypaniu drobno potłuczonego lodu (1/4 obj.), mieszając wodę odczytywano temperaturę co 1015s.
TABELA 2 (pomiar1)
czas[s] |
temp.[C] |
10 |
18 |
20 |
13 |
30 |
8 |
60 |
6.5 |
120 |
6.5 |
180 |
6 |
240 |
5.5 |
300 |
4.3 |
360 |
4 |
- Zważono naczynie kalorymetryczne.
TABELA 3 (pomiar1)
masa naczynia |
82.4g |
masa naczynia z woda |
358.1g |
masa wody |
275.7g |
masa naczynia z woda+lod |
423 |
masa lodu |
64.9g |
Sporzadzenie wykresu T=f(t):
Część obliczeniowa :
Dzięki ważeniu naczynia w poszczególnych fazach doświadczenia uzyskano następujące masy:
Wnioski :
Ważenie za pomocą wagi laboratoryjnej pozwala osiągnąć dokładność ![]()
, zatem błąd pomiaru masy kalorymetru ![]()
mas ![]()
wynosi : ![]()
. Błąd pomiaru masy wody ![]()
, wynosi : ![]()
, oraz masy lodu ![]()
wpisz tabelki ;;;;zajrzyj do książki ;; wstaw odpowiednie błędy (termometr itp.)
3
Wyszukiwarka
Podobne podstrony:
Mech- Wyznaczanie ciepła topnienia lodu(1), Sprawozdania - Fizyka
Wyznaczanie ciepła topnienia lodu, Emilia Wieteska
Mech- Wyznaczanie ciepła topnienia lodu, Sprawozdania - Fizyka
wyznaczanie ciepła topnienia lodu
fizyka, Ciepło topnienia lodu 2 (inne spr.), Temat ćwiczenia nr 32:Wyznaczanie ciepła topnienia lodu
Wyznaczanie ciepła topnienia lodu ćw nr 11, PWSZ Krosno budownictwo, Fizyka
WYZNACZANIE CIEPLA TOPNIENIA LODU, Sprawozdania
C1- Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru. sprawozdanie, Sprawozdania
Wyznaczanie ciepła topnienia lodu przy pomocy kalorymetru, Studia, Pracownie, I pracownia
Wyznaczanie ciepła topnienia lodu, topnienie lodu
C1 - Wyznaczanie ciepła topnienia lodu metoda kalorymetryczn, Sprawozdania
wyznaczanie ciepła topnienia lodu, Sprawozdania
wyznaczanie ciepla topnienia lodu, Budownictwo PG, Semestr 2, Fizyka, Laborki Fizyka, Laborki - chom
Wyznaczanie ciepła topnienia lodu, Sprawozdania - Fizyka
Wzyanczanie ciepła topnienia lodu przy pomocy kalorymetru, Studia, Pracownie, I pracownia, 27 Wyznac
spr od diany wyznaczanie ciepla topnienia lodu, biologia uj, biologia II, fizyka
więcej podobnych podstron