autodysocjacja wody, iloczyn jonowy wody, skala pH, odczyn roztworu, metody pomiaru wartości pH (indykatory pH, pH-metry, wzór Nernsta, elektroda wodorowa),
Autodysocjacja wody ub autoprotoliza wody to samorzutna dysocjacja elektrolityczna cząsteczek H2O zachodząca w wodzie ciekłej, rodzaj dysocjacji elektrolitycznej, w której czysty (ciekły) związek chemiczny w postaci cząsteczkowej rozpada się na jony pod wpływem innych cząsteczek tego samego związku, pełniąc przy tym rolę zarówno kwasu jak zasady. Autodysocjacja tego typu jest możliwa gdyż cząsteczki wody mają budowę polarną
![]()
Iloczyn jonowy - rodzaj uproszczonej stałej rownowagii reakcji autodysocjacji, które są na tyle słabymi elektrolitami, że można pominąć w tej stałej stężenie niezdysocjowanej formy związku.
![]()
Skala pH - ilościowa skala kwasowości i zasadowości roztworów wodnych związków chemicznych. Skala ta jest oparta na aktywności jonów hydroniowych [H3O+] w roztworach wodnych.
Tradycyjnie pH definiuje się jako:
pH = -log10[H3O+]
czyli minus logarytm dziesiętny aktywności jonów hydroniowych wyrażonych w molach na decymetr sześcienny. Współcześnie jednak nie jest to ścisła definicja tej wielkości.
Odczyn roztworu to cecha każdego roztworu dzięki niemu dowiadujemy się o nadmiarze jonów H+- odczyn kwaśny lub nadmiar jonów OH- - odczyn zasadowy, a gdy są w równowadze -odczyn obojętny. Jest to bardzo ważne pojęcie. Determinuje czasami przebieg, szybkość oraz rodzaj powstających produktów. Czasami określone reakcje mogą zachodzić tylko w ściśle określonym pH. Roztwory o pH od 1 do 6 mają odczyn kwasowy (zawierają nadmiar jonów wodorowych), zaś roztwory o pH od 8 do 14 maja odczyn zasadowy (zawierają nadmiar jonów wodorotlenowych). Roztwór o pH równym 7 jest obojętny.
Metody pomiaru wartości pH
Wskaźniki, indykatory, substancja pozwalająca na stwierdzenie danej cechy, związki chemiczne zmieniające barwę w pobliżu punktu równoważnikowego miareczkowania. Mogą być stosowane samodzielnie lub z obojętnym barwnikiem, wzmagającym intensywność ich koloru (wskaźniki mieszane).
To wskaźniki odczynu ,m.in:
- lakmus - czerwony w kwasach, niebieski w zasadach,
- błękit bromotymolowy - żółty w kwasach, niebieski w zasadach,
- oranż metylowy - pomarańczowy w roztworze obojętnym, czerwony w kwasach, żółty w zasadach
- fenoloftaleina - bezbarwna w roztworach obojętnych i kwasowych, malinowa w zasadach
pH-metr - urządzenie służące do pomiaru pH analizowanych substancji chemicznych.
Większość pH-metrów to w istocie mierniki potencjału, w których pH ustala się na podstawie pomiaru siły elektromotorycznej (SEM) ogniwa utworzonego z elektrody wskaźnikowej (zanurzonej w roztworze badanym) i elektrody porównawczej (zanurzonej w roztworze wzorcowym o znanym pH).
Wzór Nernsta /dla układów, w których warunki pomiaru nie są standardowe/
E - potencjał układu redoks w warunkach niestandardowych
E0 - standardowy potencjał redoks układu
R - stała gazowa
T - temperatura w K
F - stała Faradaya
[ox], [red] - stężenia /aktywności/ formy utlenionej i zredukowanej
Elektroda wodorowa - w elektrochemii elektroda gazowa, wykonana z platyny pokrytej czernią platynową omywaną gazowym wodorem pod ciśnieniem cząsteczkowym 101,3 kPa w temperaturze 273,15 K, zanurzona w roztworze o jednostkowej aktywności jonów wodorowych.
Przez międzynarodową konwencje, elektroda wodorowa używana jest jako punkt odniesienia potencjału w elektrochemii. Przyjęto jej potencjał standardowy za zero
(we wszystkich temperaturach)[1] Potencjały innych elektrod odnoszą się do potencjału tej elektrody (w tej samej temperaturze). Odniesienie potencjału metalu do elektrody wodorowej jako standardu wynika między innymi ze sposobu reakcji metali z kwasami.
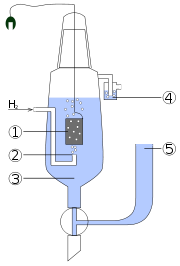
Elektroda wodorowa: 1) elektroda platynowa, 2) pęcherzyki wodoru, 3) roztwór kwasu, 4) płuczka blokująca dostęp tlenu, 5) zbiornik z zapasem elektrolitu
Wyszukiwarka
Podobne podstrony:
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
6b, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
10.2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
6a, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadanienie 7, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, eg
5, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
8, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
19, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
zagadnienie 3, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
zagadnienie 9, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
Zagadnienie16, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
17, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
11, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
więcej podobnych podstron