Marcin Sikora
Wydział : Mechaniczny
Kierunek : Automatyka i Robotyka
Rok : II
Data ćwiczenia : 02.04.98
Prowadząca : dr L. Lewowska
Ćwiczenie 25
Temat: Wyznaczanie ciepła właściwego topnienia lodu.
1) Cel ćwiczenia :
Zapoznanie z techniką pomiarów kalorymetrycznych oraz oceną ich dokładności.
2) Wprowadzenie :
Ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do danego ciała ( o określonej masie ), aby temperatura tego ciała wzrosła o jednostkę temperatury. W układzie SI ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do pewnego ciała o masie jednego 1 kg, aby jego temperatura wzrosła o jeden 1K.
Ciepłem topnienia nazywamy ilość ciepła potrzebną do zmiany 1 kg ciała stałego danej substancji o temperaturze topnienia na ciecz o tej samej temperaturze. Wynika z tego, że Q = ctm (gdzie Q -ciepło potrzebne do stopienia danego ciała stałego o masie m, ct - ciepło topnienia tego ciała).
Na energią wewnętrzną ciała stałego składa się:
energia kinetyczna cząstek ( związana z drganiami cieplnymi );
energia potencjalna wzajemnego oddziaływania cząstek.
Podczas podgrzewania ciała stałego można zauważyć zmianę jego objętości. Wynika to z tego, że podgrzewając dostarczamy energię, którą przejmują cząsteczki ciała znajdujące się w sieci krystalicznej ( drgają z coraz większą amplitudą - potrzebują więcej miejsca ) w efekcie tego objętość ciała wzrasta.Podczas dalszego ogrzewania ciała dochodzi się do pewnej charakterystycznej temperatury ( zwanej temperatura topnienia ) w której zachodzi zjawisko topnienia - czyli proces przejścia ze stanu stałego ciała w stan ciekły. Ciekawe jest, że towarzyszy temu stała temperatura. Jest to spowodowane tym, że podczas tego zjawiska energia dostarczana przechodzi tylko w energię potencjalną oddziaływań cząstek między sobą i w wyniku tego zniszczone zostają wiązania międzycząsteczkowe ( ciało przechodzi w ciecz przy stałej temperaturze ).Okazuje się, że temperatura topnienia zależy od ciśnienia w jakim ta przemiana następuje. Zależność tę oddaje równanie Clausiusa-Clapeyrona:![]()
gdzie:
T- temperatura przemiany przy ciśnieniu p?p- ciśnienia względem p?T- przyrost temperatury przemiany spowodowany przyrostem ciśnienia q- ciepło przemiany (np. ciepło topnienia)V1, V2 - objętości ciała przed i po przemianie Ciepło topnienia lodu wyznaczamy z bilansu cieplnego dla procesu stopienia pewnej ilości lodu w kalorymetrze:
![]()
- równanie bilansu cieplnegogdzie: ?Q1-cieplo potrzebne do stopienia lodu?Q2-cieplo potrzebne do ogrzania powstałej z lodu wody?Q3-cieplo dostarczone przez wódę w naczyniu kalorymetrycznym?Q4-cieplo dostarczone przez kalorymetr z mieszadłem?Q5-cieplo dostarczone przez zanurzoną cześć termometru (praktycznie zbiorniczek z rtęcią i szkło - oprawa termometru)
4) Wartości przyjęte w doświadczeniu :
Waga suchego naczynia kalorymetrycznego z mieszadłem :
mk=0,06255kg
Waga wody destylowanej dla doświadczenia nr 1 :
mw=0,26615kg
Waga wody destylowanej dla doświadczenia nr 2 :
mw=0,25500kg
Pojemność cieplna właściwa zbiornika z rtęcią:
![]()
Ciepło właściwe wody :
![]()
Ciepło właściwe kalorymetru aluminiowego :
![]()
Objętość zanurzenia termometru w doświadczeniu nr 1 :
V=0,16ml
Objętość zanurzenia termometru w doświadczeniu nr 2 :
V=0,12ml
Waga lodu w doświadczeniu nr 1 :
ml=0,0513kg
Waga lodu w doświadczeniu nr 2 :
Błędy pomiaru temperatury :
ΔTw=ΔTk=0,2K
Błąd pomiaru masy naczynia kalorymetrycznego :
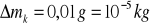
Błędy pomiaru masy wody :
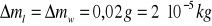
Błąd pomiaru objętości zanurzonej części termometru :
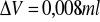
Błędy dla wielkości stałych :
Pomiar temperatury wody w kalorymetrze :
Doświadczenie 1
Doświadczenie 2
Czas [s]
Temperatura [°C]
Temperatura [K]
Temperatura [°C]
Temperatura [K]
0
32,8
305,8
35,0
308,0
60
32,7
305,7
34,8
307,8
120
32,6
305,6
34,7
307,7
180
32,5
305,5
34,6
307,6
240
32,4
305,4
34,5
307,5
300
32,3
305,3
34,4
307,4
cx ciepło topnienia lodu
ml masa lodu
cw ciepło właściwe wody
mw masa wody w kalorymetrze
ck ciepło właściwe kalorymetru
mk masa kalorymetru z mieszadełkiem
R objętościowe ciepło właściwe szkła i rtęci
V objętość zanurzonej części termometru
Tw temperatura początkowa wody w kalorymetrze
Tk temperatura końcowa układu
Tt temperatura topnienia lodu równa 273,0K
ml=0,03205kg
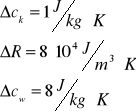
5) Tabela :
Pomiar temperatury wody z lodem w kalorymetrze :
|
Doświadczenie 1 |
Doświadczenie 2 |
||
Czas [s] |
Temperatura [°C] |
Temperatura [K] |
Temperatura [°C] |
Temperatura [K] |
5 |
25,0 |
298,0 |
30,0 |
303,0 |
10 |
23,5 |
296,5 |
28,5 |
301,5 |
20 |
22,2 |
295,2 |
26,5 |
299,5 |
30 |
21,8 |
294,8 |
25,2 |
298,2 |
40 |
19,0 |
292,0 |
24,8 |
297,8 |
50 |
18,2 |
291,2 |
24,7 |
297,7 |
60 |
17,8 |
290,8 |
24,3 |
297,3 |
70 |
17,5 |
290,5 |
24,2 |
297,2 |
80 |
17,3 |
290,3 |
24,1 |
297,1 |
90 |
17,0 |
290,0 |
23,9 |
296,9 |
100 |
16,8 |
289,8 |
23,9 |
296,9 |
110 |
16,7 |
289,7 |
23,9 |
296,9 |
120 |
16,7 |
289,7 |
23,9 |
296,9 |
180 |
16,5 |
289,5 |
23,9 |
296,9 |
240 |
16,4 |
289,4 |
23,9 |
296,9 |
300 |
16,3 |
289,3 |
23,8 |
296,8 |
360 |
16,3 |
289,3 |
23,8 |
296,8 |
420 |
16,3 |
289,3 |
23,8 |
296,8 |
6) Obliczenia :
Wyznaczenie ciepła topnienia lodu z równania bilansu cieplnego :
Po podstawieniach:
![]()
![]()
![]()
![]()
![]()
![]()
Oznaczenia :
Mogę teraz wyliczyć ciepło topnienia lodu :
![]()
![]()
![]()
Błąd :
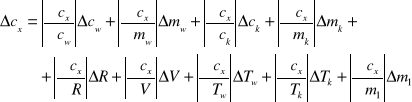

![]()
Ostatecznie ![]()
Błąd względny wynosi ![]()
7) Wnioski :
Celem ćwiczenia było zmierzenie ciepła topnienia lodu. Pomiary dały wynik 336260,34 J/Kkg. Wartość ciepła topnienia podawana w tablicach fizycznych wynosi 340000 J/Kkg. Błąd bezwzględny wyniku to 1453 J/Kkg co jest sporą wartością, lecz jako błąd względny daje ostatecznie 0,43 %.
Na wykresie topnienia (na papierze milimetrowym) widać, ze charakterystyka jest "zaokrąglona", nie ma tam kątów ostrych (teoretycznie - bez uwzględniania warunków praktycznych pomiaru powinny być ostre). Wynika to z bezwładności cieplnej wszystkich elementów biorących udział praktycznie w wymianie ciepła, więc : kalorymetr, woda, termometr, mieszadełko kalorymetru, powietrze w kalorymetrze i poza nim, stół na którym stal kalorymetr. Największy wpływ na zaokrąglenie charakterystyki miały czynniki bezpośrednio stykające się z lodem.
Pomiar ciepła topnienia lodu był pośredni (nie można zmierzyć tego bezpośrednio - należy wyliczyć ze wzoru). W związku z tym, że wzór był dość rozbudowany i składał się z wielu zmiennych. Na błąd pomiaru wpływało wiele czynników takich jak :
dokładność pomiaru mas (kalorymetru, kalorymetru z woda, kolorymetru z woda i lodem)
dokładność pomiaru objętości pojemniczka z rtęcią w termometrze
dokładność pomiaru temperatury w rożnych chwilach
Spośród tych rożnych przyczyn największy wpływ na błąd miały : dokładność pomiaru temperatury końcowej całego układy i dokładność pomiaru temperatury początkowej wody w kalorymetrze. Generalnie na błędy najbardziej wpłynął pomiar temperatury.
Dodatkowo niedokładności mogły być związane z wymiana ciepła miedzy kalorymetrem, a powietrzem (niedokładne odizolowanie wewnętrznego naczynia kalorymetru od zewnętrznego). Pewną wymianę ciepła z otoczeniem dawał także termometr i mieszadełko kalorymetru.
Wyszukiwarka
Podobne podstrony:
44, CWI44A, Marcin Sikora
OBSERWACJA nr 25 26 Marcin gry i zabawy
Ustawa z dnia 25 06 1999 r o świadcz pien z ubezp społ w razie choroby i macierz
Cwiczenia 23 25 2007
Wykład 25
Wykład12 Sieć z protokołem X 25 i Frame Relay
zwierzaczki 25
25 Wyklad 1 Dlaczego zwiazki sa wazne
wyklad 2012 10 25 (Struktury systemów komputerowych)
Wykład10a Sieć z protokołem X 25 i Frame Relay
prognozowanie i symulacje wyklad (25 str)
25 26
21 25
25 Pilot, Mechanizmy prowadzace do zroznicowania genetycznego miedzy populacjami w obrebie gatunku (
KM W 25 lekkie konst met stud
2 25 Spajanie różnorodnych materiałów
obrazki 25
więcej podobnych podstron