18.10.2006r.
PRAWOZDANIE Z ĆWICZENIA NR 3 - PRZEWODNICTWO ELEKTROLITÓW
Grupa II :
Michał Październik
Paweł Pietrzykowski
Adam Pośpiech
Grzegorz Wiszowaty
Ćwiczenie 1. Pomiar przewodnictwa równoważnikowego słabych elektrolitów |
||
Data |
Ocena |
Podpis asystenta |
Tabela 1. Wyniki pomiarów
(Temperatura prowadzenia oznaczeń: 298 K).
Stężenie roztworu [mol/l] |
Przewodnictwo roztworu λ [S] |
0,01 KCl |
2,79 x10-3 |
C = 0,03020 C/2 = 0,0151 C/4 = 7,55x10-3 C/8 = 3,77 x10-3 C/16 = 1,89 x10-3 C/32 = 9,44 x10-4 C/64 = 4,72 x10-4
|
638 x10-6 520 x10-6 393 x10-6 286 x10-6 213 x10-6 183 x10-6 156 x10-6 |
Stała naczynka k:
k = ![]()
= ![]()
= 50,645 m-1
Tabela 2. Wyniki obliczeń
Stężenie roztworu [mol/l] |
Przewodnictwo właściwe κ [S/m] |
Przewodnictwo równowaznikowe Λ [Sm2 /mol] |
0,01 KCl |
0,1431 |
1,431 |
C = 0,03020 C/2 = 0,0151 C/4 = 7,55x10-3 C/8 = 3,77 x10-3 C/16 = 1,89 x10-3 C/32 = 9,44 x10-4 C/64 = 4,72 x10-4
|
0,03231 0,02633 0,01990 0,01449 0,01079 9,26x10-3 7,90x x10-3
|
1,07 x10-3 1,74 x10-3 2,63 x10-3 3,84 x10-3 5,71 x10-3 9,81 x10-3 1,67 x10-2 |
Wykres zależności Λ = f( √C) dołączony do sprawozdania.
Obliczenia przewodnictwa właściwego oraz przewodnictwa równoważnikowego przeprowadzono z następujących wzorów: (wyniki w tabeli 2.)
k = ![]()
czyli κ = λ x k
Λ = 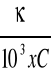
Ćwiczenie 2. Pomiar przewodnictwa równoważnikowego mocnych elektrolitów |
||
Data |
Ocena |
Podpis asystenta |
Tabela 3. Wyniki pomiarów
(Temperatura prowadzenia oznaczeń: 298 K).
Stężenie roztworu [mol/l] |
Przewodnictwo roztworu λ [S] |
C = 0,02 C/2 = 0,01 C/4 = 0,005 C/8 = 2,5 x10-3 C/16 = 1,25 x10-3
|
296 x10-6 166,3 x10-6 137,6 x10-6 120,0 x10-6 108,5 x10-6 |
Tabela 4. Wyniki obliczeń
Stężenie roztworu [mol/l] |
Przewodnictwo właściwe κ [S/m] |
Przewodnictwo równowaznikowe Λ [Sm2 /mol] |
C = 0,02 C/2 = 0,01 C/4 = 0,005 C/8 = 2,5 x10-3 C/16 = 1,25 x10-3
|
0,01499 8,42 x10-3 6,97 x10-3 6,08 x10-3 5,49 x10-3 |
7,49 x10-4 8,42 x10-4 1,39 x10-3 2,43 x10-3 4,39 x10-3 |
Obliczenia przewodnictwa właściwego oraz przewodnictwa równoważnikowego przeprowadzono z następujących wzorów:
k = ![]()
czyli κ = λ x k
Λ = 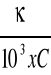
Współczynniki a i b zostały obliczone metodą najmniejszych kwadratów:
Λ (zmienna y) [Sm2 /mol] |
√C (zmienna x) [√mol/l]
|
Λx√C (iloczyn zmiennych x i y) [Sm2 √mol/ mol x l] |
7,49 x10-4 8,42 x10-4 1,39 x10-3 2,43 x10-3 4,39 x10-3 |
0,14 0,1 0,07 0,05 0,03 |
1,05 x10-4 0,84 x10-4 9,31 x10-5 1,22 x10-4 1,33 x10-4 |
Σ Λ= 9.8 x10-3 |
Σ√C=0,039 Σ(√C)2= 0,0379 |
Σ(Λx√C)= 5,36x10-4 |
a = 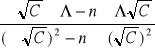
= - 0,0305 [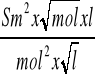
]
b = 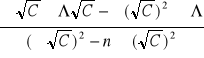
= Λ0 = 0,0043 [Sm2 /mol]
a więc równanie ma postać y = - 0,0305x + 0,0043
Wykres zależności Λ = f( √C) dołączony do sprawozdania.
Ćwiczenie 3. Pomiar iloczynu rozpuszczalności trudno rozpuszczalnej soli |
||
Data |
Ocena |
Podpis asystenta |
Tabela 5. Wyniki pomiarów
(Temperatura prowadzenia oznaczeń: 298 K).
Nr pomiaru |
Przewodnictwo λ [S] |
|
|
Woda |
Roztwór soli |
1 2 3 wartość średnia |
6 x10-6 ---------------- ---------------- 6 x10-6 |
23,4 x10-6 22,4 x10-6 22,8 x10-6 22.87 x10-6 |
Stała naczynka, zgodnie z wcześniejszymi obliczeniami wynosi: k = 50,645 m-1
Tabela 6. Wyniki obliczeń
Λ0sól = 286,9 x10-4 Sm2/mol (wartość podana przez asystenta)
Przewodnictwo właściwe κ [S/m] |
Stężenie soli C [mol/l] |
Iloczyn rozpuszczalności L [mol2 x l2 ] |
||
Woda κ1 |
R-r soli κ2 |
Sól κ2 - κ1 |
|
|
4,55 x10-4
|
1,16 x10-3 |
7,05 x10-4 |
2,46 x10-5 |
6,04 x10-10 |
Obliczenia:
κ1 = 50,645x6 x10-6 = 4,55 x10-4 Sm2/mol
κ2 = 50,645x22.87 x10-6= 1,16 x10-3 Sm2/mol
κ2 - κ1 =1,16 x10-3 - 4,55 x10-4 = 7,05 x10-4Sm2/mol
Stężenie soli :
Λ= 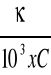
, a więc C = 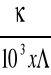
C = 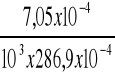
= 2,46 x10-5 mol/l
Iloczyn rozpuszczalności soli :
MeX Me+ + X-
[Me+] = [X- ] = C , a więc L = C2
L = (2,46 x10-5 )2 = 6,04 x10-10 [mol2 x l2 ]
Ćwiczenie 4. Wyznaczanie stałej dysocjacji słabego elektrolitu metodą konduktometryczną i przewodnictwa granicznego |
||
Data |
Ocena |
Podpis asystenta |
Tabela 7. Wyniki pomiarów i obliczeń
(Temperatura prowadzenia oznaczeń: 298 K).
C [mol/dm3] |
λ [S] |
κ [S/m] |
Λ [Sm2/mol] |
|
C |
0,01007 |
442x10-6 |
0,022 |
2,18x10-3 |
C/2 |
5,03x 10-3 |
350x10-6 |
0,018 |
3,51x10-3 |
C/4 |
2,52x10-3 |
275x10-6 |
0,0139 |
5,52x10-3 |
C/8 |
1,26x10-3 |
212x10-6 |
0,0107 |
8,5x10-3 |
C/16 |
6,2910-4 |
173x10-6 |
8,76x10-3 |
0,014 |
Obliczenia przewodnictwa właściwego oraz przewodnictwa równoważnikowego przeprowadzono z następujących wzorów:
k = ![]()
czyli κ = λ x k
Λ = 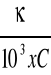
Równanie ma postać :
![]()
= ![]()
+ ![]()
Wyznaczone ze wzorów regresji liniowej współczynniki a i b wynoszą:
1/Λ (zmienna y) [mol/Sm2 ] |
CΛ (zmienna x) [Sm2/l ]
|
1/Λ x CΛ(iloczyn zmiennych x i y) [mol/l] |
458,72 284,90 181,16 117,65 71,43 |
2,2 x10-5 1,76 x10-5 1,39 x10-5 1,07 x10-5 8,81 x10-6 |
0,01 5,01 x10-3 2,52 x10-3 1,26 x10-3 6,29 x10-4 |
Σ 1/Λ= 1113,86 |
ΣCΛ =7,30x10-5 Σ (CΛ)2 = 1,18x10-9 |
Σ{(1/Λ)xCΛ}= 0,019 |
a = 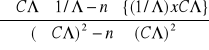
= 24561403,51 [mol x l/ (Sm2)2 ]
b = 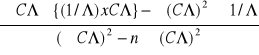
= -140,35 [mol/Sm2 ]
a więc funkcja ma postać y = 24561403,51x -140,35
b = ![]()
, a więc Λ0 = ![]()
= - 0,007125 Sm2/mol
a = ![]()
, a więc K = ![]()
= 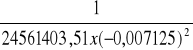
= 8,02 x 10-4 [Sm2/l]
Wykres zależności 1/Λ=f(CxΛ) został dołączony do sprawozdania.
Wyszukiwarka
Podobne podstrony:
sprawko z przewodnictwa, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
Sprawozdanie z cw III poprawiona, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozda
inwersja sacharozy, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
sprawko z refraktometrii, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fi
sprawozdanie z ćw.7, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczn
SPRAWOZDANIE Z ĆWICZENIA 4, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
Przewodnictwo elektrolitów, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
koloidy i emulsje, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej
Sprawozdanie z cwiczenia 19, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z
SPRAWOZDZANIE Z ĆWICZENIA NR 6, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdani
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
więcej podobnych podstron