1Związek chemiczny - jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania.
Podstawową jednostką związku chemicznego jest cząsteczka. Cząsteczki powstają i rozpadają się w wyniku tworzenia i zrywania wiązań
chemicznych między atomami. Procesy tworzenia i zrywania wiązań nazywa się reakcjami chemicznymi.
2. Równanie chemiczne stanowi zapis przebiegu reakcji chemicznej ujmujący jakościowy i ilościowy bilans substratów i produktów
reakcji, przedstawiony za pomocą symboli i wzorów chemicznych. Zapis równania chemicznego nie uwzględnia mechanizmu reakcji
chemicznej, to znaczy nie rejestruje dokładnego przebiegu tworzenia się połączeń przejściowych lub związków chemicznych, które nie
są substratami i produktami reakcji. Zn+2HCL=ZnCl2+H2
3. Reakcja egzotermiczna, reakcja chemiczna prowadzona przy stałej temperaturze i ciśnieniu (warunki izotermiczno-izobaryczne),
podczas której następuje przekazanie energii z układu reakcyjnego do otoczenia na sposób ciepła. Entalpia reakcji egzotermicznej jest
ujemna (ΔH<0).
4. Reakcja endotermiczna to reakcja chemiczna, która posiada ujemny bilans wymiany ciepła z otoczeniem. Można też powiedzieć,
że jest to reakcja, w której ciepło znajduje się po stronie substratów, albo inaczej która pochłania ciepło z otoczenia.
5. Jak w prosty sposób można wyjaśnić mechanizm tworzenia się związku chemicznego: Podstawową jednostką związku chemicznego
jest cząsteczka. Cząsteczki powstają i rozpadają się w wyniku tworzenia i zrywania wiązań chemicznych między atomami. Procesy
tworzenia i zrywania wiązań nazywa się reakcjami chemicznymi.
6. powstawanie wiazania jonowego W czasie powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje, a atom
pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony o różnoimiennych ładunkach, przyciągające się dzięki działaniu
sił elektrostatycznych, które w stanie stałym tworzą sieć jonową. Powszechnie znanym przykładem wiązania jonowego jest wiązanie
między jonem sodu i jonem chloru w chlorku sodowym Na+Cl- lub między jonami magnezu i chloru w chlorku magnezu Cl-Mg2+Cl-.
Poniżej przykłady przedstawiające mechanizm tworzenia wiązania jonowego w cząsteczkach NaCl
7. Wiązania kowalencyjne (atomowe) powstają, gdy łączą się z sobą atomy pierwiastków zaliczanych do niemetali. Mechanizm tworzenia
wiązania kowalencyjnego, podobnie jak i w wiązaniu jonowym tłumaczy się dążeniem atomów do przyjęcia konfiguracji najbliższego gazu
szlachetnego (reguła dubletu, oktetu). Skompletowanie oktetów (dubletu) w wiązaniu atomowym następuje poprzez uwspólnienie par
elektronowych.. Przykładem jest cząsteczka wodoru, w której dublet jest osiągany poprzez uwspólnienie dwóch elektronów pochodzących
od dwóch atomów wodoru.
8. wiązanie spolaryzowane, kowalencyjne wiązanie chemiczne między atomami różnych pierwiastków, w którym chmura elektronów
tworzących to wiązanie ma większą gęstość w pobliżu jednego z atomów (atomu pierwiastka chem. o większej elektroujemności).
9. Wiązanie metaliczne - ogólna nazwa dla wszelkich wiązań chemicznych występujących bezpośrednio między atomami metali.
Wiązania między atomami metalu, jeśli występują w izolowanej formie (np. w związkach metaloorganicznych) są w zasadzie typowymi
wiązaniami kowalencyjnymi, wyróżniają się jednak w stosunku do analogicznych wiązań między niemetalami dwiema istotnymi cechami:
ulegają one łatwiejszej polaryzacji pod wpływem np. pola elektrycznego ze względu na to, że ogólnie w metalach elektrony walencyjne są
słabiej związane z jądrami atomów niż w niemetalach
nawet jeśli formalnie są wiązaniami pojedynczymi, ze względu na występowanie w metalach dużej liczby walencyjnych orbitali d zachodzi
zjawisko ich nakładania się, co powoduje że wiązania te nabierają często charakteru częściowo wielokrotnego.
10. Związki o budowie jonowej maja wysokie temperatury wrzenia i topnienia. Po stopieniu lub w roztworach wodnych przewodzą prąd.
Związki jonowe nie są zbudowane z cząsteczek lecz różnoimiennych jonów, które wzajemnie się przyciągają, w krysztale NaCl nie ma
cząsteczek NaCl są natomiast przemiennie ułożone jony Na i Cl
11. wpływ rodzaju wiązania na właściwości związku chemicznego? Rodzaje wiązań chemicznych
występujące w związkach chemicznych mają decydujący wpływ na właściwości tych związków.
a) Wiązanie kowalencyjne Substancje mające wiązanie kowalencyjne w stałym stanie skupienia
tworzą kryształy cząsteczkowe, takie jak : SiH4 . Substancje te na ogół nie przewodzą prądu elektrycznego ( wyjątek -
grafit) i nie ulegają dysocjacji elektrolitycznej. Słabo rozpuszczają się w wodzie i alkoholu, natomiast dobrze
w benzynie czy benzenie. Reagują powoli, gdyż wiązanie kowalencyjne jest silnym wiązaniem Im większy
jest udział wiązania kowalencyjnego w tlenkach, tym bardziej kwasowy jest jego charakter.
b) Wiązanie jonowe. Wiązanie jonowe posiadają sole: NaCl, K2SO4. Związki te w stanie stałym
tworzą sieci jonowe w których nie ma cząsteczek, ani atomów, lecz ułożone naprzemianlegle jony
dodatnie i ujemne .Związki jonowe mają wysoką temperaturę topnienia , dobrze rozpuszczają się w wodzie .
Kryształy jonowe nie przewodzą prądu elektrycznego , ale stopione i rozpuszczone w wodzie
sole są dobrymi przewodnikami elektryczności . W roztworze związki te ulegają procesowi dysocjacji.
Im większy jest udział wiązania jonowego w związku - tlenku, czy wodorotlenku tym bardziej
zasadowy jest związek. c). Wiązanie metaliczne Substancje mające wiązanie metaliczne to metale. Charakteryzują się
one połyskiem i bardzo dobrym przewodnictwem elektrycznym i cieplnym. Są kowalne, ciągliwe można je obrabiać
mechanicznie. Nie roztwarzają się w wodzie , chociaż niektóre z nich gwałtownie z nią
reagują - sód. Mają wysokie temperatury topnienia, poza takimi pierwiastkami , jak: rtęć, gal, ind, grupa litowców
12.Jak powstaje wiązanie typu sigma ?Podaj przyklad
Wiązanie sigma, σ, kowalencyjne wiązanie molekularne powstałe w wyniku atomowych wzdłuż osi łączącej jądra
pierwiastków. Wiązanie tego typu występuje w wiązaniach pojedynczych, oraz jako składnik wiązań
wielkorotnych. Wiązania σ są znacznie silniejsze od wiązań π.
Wiązania pojedyńcze nazywane są wiazaniami sigma i oznacza się je grecką literą (sigma), skierowane
są wzdłuż prostej łączącej jadra dwóch atomów i tworzą się w wyniku osiowego przenikania (nakładania się) chmur
elektronowych dwóch orbitali: typu s (wiązanie s-s) w cząsteczce H2; typy p (wiazanie p-p) w czasteczce F2, Cl2, itp,
wiązanie s-p. Przykład HBr
13.Jak powstaje wiązanie typu pi?Podaj przykład
Wiązanie π - wiązanie chemiczne powstałe w wyniku nakładania bocznego orbitali atomowych (oprócz s). Kształt tego
wiązania wyznacza orbital molekularny π. Przy opisie wiązania π w indeksie dolnym lub po spacji podaje się jakie
orbitale tworzą dane wiązanie, np. πd-d, πp-p*, gdzie * oznacza orbital antywiążący.
14. Co to są wolne pary elektronowe? W jaki sposób wpływają one na budowe cząsteczki zwiazku chemicznego?
15. Jaki jest kształt chmury elektronowej dla par elektronowych o,pi,n
16. Podaj przykład cząsteczek z wiązaniami pi
17. Wyjaśnij budowę cząsteczki wody, zrób odpowiedni rysunek.
W cząsteczce wody następuje przesunięcie elektronów w stronę atomu tlenu. Powoduje to, że atom
tlenu ma pewien ładunek ujemny, a atomy wodoru odpowiadający mu ładunek dodatni. Ujemny ładunek
atomu tlenu przyciąga dodatnio naładowane atomy wodoru sąsiedniej cząsteczki i pomiędzy nimi powstaje
tak zwane wiązanie wodorowe. Mówimy, że cząstka wody jest polarna, czyli tworzy dipol.
Układ krystalograficzny: heksagonalny (lód) Moment dipolowy: 1,85 D
18. Wyjaśnij budowę cząsteczki dwutlenku węgla, zrób odpowiedni rysunek.
Cząsteczka dwutlenku węgla ma budowę liniową, atom węgla znajduje się w niej pomiędzy oboma atomami tlenu.
Tego rodzaju kształt cząsteczki wskazuje na hybrydyzację digonalną sp atomu węgla. Długość wiązania C - O,
wynosząca 116 pm i energia wiązania zbliżają się bardziej do odpowiednich wielkości dla wiązania potrójnego w CO
niż dla wiązania podwójnego, np. w HCHO. Układ krystalograficzny jak kwarc, Moment dipolowy zero D O=C=O
19. Co to znaczy że cząsteczka wody jest dipolem?
dalczego woda jest dipolem?- Cząsteczka wody jest dipolem ponieważ występuje u niej dwa
bieguny (+,-)Jest dipolem ponieważ ma budowę kątową to znaczy że kat miedzy wiązaniami wynosi
105. ładunki cząstkowe są niesymetrycznie ułożone, dlatego jest dipolem. Moment dipolowy >0 Dzięki
temu ze woda jest dipolem cząsteczki wody mogą się ze sobą łączyć,tworząc duże skupiska(osocjaty),
tworzą się wiązania typu dipol- dipol. Miedzy cząsteczkami wody tworzą się również wiązania wodorowe.
20. Przedstaw na odpowiednim wykresie zmiany energetyczne podczas nakładania się orbitali atomowych.
. Co to jest wiązanie wodorowe? Podaj odpowiedni przykład.Powstające pomiędzy atomem wodoru, na którym
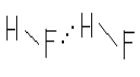
znajduje się ładunek dodatni, a wolną parą elektronową atomu pierwiastka o dużej elektroujemności (np. tlenu, azotu, fluoru)
np. wiązanie wodorowe pomiędzy cząsteczkami wody i fluorowodoru:
Wiązanie wodorowe polega na elektrostatycznym przyciąganiu się dipoli,
których biegunem dodatnim jest atom wodoru, a biegunem ujemnym atom pierwiastka silnie elektroujemnego.
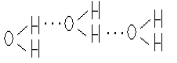
22. Jakie są właściwości substancjii, w których występują wiązania wodorowe?
Konsekwencją tworzenia się wiązań wodorowych między cząsteczkami jest ich łączenie się w większe zespoły - asocja Wiązania
wodorowe są odpowiedzialne za łączenie się pojedynczych cząstek wody w większe agregaty, co ma wpływ na właściwości
fizyczne, m.in. na stan skupienia Tw. się wiązań w. ma również istotny wpływ na konformację (kształt) makrocząsteczek białek
czy kw. Nukleinowych na właściwości biologiczne tych związków.Podstawowe znaczenie dla właściwości i budowy wody maja
wiązania wodorowe. Powodują one, że silnie oddziałujące między sobą cząsteczki H2O przechodzić w stan gazowy zaczynają
dopiero przy 100 C. Gdyby nie istnienie wiązań wodorowych cała woda na Ziemi znajdowała by się w postaci pary wodnej.
Również lód zawdzięcza swoje niezwykłe właściwości tym słabym oddziaływaniom. Każdy atom tlenu łączy się dwoma
wiązaniami kowalencyjnymi z atomami wodoru, oraz dwoma wiązaniami wodorowymi z sąsiednimi cząsteczkami
![]()
23. Wyjaśnij budowę wiązania podwójnego pomiędzy atomami węgla.
Wiąznie pomiędzy alkenami wiązanie typu - słąbe, łątwiej ulega rozerwaniu wiązanie typu G - trwałe
![]()
24. Wyjaśnij budowę wiązania potrójnego pomiędzy atomami węgla.
Wiąznie pomiędzy alkilami
25. Wyjaśnij budowę cząsteczki benzenu.
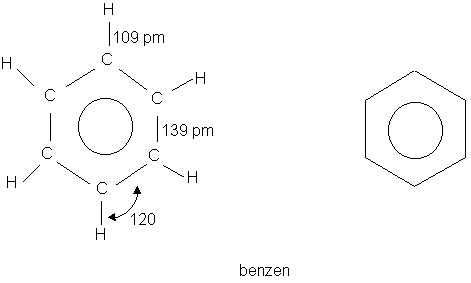
-Obecność w cząsteczce wiązania zdelokalizowanego zbudowanego
z sześciu elektronów (sekstetu elektronowego), Tworzy ono chmurę
elektronową nad i pod pierścieniem.
Rozmieszczenie elektronów w cząsteczce jest wypadkową obu struktur
granicznych i nie może być zapisane tylko za pomocą jednego wzoru.
26. Jakie rodzaje oddziałowywań mogą występować pomiędzy drobinami.
Odziałowywania międzycząsteczkowe: siły krótkiego zasięgu, siły długiego zasięgu
-siły przyciągania i odpychania wynikające z dodatniego łądunku jąder atomów i ujemnych łądynków elektronów
-siły van der waalsa
27. Opisz siły wzajemnego odziałowywania między cząsteczkami, tzw. siły van der Waalsa.
Specyfizna grupa sił przyciągania działąjących między ataomami lub cząsteczkami,siły te dzielą się na:
s. indukcyjne s. orientacyjne s. dyspersyjne s. konformacyjne i multopolowe
28. Odziałowywanie dyspersyjne.
są to oddziaływania między trwałym dipolem i wzbudzonym dipolem lub między dwoma wzbudzonymi dipolami.
W cząsteczkach, które nie posiadają trwałego momentu dipolowego, może on być wzbudzany przez cząsteczki z
trwałym momentem; następnie taki wzbudzony dipol i trwały dipol oddziałują na siebie podobnie jak dwa trwałe
dipole, tyle że znacznie słabiej. W cząsteczkach bez trwałego momentu dipolowego występują natomiast stochastyczne
fluktuacje ich chmur elektronowych, powodujące powstawanie chwilowych momentów dipolowych. Cząsteczka posiadająca
chwilowy moment dipolowy może go wzbudzić w cząsteczce sąsiadującej, wskutek czego obie cząsteczki mogą się nazwajem
chwilowo przyciągać lub odpychać. Uśrednienie sił odpychających i przyciągających daje w wyniku oddziaływanie przyciągające.
Oddziaływania van der Waalsa wynikają m.in. z korelacji ruchów elektronów pomiędzy oddziałującymi atomami - dlatego w
metodach obliczeniowych nieuwzględniających korelacji elektronowej sił tych praktycznie ni
29. Odziałowywanie indukcyjne.
Jon lub dipol trwały powoduje wyindukowanie momentu dipolowego w cząsteczce, która nie miała tych właściwości dipolowych.
Każda cząsteczka jest zbiorem ładunków elektrostatycznych dodatnich i ujemnych i gdy taki układ różnoimienny zostanie umieszczony
w polu elektrostatycznym nastąpi rozsunięcie ładunków elektrycznych.
Pojawi się wówczas indukowany moment dipolowy niezależnie od tego czy cząsteczka ma już moment dipolowy. Mówimy wtedy o tak
zwanych siłach indukcji - siły pomiędzy cząsteczką dipolową a inną cząsteczką.
30.Co to jest granica faz
obszar szczególny o swoistej strukturze, właściwościach fizycznych i chemicznych, na którym zachodzą szczególne zjawiska i procesy
(adsorpcja, rozproszenie światła, efekt fotoelektryczny, heterogeniczna kataliza reakcji chemicznych).
Układ granicy faz jest układem szczególnym, którego właściwości są funkcją struktury cząsteczek i ich właściwości elektrycznych, a co
za tym idzie oddziaływań międzycząsteczkowych. Obszar ten leży na styku przylegających do siebie faz i najważniejszą jego cechą jest
to, że zachodzi w nim nagła zmiana właściwości fizycznych lub chemicznych, charakterystycznych dla każdej z tych faz.
granica faz = powierzchnia graniczących faz = faza powierzchniowa = granica międzyfazowa = warstwa graniczna =obszar międzyfazowy
31. rozkład sił działających na cząsteczkę w głębi fazy i na granicy fazy.
32. czym zajmuje się termodynamika
Termodynamika - nauka o energii, dział fizyki zajmujący się badaniem energetycznych efektów wszelkich
przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych układów.
Wbrew rozpowszechnionym sądom termodynamika nie zajmuje się wyłącznie przemianami cieplnymi, lecz także
efektami energetycznymi reakcji chemicznych, przemian z udziałem jonów, przemianami fazowymi, a nawet
przemianami jądrowym i energią elektryczną.
33. Opis granicy faz:a) Dokładny, metody termodynamiki, posługujące się parametrami i funkcjami charakteryzujące
stan energetyczny układu, którym jest granica faz. b)Opis molekularny, biorący pod uwagę właściwości fizyczne
i chemiczne atomów i cząsteczek przejawiające się ich wzajemnym oddziaływaniem, aby lepiej poznać strukturę
i właściwości granicy faz (modele - zwykle uproszczone). Ze względu na stan skupienia kontaktujących
się faz obszar międzyfazowy może być utworzony przez: ciecz / gaz,, ciecz / ciecz,, ciecz /ciało,,, stałe ciało,,
stałe / gaz ,, ciało stałe / ciało stałe
34. Podstawowe wielkości opisujące termodynamiczny stan granicy faz: powierzchnia A [m2],
energia powierzchniowa (napięcie powierzchniowe) s [J/m2] ,,potencjał elektryczny y [V]
gęstość ładunku powierzchniowego q stężenie powierzchniowe G = ni / A [mol/m2]
35. co to jest napięcie powierzchniowe i międzyfazowe
Napięcie powierzchniowe - zjawisko fizyczne występujące na styku powierzchni cieczy z ciałem stałym,
gazowym lub inną cieczą. Polega na powstawaniu dodatkowych sił działających na powierzchnię cieczy w
sposób kurczący ją (dla powierzchni wypukłej przyciągający do wnętrza cieczy, dla wklęsłej odwrotnie).
Zjawisko to ma swoje źródło w siłach przyciągania pomiędzy molekułami cieczy. Występuje ono zawsze na
granicy faz termodynamicznych, dlatego zwane jest też napięciem międzyfazowym.
Efektem napięcia powierzchniowego jest np. utrudnione zanurzanie w cieczy ciał niepodatnych na zwilżanie tą
cieczą (znika ono w momencie całkowitego zanurzenia takiego ciała). Innym zjawiskiem związanym z napięciem
powierzchniowym jest podnoszenie się (np. woda) lub opadanie (np. rtęć) cieczy w wąskich rurkach, tzw. kapilarach
- zjawisko to należy do zjawisk kapilarnych.
Napięcie międzyfazowe, w fizykochemii, praca potrzebna do izotermicznego, odwracalnego wytworzenia jednostkowej
powierzchni rozdziału dwóch faz (np. cieczy i ciała stałego).
Miarą napięcia międzyfazowego jest stosunek pracy do powierzchni, jednostką w układzie SI jest J/m2 lub N/m.
Mikroskopowo napięcie międzyfazowe wynika z różnicy sił oddziaływań międzycząsteczkowych w obu fazach.
36. Na czym polega proces adsorpcji:
Adsorpcja jest to proces zachodzący na granicy dwóch faz, w wyniku którego stężenie substancji na granicy faz
jest większe (adsorpcja dodatnia) lub mniejsze (adsorpcja ujemna) niż w głębi fazy. (zjawisko powierzchniowe
polegające na samorzutnym gromadzeniu się cząsteczek na powierzchni granicy faz)
Adsorpcja może zachodzić na granicach faz: ciecz / gaz ,ciało stałe / gaz, ciało stałe / ciecz , ciecz / ciecz
37. Co to jest izoterma adsorpcji Izoterma adsorpcji to związek ilości zaadsorbowanej substancji i stężenia lub ciśnienia
adsorbatu przy ustalonej temperaturze
38. Co to są Substancje powierzchniowo czynne:
powierzchniowo czynne substancje, surfaktanty, grupa związków chem., których cząsteczki są zbudowane z 2
elementów o przeciwnym powinowactwie do wody — z części hydrofobowej (małe powinowactwo do wody) oraz
części hydrofilowej (duże); dzięki temu rozpuszczalne w wodzie cząsteczki s.p.cz. gromadzą się na powierzchni
zetknięcia roztworu z fazą gazową (powietrze), ciekłą (np. olej) lub stałą (powierzchnia naczynia, tkaniny itp.);
obniża to napięcie powierzchniowe na granicy faz lub zmienia ładunek powierzchniowy i dzięki temu s.p.cz.
wykazuje właściwości emulgujące, myjące i piorące.
39. Klasyfikacja substancji powierzchniowo czynnych:
1. Jonowe (dysocjujące), a wśród nich: a) anionowo czynne - część powierzchniowo czynną stanowi anion
cząsteczki; to te, w których część powierzchniowo czynną stanowi ujemnie naładowana grupa hydrofilowa, a więc
anion dysocjującej na jony cząsteczki. Do tej grupy związków należą: mydła, siarczany alkilowe, niektóre sulfoniany
alkilowe i alkilo- arylosulfonowe oraz saponiny.
b) kationowe czynne - część powierzchniowo czynną stanowi kation cząsteczki; związki, w których część hydrofobowa,
nie łącząca się z wodą związana jest dodatnio naładowaną grupą hydrofilową. Typowymi ich przedstawicielami są
czwarto-rzędowe zasady amoniowe zwane również mydłami inwertowanymi.
c) amfoteryczne - w zależności od pH część powierzchniowo czynna może przyjmować postać
kationu lub anionu. Należą do nich anionowe i kationowe czynne lecytyny i proteiny.
2. Niejonowe (niedysocjujące).Np. alkohole, estry, eteroestry kwasów tłuszczowych i hydroksy-kwasów karboksylowych
oraz cukrów wielowodoro-tlenowych. Najbardziej znanymi są spany i tweeny.
40. Na czym polega zjawisko micelizacjiMicelizacja to proces polegający na rozdrobnieniu substancji rozpuszczalnych
jedynie w tłuszczach do postaci łatwo przyswajalnej przez środowisko wodne organizmu. Dzięki temu organizm może
wykorzystać odżywcze właściwości danej substancji. Jako że system transportu substancji w ciele "opiera się na wodzie",
przyswajanie substancji rozpuszczalnych w tłuszczach jest utrudnione Organizm z pomocą kwasu żółciowego i innych
substancji trawiennych, buduje tzw. micele do których dołączane są substancje rozpuszczalne w tłuszczach w celu ich
wchłonięcia. Wskaźnik wchłonięcia jest tu dość niski - 25 - 30%.
Przy pomocy micelizacji substancji rozpuszczalnych w tłuszczach mogą zostać wytworzone najmniejsze micele już w
produktach spozywczych, które łatwiej dostarczą organizmowi witaminy rozpuszczalne w tłuszczach. W porównaniu z
witaminami syntetycznymi witaminy zmicelizowane wchłaniają się 5-cio krotnie efektywniej. Micelizacja owoców i
warzyw powoduje, że witaminy rozpuszczalne znajdujące się w nich, także przyswajane sią o wiele łatwiej jak w produktach
niemicelizowanych.
41. Jak zbudowane są micele i jakie są właściwości roztworów micelarnych?
Micele to cząstki występujące w trwałych emulsjach. Tworzą je związki chemiczne o własnościach amfifilowych.
Micele są kulistymi tworami zawierającymi od kilkudziesięciu do kilkuset cząsteczek.
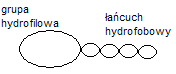
42. Budowa cząsteczki substancji powierzchniowoczynnej.
Substancje te posiadają w cząsteczce długi łańcuch hydrofobowy
oraz grupę polarną (hydrofilową). Grupy polarne: anionowe
(gr. naładowana ujemnie); Kationowe(dodatnio);
Amfoterycznie(zawierają równocześnie gr. kationową i anionową)
43. Właściwości roztworów substancji powierzchniowoczynnych.- obniżanie napięcia powierzchniowego
- możliwość tworzenia micel (Po utworzeniu micel nie ma miejsca zmniejszenie napięcia powierzchniowego roztworu)
- solubilizacja - wł. Rozpuszczania substancji organicznych
44. Właściwości pianotwórcze związków powierzchniowoczynnych.
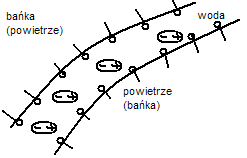
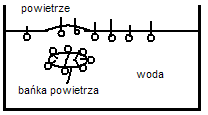
45. Stabilizacja emulsji.Polega na zwiększeniu hydratacji powierzchni kropelek emulsji, co może być wywołane
albo przez nadanie powierzchni kropelek ładunku elektrycznego (adsorpcja jonów RCOO-), albo też przez pojawienie
się na powierzchni grup hydrofilowych (RCOOH, ROH).
46. Co to jest EWP?Elektryczna warstwa podwójna - charakterystyczny rozkład ładunku elektrycznego na
granicy faz, np. na granicy ciało stałe-ciecz.
47. Rodzaje roztworów ze względu na: stan skupienia, stężenie, stopień rozdrobnienia substancji rozpuszczonej,
efekt po dodaniu substancji rozpuszczonej.Układ gruboziarnisty, koloid, roztwór właściwy.
48. Jaka jest różnica pomiędzy adsorpcją chemiczną a adsorpcją fizyczną?
W przypadku adsorpcji fizycznej siły działające mają charakter słabych oddziaływań międzycząsteczkowych
(siły Van der Waalsa), natomiast w przypadku chemisorpcji - znacznie silniejszych oddziaływań chemicznych.
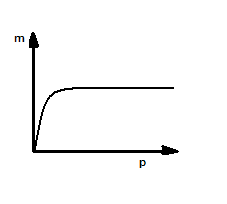
49. Izoterma adsorpcji Freundlicha.
Izoterma adsorpcji fizycznej, opisywana empirycznym równaniem adsorpcji:
m=k*pn m - masa gazu zaabsorbowana przez jednostkę adsorbentu
p - ciśnienie gazu n - współczynnik empiryczny c - stężenie
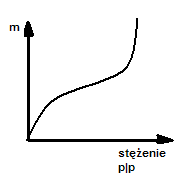
60.Browna ruchy, chaotyczne przesunięcia cząstek koloidalnych zawiesiny w cieczy lub gazie, wywołane
zderzeniami z cząsteczkami fazy rozpraszającej, wykonującymi ciągłe bezwładne ruchy cieplne. Ruchy Browna
są tym intensywniejsze, im mniejsza jest lepkość cieczy i rozmiary cząstek zawiesiny oraz im wyższa jest jej
temperatura.
61.liofobowe:otzrymywaie metodą dyspersji lub kondensacji; struktura:zespoły cząsteczek;stężenie
fazy rozproszonej:na ogol nieznaczne;ruchy Browna wystepują wyraźnie;efekt Tyndalla:wyraźy;często
zabarwione;cząstki zawsze naładowane;nieznaczna lepkość;duża wrażliwość na elektrolit.Liofilowe:
otrzymywanie przez zwykłe rozpuszczanie,; struktura:cząsteczki olbrzymy;stężenie fazy rozproszonej
może być duże;ruchy Browna często bardzo wyraźne;efekt Tyndalla-niewyraźny;często bezbarwne;ładunek
nieznaczny lub brak;znaczna lepkość;mała wrażliwość na elektrolit
62.Koloidy cząsteczkowe stanowią układy fizycznie jednorodne i rozpuszczają się samorzutnie w
odpowiednich rozpuszczalnikach. W przeciwieństwie do koloidów fazowych cząsteczka koloidalna
jest cząsteczka chemiczną (tzw. makrocząsteczką), charakter koloidalny jest wynikiem budowy chemicznej.
Do koloidów cząsteczkowych należą: białko, żelatyna oraz polimery.
63. Koloidy fazowe charakteryzuje to, że cząsteczka koloidalna nie jest cząsteczka chemiczną substancji.
Powierzchnia cząsteczki jest siedliskiem ładunku elektrycznego a to z kolei warunkuje pewne cechy
charakterystyczne jak np. uleganie koagulacji pod wpływem małych ilości elektrolitów. Co prawda
agregacja, jak i dezagregacje cząsteczek fazy rozproszonej prowadzi do powstania nowych cząsteczek
jednak są one o jednakowym charakterze chemicznym. Do koloidów fazowych zaliczamy: sole metali
szlachetnych (Au, Ag, Pt) oraz uwodnione tlenki metali
64. Koloidy asocjacyjne (micelarne) składają się z cząsteczek powstałych przez asocjację cząsteczek
substancji rozpuszczonej. W koloidach asocjacyjnych zachodzi równowaga między pojedynczymi
cząsteczkami, a ich zespołami, charakter ten zależy od temperatury i stężenia roztworu. Do koloidów
asocjacyjnych zaliczamy oleinian sodu, mydła i garbniki w roztworach wodnych.
65.Równowaga chemiczna to taki stan układu złożonego z produktów i substratów dowolnej reakcj
i odwracalnej, w którym szybkość powstawania produktów jest równa szybkości ich rozpadu
66.Kinetyka reakcji chem - zajmuje się badaniem przebiegu reakcji chemicznej w czasie;Kinetyka
zajmuje się przewidywaniem zmian stężeń substratów i produktów reakcji chemicznych w czasie,
badaniem szybkości reakcji, wpływu rozmaitych czynników na tę szybkość i ogólnie przebiegiem całej
reakcji. Zbadanie danej reakcji od strony kinetycznej polega zazwyczaj na ustaleniu zależności tempa
powstawania produktów (i ubytku substratów) od temperatury, ciśnienia, rodzaju rozpuszczalnika,
rodzaju i stężenia katalizatora oraz wyjściowych proporcji substratów. Uzyskane dane mogą pozwolić
na wyznaczenie stałych szybkości reakcji i sformułowanie matematycznego równania kinetycznego reakcji
oraz na ustalenie mechanizmu reakcji.
67. Prawo działania mas zwane prawem Guldberga i Waagego;brzmi: Szybkość reakcji chemicznej
jest proporcjonalna do efektywnego stężenia wszystkich uczestniczących w niej reagentów. Jest to
fundamentalne prawo, stanowiące podstawę współczesnej kinetyki chemicznej i wszelkich obliczeń
uwzględniających fakt występowania równowagi reakcji chemicznych.
68.reguła przekory-Jeżeli w układzie stan równowagi zostanie zakłócony, to rozpocznie się w nim
taka przemiana, która przeciwdziałać będzie zakłóceniom i doprowadzi do ponownego osiągnięcia stanu
równowagi. Oznacza to w praktyce, że na przykład: zwiększenie stężenia substratu lub zmniejszenie
stężenia produktu powoduje przesunięcie równowagi w prawo, czyli w kierunku tworzenia produktów,
Wyszukiwarka
Podobne podstrony:
entomologia egzamin- zagadnienia, STUDIA, Entomologia
egzamin - zagadnienia, Studia ZiIP GiG AGH, Magisterskie, Zarządzanie strategiczne
Chemia egzamin pomoc, STUDIA, WL, Uniwersytet Rolniczy Wydział Leśny, Chemia
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
zagadnienie 3, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
zagadnienie 9, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
Zagadnienie16, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egz
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
tos2-2013d, Studia, chemia egzaminy
egz.42, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
Ad 7, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
tos2-2014a, Studia, chemia egzaminy
Pytania i odpowiedzi na egzamin, Budownictwo - studia, I stopień, I rok, Chemia
Zagadnienia egzaminacyjne-prawo[1], Studia, Prawo, Egzamin
MSM zagadnienia egzaminacyjne II, ★ Studia, Bezpieczeństwo Narodowe, Międzynarodowe stosunki militar
Chemia ogólna - egzamin - ściąga3, studia ochrony środowiska, Chemia ogólna
więcej podobnych podstron