Ćwiczenie 10
Kinetyka reakcji: wyznaczanie stałej szybkości reakcji bez katalizatora
i z katalizatorem.
Celem ćwiczenie jest wyznaczenie stałych szybkości reakcji utleniania jonów tiosiarczanowych (S2O32-) za pomocą jonów żelaza(III) Fe3+ bez katalizatora i z katalizatorem.
Reakcja przebiega według równania sumarycznego:
2Fe3+ + 2S2O32- → 2Fe2+ + S4O62-
W rzeczywistości reakcja przebiega w dwóch etapach
I. Fe3+ + S2O32- → FeS2O3+ etap powolny
II. FeS2O3+ + FeS2O3+ → 2Fe2+ + S4O62- etap szybki
Ponieważ szybkości całego procesu decyduje etap najwolniejszy sumaryczna szybkość reakcji jest określona przez szybkość etapu I, który jest reakcją drugiego rzędu.
Równanie kinetyczne przybiera zatem postać:
![]()
Oznaczając początkowe stężenie [Fe3+] jako a, natomiast stężenie [S2O32-] jako b oraz stężenie produktu reakcji w czasie t jako x otrzymujemy:
![]()
Po scałkowaniu tego równania otrzymujemy:
![]()
Reakcja jonów żelaza(III) z jonami tiosiarczanowymi katalizowana jest przez jony miedzi(II). Szybkość reakcji w obecności jonów miedzi jest proporcjonalna do ich stężenia.
Tak więc równanie kinetyczne przyjmuje postać:
![]()
Ponieważ stężenie katalizatora podczas reakcji jest stałe, iloczyn stałej szybkości k i stężenia jonów miedzi(II) [Cu2+] też jest stały. W miejsce k · [Cu2+] można wstawić k' i uprościć równanie kinetyczne:
![]()
Postęp reakcji śledzony jest poprzez pomiar stężenia jonów Fe3+, które tworzą barwny związek kompleksowy z jonami rodanowymi SCN- dodanymi do mieszaniny reakcyjnej. Barwa tego kompleksu jest intensywnie czerwona a w miarę przebiegu reakcji ubywa jonów żelaza(III) reagujących z jonami tiosiarczanowymi i roztwór staje się coraz bledszy. Stężenie określane jest metodą spektrofotometryczną poprzez pomiar absorbancji roztworu.
CZĘŚĆ PRAKTYCZNA
1. Wyznaczanie molowego współczynnika absorpcji rodanowego kompleksu żelaza(III).
Do kolbki o pojemności 50 cm3 wlać kolejno:
- 5 cm3 roztworu FeCl3 o stężeniu 2,3 · 10-3 mol/dm3
- 10 cm3 KSCN o stężeniu 0,25 mol/dm3
Następnie uzupełnić roztwór w kolbce wodą destylowaną do kreski.
Zmierzyć absorbancję roztworu w zakresie pomiarowym 430-470 nm co 5 nm, stosując wodę destylowaną jako odnośnik. Odczytać długość fali, przy której występuje maksimum absorbancji dla tego kompleksu.
Obliczyć molowy współczynnik ekstynkcji dla λmax ze wzoru:
![]()
2. Wyznaczanie stałej szybkości reakcji bez katalizatora.
Do kolbki o pojemności 50 cm3 wlać kolejno roztwory:
- 5 cm3 roztworu FeCl3 - 2,3·10-3 mol/dm3
- 10 cm3 roztworu KSCN - 0,25 mol/dm3
- 10 cm3 roztworu Na2S2O3 - 6·10-3 mol/dm3
Następnie SZYBKO uzupełnić roztwór w kolbce wodą destylowaną do kreski.
Po wymieszaniu roztworu w kolbce wlać do kuwetki i mierzyć absorbancję po upływie ustalonego czasu z zakresu 10 - 30 min. przy długości fali ustalonej w punkcie 1. stosując wodę jako odnośnik.
3. Wyznaczanie stałej szybkości reakcji z katalizatorem.
Do kolbki o pojemności 50 cm3 wlać kolejno roztwory:
- 5 cm3 roztworu FeCl3 - 2,3 · 10-3 mol/dm3
- 10 cm3 roztworu KSCN - 0,25 mol/dm3
- 5 cm3 roztworu CuSO4 - 5 · 10-5 mol/dm3
- 10 cm3 roztworu Na2S2O3 - 6 ·10-3 mol/dm3
Następnie uzupełnić roztwór w kolbce wodą destylowaną do kreski.
Po wymieszaniu roztworu w kolbce wlać do kuwetki i mierzyć absorbancję po upływie takiego samego czasu jak w punkcie 2. przy ustalonej długości fali w punkcie 1. stosując wodę jako odnośnik.
Opracowanie wyników
Obliczyć molowy współczynnik absorpcji (ε) dla rodankowego kompleksu żelaza(III)
korzystając z równania:
![]()
gdzie:
A -absorbancja roztworu
c- stężenie molowe jonów żelaza (III) [2,3 · 10-3 mol/dm3]
l - grubość kuwety (1 cm)
Obliczyć dla każdego czasu aktualne stężenie jonów żelaza (III)
![]()
gdzie:
a - początkowe stężenie jonów żelaza(III) [2,3 · 10-3 mol/dm3]
x - stężenie produktu reakcji [mol/dm3]
a następnie wartość x ze wzoru:
![]()
3. Obliczyć dla każdego czasu aktualne stężenie jonów S2O32-
[S2O32-] = b - x
gdzie:
b - początkowe stężenie jonów S2O32 [6,0 · 10-3 mol/dm3mol/dm3]
a - początkowe stężenie jonów żelaza(III) [2,3 · 10-3 mol/dm3]
Obliczyć wartości stałych szybkości reakcji dla reakcji bez katalizatora i z katalizatorem korzystając z równania:
![]()
Po podstawieniu stałych wartości a i b
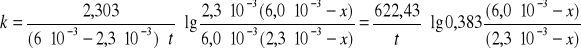
otrzymujemy ostateczny wzór pozwalający obliczyć wartość k z katalizatorem i bez katalizatora
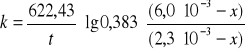
Otrzymane wyniki należy umieścić w tabeli
Czas [min] |
ABSORBANCJA A |
[Fe3+] [mol/dm3] |
[S2O32-] [mol/dm3] |
k/k' [mol-1· dm3· min] |
Reakcja bez udziału katalizatora |
||||
|
|
|
|
|
Reakcja z udziałem katalizatora |
||||
|
|
|
|
|
Każda para wykonująca ćwiczenie ustala własny czas reakcji (10 - 30 min.), jednakowy dla reakcji bez udziału katalizatora i z katalizatorem. Pomiar można wykonać kilka razy dla różnego czasu.
Katedra i Zakład Chemii Medycznej
- 2 -
Wyszukiwarka
Podobne podstrony:
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
Ćwiczenie 10 (2), Towaroznawstwo SGGW, Rok I, Semestr I, fizyka, Fizyka, Fizyka - coś, ćwiczenia, Op
10. Etery, studia, I rok, chemia, organiczna
sciaga kinetyka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA
10.Reakcje zobojętniania, Chemia ogólna ćwiczenia
Ch w2 13.10 (Naprawiony), Studia (Geologia,GZMIW UAM), I rok, Chemia
WNIOSKOWANIE STATYSTYCZNE 12.10.2013, IV rok, Ćwiczenia, Wnioskowanie statystyczne
Podział mieszanin chemicznych, Science ^^, Farmacja, 1 rok, Chemia, ćwiczenia, Semestr II
WNIOSKOWANIE STATYSTYCZNE 26.10.2013, IV rok, Ćwiczenia, Wnioskowanie statystyczne
Ch w1 6.10, Studia (Geologia,GZMIW UAM), I rok, Chemia
Chemia fizyczna 18-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 10
Ćwiczenie1 10, TiR UAM II ROK, Informatyka
cwiczenie11, Płyta farmacja Poznań, II rok, chemia analityczna, ćwiczenia
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
Biologia i Ekologia I ROK IŚ ćwiczenie 6, ĆWICZENIE 9, 10
Test z ćwiczeń 7-10, rok numer trzy, tpl, kolokwia
Ćwiczenie 9a, Studia, I rok, Chemia ogólna i nieorganiczna
cwiczenia 9 i 10 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczen
więcej podobnych podstron