KOROZJA METALI I
Przebieg doświadczenia
Doświadczenie polega na przeprowadzeniu procesu rdzewienia żelaza. Do dwóch zlewek wlano po 100 mln roztworu o składzie 3% NaCl, oraz 3% H2 O2. Następnie zanurzono w nich płytkę ze stali nierdzewnej, oraz płytkę ze stali zwykłej. Płytki te zostały uprzednio oczyszczone papierem ściernym, odtłuszczone w metanolu, opłukane wodą destylowaną oraz osuszone bibułą po wykonaniu tych czynności zwarzono płytki z dokładnością do 0,001g. Po czasie 45 min płytki opłukano wodą, osuszono bibułą i ponownie zwarzono.
Wynik doświadczenia
Waga płytki przed zanurzeniem w roztworze |
Waga płytek po czasie 45 min |
||
Stal nierdzewna |
13,314g |
Stal nierdzewna |
13,284g |
Stal rdzewna |
8,287g |
Stal rdzewna |
8,290g |
Wyniki doświadczenia z płytka ze stali nierdzewnej: wykazuje, że zwiększyła swoją wagę. Taki wynik doświadczenia był prawdopodobnie spowodowany niedokładnością wykonania pomiarów w warunkach laboratoryjnych. Możliwe iż płytka ze stali była źle osuszona, co mogło być przyczyną takiego wyniku. Przypuszczalnie jednak można wykazać, że płytka ze stli nierdzewnej nie powinna zmienić swojej wagi.
Wyniki doświadczenia z płytka ze stali zwykłej: nastąpił ubytek masy. Roztwór uległ zaciemnieniu a na płytce pojawił się nalot o żółtej barwie. Na płytce tej nastąpiło zjawisko określane jako korozja lokalna, w której tylko niektóre części powierzchni metalu ulegają zniszczeniu.
Zachodzące reakcje: Na płytce zaszło zjawisko reakcji katodowej i przebiegającej w tym samym czasie reakcji anodowej.
Reakcja anodowa - utlenianie - związana z rozpuszczeniem się metalu
Fe Fe2+ + 2e -
Reakcja katodowa - redukcja - związana ze zużyciem czynnika podtrzymującego proces katodowy - tlen rozpuszczonego w wodzie:
Reakcja w elektrolicie
Fe2+ + 2OH - Fe(OH)2
Powstawanie wodorotlenku żelaza
Fe(OH)2 + ½ O2 + (n-2)H2 Fe3O3 * nH2O
W procesie tym wodorotlenek żelazawy w wyniku działania tlenu, utlenia się do hydratu tlenku żelaza trójwartościowego, czyli rdzy.
Cel doświadczenia
Doświadczenie polegało na wykonaniu oksydowego ogniwa stężeniowego. W tym celu wykonania doświadczenia, na oczyszczoną i odtłuszczoną w metanolu płytkę ze stali zwykłej naniesiono kilka kropel wskaźnika stężeniowego.
Wyniki: W kropli następował zmiana barwy. Spowodowane to było związkami zawartymi we wskaźniku ferroksylowym.
Żelazocyjanek potasowy strąca niebieski osad z jonami żelaza dwuwartościowego
Fenoloftaleina (wskaźnik kwasowo - zasadowy) zabarwia się na czerwono w obecności jonów wodorotlenowych
W głębi kropli zaobserwowano niebieskie zabarwienie a po pewnym czasie na obrzeżach kropli zabarwienie zmieniło się na granatowe, by po czasie stać się lekko malinowe.
Takie wyniki doświadczenia wskazują, iż otrzymaliśmy tlenowe ogniowo stężeniowe.
Proces ten jest spowodowany nierównomiernym natlenianiem roztworu stykającego się z różnymi partiami przedmiotu, powodując powstanie różnicy potencjałów.
Zachodzące reakcje: Na obrzeżach kropli było więcej jonów tlenu i tam miała miejsce reakcja katodowa.
½ O2 + H2 O + 2e - 2OH -
Środek kropli jest
miejscem, w którym stężenie jonów tlenu jest mniejsze ( droga dyfuzji tlenu jest dłuższa), co powoduje, że fragmenty powierzchni stykają się z elektrolitem spełniają rolę obszarów anodowych i żelazo ulega rozpuszczeniu.
Fe Fe2+ + 2e -
W elektrolicie w wyniku zachodzących reakcji, dochodzi do powstania rdzy (wodorotlenek żelazawy w wyniku działania tlenu, utlenia się do hydrantu tlenku żelaza trójwartościowego).
Fe2+ + 2OH - Fe(OH)
Fe(OH)2 + ½ O2 + (n-2)H2 Fe3O3 * nH2O
Cel doświadczenia
Polegało na wyznaczeniu potencjałów elektrod Fe, Cu, Ni,Al.
Po mechanicznym oczyszczeniu i odtłuszczeniu wyżej wymienionych płytek zbudowano z nich kolejno i z elektrody kalomelowej ogniwo wg schematu:
mV
ELEKTRODA PŁYTKA
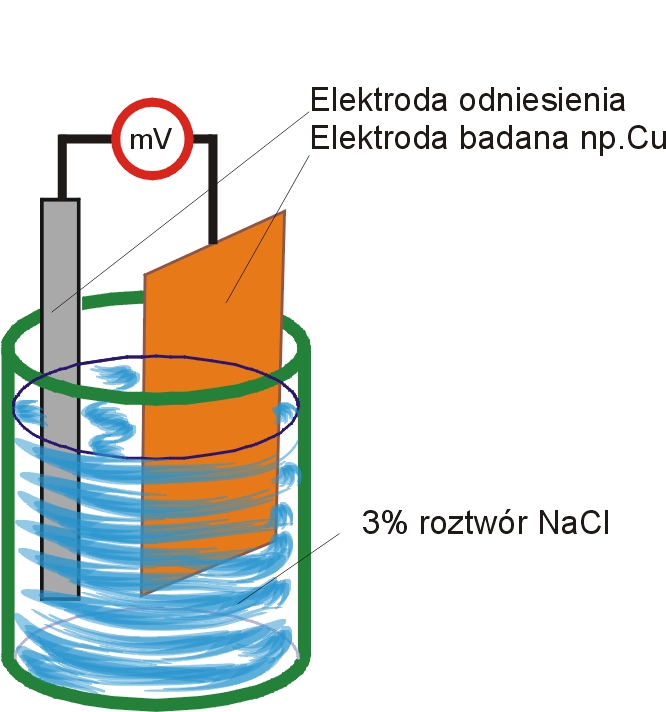
KALOMELOWA METALOWA
Zadanie polegało na mierzeniu siły elektromotorycznej (SEM) tak zbudowanych elektrod co 15 sekund od momentu zanurzenia elektrod w roztworze 3% NaCl w czasie 4 minut
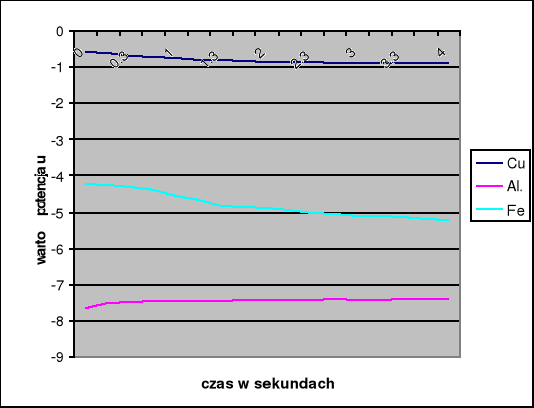
Wyniki odczytów zestawione w tabeli poniżej:
czas |
Cu |
Al |
Fe |
0,00 |
-058 |
-766 |
-422 |
0,15 |
-061 |
-750 |
-425 |
0,30 |
-070 |
- 747 |
-430 |
0,45 |
-073 |
-746 |
-440 |
1,00 |
-076 |
-745 |
-453 |
1,15 |
-079 |
-744 |
-466 |
1,30 |
-080 |
-744 |
-484 |
1,45 |
-083 |
-743 |
-487 |
2,00 |
-085 |
-743 |
-490 |
2,15 |
-085 |
-743 |
-496 |
2,30 |
-086 |
-742 |
-500 |
2,45 |
-087 |
-739 |
-505 |
3,00 |
-087 |
-741 |
-509 |
3,15 |
-088 |
-741 |
-511 |
3,30 |
-087 |
-740 |
-513 |
3,45 |
-087 |
-739 |
-518 |
4,00 |
-088 |
-738 |
-521 |
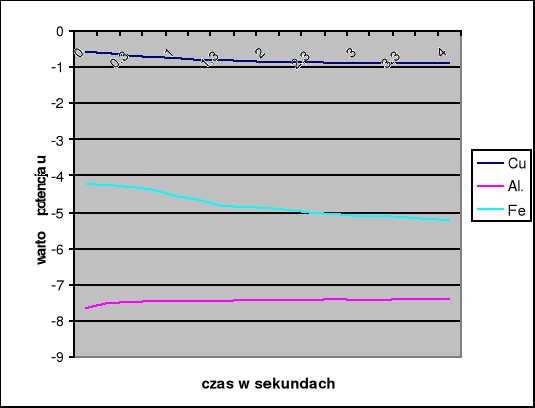
Należy teraz wyznaczyć potencjały normalne metali względem normalnej elektrody wodorowej. W tym celu korzystamy ze wzoru:
E = E1 - E2
Gdzie:
E1 - potencjał elektrody dodatniej
E2 - potencjał elektrody ujemnej
Potencjał elektrody kalomelowej: +0,249 V
GLIN (Al)
KATODA - elektroda kalomelowa
ANODA - płytka glinu
E =
E2 = E1 - E
E2 =
MIEDŹ (Cu)
KATODA - płytka miedzi
ANODA - elektroda kalomelowa
E =
E1 = E2 + E
E1 =
ŻELAZO (Fe)
KATODA - elektroda kalomelowa
ANODA - płytka żelaza
E =
E2 = E1 - E
E2 =
Rodzaj płytki |
Otrzymany potencjał normalny (V) |
Wzorcowy potencjał normalny (V) |
Cu |
|
|
Al |
|
|
Fe |
|
|
1
1
Wyszukiwarka
Podobne podstrony:
LABORKI OPRACOWANE DOŚWIADCZENIA, 2007.12.15 Twardość wody, Protokół z ćwiczenia 1
LABORKI OPRACOWANE DOŚWIADCZENIA, 2007.11.24 Błonotwórcze, CHEMIA BUDOWLANA
choroby trzustki i watroby 2008 2009 (01 12 2008)
Japonia wycofa się z Iraku do końca roku (01 12 2008)
Wykłady Maćkiewicza, 2008.01.23 Językoznawstwo ogólne - wykład 12, Językoznawstwo ogólne
Ostra i przewlekła biegunka u dzieci 01 12 2008 Kopia
Mapy polityczne konturowe, 2008 01 29 12 51 mapa polityczna azji A4
choroby trzustki i watroby 2008 2009 (01 12 2008)
Japonia wycofa się z Iraku do końca roku (01 12 2008)
2008 01 15 godz 12 LH
2008 01 16 godz 12 LH
2008 01 16 godz 12 HL
więcej podobnych podstron