Anomalna rozszerzalność wody
Ćwiczenie nr 29
Opis teoretyczny
Budowa wszystkich ciał makroskopowych jest cząsteczkowa, przy czym owe cząsteczki są w ciągłym ruchu i oddziaływają między sobą pewnymi siłami. Siły oddziaływania międzyatomowego są odpowiedzialne za powstawanie cząsteczek. Siły oddziaływania miedzy cząsteczkami prowadzą do tworzenia się struktur wielomolekularnych, w szczególności do powstania ciał stałych i cieczy. Zbliżanie do siebie atomów powoduje pojawienie się sił przyciągających, które najpierw wzrastają w miarę zmniejszania odległości miedzy jądrami atomów, a potem zmniejszają się aż w końcu przechodzą w siły odpychające. Gdy siła oddziaływania jest zerowa dla pewnej odległości r oraz energia potencjalna osiąga minimalną wartość cząstka jest w stanie równowagi trwałej. Ową odległość r nazywamy długością wiązania atomowego. Ze względu na strukturę wiązań możemy wyróżnić wiązania jonowe (powstają w wyniku przyciągania się elektrostatycznego) oraz kowalencyjne (powstaje dzięki 2 elektronom - po jednym z każdego atomu - ale jako para należą jednocześnie do jednego jak i drugiego atomu).
W przypadku cząsteczki wody atomy wodoru połączone są z atomem tlenu wiązaniem kowalencyjnym. W cząsteczce wody ładunek ujemny jest przesunięty w kierunku atomu tlenu (większa zdolność przyciągania elektronów przez atomy tlenu), a co za tym idzie - ładunek dodatni jest przesunięty w kierunku atomów wodoru. W rezultacie cząsteczka wody ma charakter dipolowy (o określonym momencie dipolowym).
W cieczach odległości między cząsteczkami są porównywalne z ich wymiarami, dlatego ważne są też oddziaływania między cząsteczkowe. W wodzie występują tzw. siły van der Wallsa. Są to siły międzycząsteczkowe w krysztale, mające tę samą naturę co siły przyciągania się cząsteczek w gazach.
W przypadku wody, elektrycznie spolaryzowane cząsteczki łączą się z sąsiednimi cząsteczkami wiązaniami wodorowymi (słabe wiązanie tworzące mostek wodorowy). Przyjmuje się, że struktura wody ma charakter kwazikrystaliczny (zmienny w czasie), o uporządkowaniu bliskim względem najbliższych sąsiadów. Woda zawiera cząsteczki swobodne, ale również grupy cząsteczek powiązanych ze sobą wiązaniami wodorowymi. Te właśnie wiązania wodorowe są odpowiedzialne za oddziaływania cząsteczek i za szczególne właściwości wody i lodu. Większość cieczy zwiększa swoją objętość wraz ze wzrostem temperatury. Woda jest jednak wyjątkiem. Powyżej 4![]()
zachowuje się „normalnie” jednak w zakresie temperatur od 0![]()
do 4![]()
kurczy się aby w temperaturze 4![]()
mieć najmniejszą objętość (największą gęstość). Wynika z tego, że obniżając temperaturę woda rozszerza się. Jest to skutkiem asocjacji (łączenia się) cząsteczek wody, w wyniku czego w temperaturze 0![]()
tworzy się heksagonalna struktura lodu z dużymi otwartymi przestrzeniami między ściankami kryształu. Konsekwencją takich procesów jest zwiększenie objętości wody o około 10%. W czasie topnienia wiązania wodorowe pękają a kryształki przechodzą w stan ciekłej wody.
OPIS DOŚWIADCZENIA
Aby wykonać nasze doświadczenie posłużyliśmy się aparaturą przedstawianą na poniższym rysunku.
Na początku sporządziliśmy mieszaninę chłodzącą z 450g rozdrobnionego lodu oraz z 40g soli. Naczyńko z wodą destylowaną umieściliśmy w mieszaninie chłodzącej, a następnie położyliśmy na mieszadle magnetycznym.
Gdy temperatura wody w naczyńku osiągnęła 11°C rozpoczęliśmy pomiar zależności wysokości słupa wody w kapilarze od temperatury. Doświadczenie przeprowadzaliśmy dopóty woda destylowana nie osiągnęła 0°C. Wyniki pomiarowe znajdują się na pierwszej stronie oraz na Rysunku 1 (ochładzanie) i Rysunku 2 (ogrzewanie).
Jak widać z Rysunku 1 objętość wody malała podczas ochładzania. Jednakże tylko do temperatury 4°C, po której następował wzrost objętości do temperatury 0°C. W przypadku ogrzewania było odwrotnie, tzn. Przy ogrzewaniu do 4°C objętość malała, a następnie zaczęła rosnąć. Wyniki naszych badań sugerują, iż charakter zmiany objętości przy 4°C jest paraboliczny.
Maksymalny przyrost wysokości słupa wody w doświadczeniu wniósł 30 milimetrów dla temperatury 11![]()
- przy czym 0 milimetrów przyjmujemy dla 4![]()
. Wysokość słupa wody dla 0![]()
wyniosła 12 milimetrów.
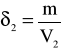
Aby obliczyć maksymalną gęstość skorzystamy z danych tablicowych. Otóż gęstość wody dla temperatury 10°C wynosi δ=0,9997*103 [kg*m-3]. Masa wody jest stała.
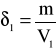
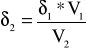
Czyli:
Średnica |
0,0017[m] |
V1 |
0,000000635544193821 |
V2 |
0,000000567450173055 |
δ1 |
0,9997[kg*m-3] |
|
|
δ2 |
1,119664 |
Przyjąłem, że wysokość kapilarki w temperaturze 10°C jest równa 0,25m+0,03m, natomiast w temperaturze 4°C (największa gęstość była w momencie najmniejszej osiągniętej objętości - czyli w temperaturze 4![]()
). jest równa 0,25m
Wnioski
Doświadczenie to wykazuje anomalną rozszerzalność wody. Jest to dowód na to, iż woda zachowuje się inaczej niż wszystkie inne ciecze, że dla temperatur od 0°C do 4°C cząsteczki wody zaczynają się łączyć, w wynik czego w temperaturze 0°C tworzy się heksagonalna struktura lodu z dużymi otwartymi przestrzeniami między ściankami kryształu.
Jest to bardzo ważny fakt dla życia organicznego w wodzie w czasie zimy. Podczas ochładzania, zgodnie z prawem Archimedesa, woda o temperaturze 4°C opada na dno zbiornika wodnego, krzepnięcie wody rozpoczyna się od powierzchni. Lód, który ma gęstość mniejszą niż woda utrzymuje się na powierzchni.
Analiza błędów
Dokładność pomiaru temperatury wynosi 0,1°C. Odczyt temperatury wydaje mi się, iż był prawidłowy, ponieważ temperatura wody w całym naczyńku była równomierna (dzięki mieszadełku).
Natomiast dokładność pomiaru wysokości słupa w kapilarze wynosi 1mm.
7
7.01.2000
dr T. Biernat
Marcin Grześczyk
I rok „bis” - Fizyka
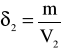
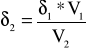
Wyszukiwarka
Podobne podstrony:
SPR29, Studia, Pracownie, I pracownia, 29 Anomalia rozszerzalności cieplnej wody, 29.1
25, Studia, Pracownie, I pracownia, 25 Wyznaczanie współczynnika rozszerzalności cieplnej metali za
Numer pomiaru, Studia, Pracownie, I pracownia, 28 Wyznaczanie współczynnika rozszeżalności liniowej
cw25, Studia, Pracownie, I pracownia, 25 Wyznaczanie współczynnika rozszerzalności cieplnej metali z
ROZSZERZALNOŚĆ TEMPERATUROWA, Studia, Pracownie, I pracownia
28 - NAPISAĆ, Studia, Pracownie, I pracownia, 28 Wyznaczanie współczynnika rozszeżalności liniowej d
Badanie wahadła skrętnego, Studia, Pracownie, I pracownia, 7 Badanie drgań wahadła skrętnego {torsyj
24 - oddane 21.04.2010, Studia, Pracownie, I pracownia, 24 Wyznaczenie mechanicznego równoważnika ci
Wstęp 59, Studia, Pracownie, I pracownia, 59 Rezonans elektromagnetyczny, Waldek
m5 NP, Studia, Pracownie, I pracownia
OSCYLOSK, Studia, Pracownie, I pracownia, 51 Pomiary oscyloskopowe, Ludwikowski
Wstęp teoretyczny 32, Studia, Pracownie, I pracownia
Sprawozdanie M7w, Studia, Pracownie, I pracownia
76, Studia, Pracownie, I pracownia, 76 Rozpady promieniotwórcze
teor 76, Studia, Pracownie, I pracownia
ZAGADN1, Studia, Pracownie, I pracownia, 1 Dokładność pomiaru długości, Marek
cw30, Studia, Pracownie, I pracownia, 30 Wyznaczanie względnej gęstości cieczy i ciał stałych, Ludwi
Sprawozdanie 49, Studia, Pracownie, I pracownia, 49 Charakterystyka tranzystora, Waldek
więcej podobnych podstron