1. Masa atomowa (definicja, jednostki, właściwości i znaczenie defekt masy).
Masa atomowa „MA” - masa atomu wyrażona w jednostkach skali masy atomowej oznaczona u lub amu. Ponieważ pierwiastek jest zbiorem izotopów składających się z atomów o różnych masach więc masa atomowa jest średnią ważoną wyrażającą skład izotopowy pierwiastka.
Defekt masy- niedobór masy, deficyt masy) - różnica między sumą mas składników atomu stanowiących składniki atomu a masą tego atomu.
2. Masa cząsteczkowa (definicja, jednostki, właściwości i znaczenie, defekt masy).
Masa cząsteczkowa- masa cząsteczki wyrażona w jednostkach skali masy atomowej. Związek chemiczny składający się z cząsteczek o wzorze ogólnym AxByCz ma masę cząsteczkową będącą sumą iloczynów mas atomowych i liczb atomów w cząsteczce.
MAxByCz=x Ma +yMb + Mc np.
masa cząsteczkowa wody MH2O = 2.MH+ Mo = 2* 1,008 + 16 =18,016
3. Podaj definicję defektu masy i jego znaczenie. Defekt masy i energia wiązania nukleonów w jądrze atomowym. Dwa warianty uzyskiwania energii atomowej. Wyjaśnij dlaczego jądro ziemi zawiera głównie żelazo?
Defekt masy- niedobór masy, deficyt masy) - różnica między sumą mas składników atomu stanowiących składniki atomu a masą tego atomu.
Brakująca masa odpowiada energii wiązania uwalnianej w trakcie łączenia się nukleonów w jądro.
Ponieważ wszystkie przemiany izotopowe przemiany chemiczne kończą się na żelazie i dalej nie zachodzą.
Ta brakująca masa jest równoważna energii wiązania nukleonów zgodnie ze wzorem podanym przez Einsteina: delta E = delta m· c2.
4. Definicja masy atomowej. Dlaczego masę atomów zazwyczaj nie wyrażamy w jednostkach masy SI? Defekt masy atomowej
Masa atomowa „MA” - masa atomu wyrażona w jednostkach skali masy atomowej oznaczona u lub amu. Ponieważ pierwiastek jest zbiorem izotopów składających się z atomów o różnych masach więc masa atomowa jest średnią ważoną wyrażającą skład izotopowy pierwiastka.
Nie wyrażamy jej w jednostkach masy SI ponieważ masy atomów są tak małe iż trzeba było stworzyć specjalną jednostkę by nie przeliczać gramów na bardzo małe wartości.
Defekt masy- niedobór masy, deficyt masy) - różnica między sumą mas składników atomu stanowiących składniki atomu a masą tego atomu.
5. Ile moli ludzi żyje na świecie? Obliczenia wykonaj zakładając populacje 6 miliardów ludzi. Ile planet takich jak Ziemia musiałoby istnieć aby stanowić 1 mol ludzi?
6 miliardów = 6 •109?
n= 6 •109/NA= 6•109[ludzi]/6,022 ·1023[ludzi/mol]=0,965•10-14[mol] ludzi
liczymy z proporcji
1 planeta - 0,965•10-14[mol] ludzi
x - 1mol
x=0,965•1014 planet
6. Definicja i znaczenie mola w chemii. Mol, masa molowa (definicja, jednostki, właściwości i znaczenie defekt masy).
Mol - podstawowa w układzie SI jednostka liczności materii, oznaczana symbolem mol,n
Jeden mol jest to liczność materii układu, zawierającego liczbę cząstek równą liczbie atomów zawartych w 12 gramach izotopu węgla 12C(w stanie nie wzbudzonym).
W jednym molu znajduje się (6,02214179 ± 0,00000030) · 1023 cząstek. Liczba ta jest nazywana stałą Avogadra
Na = 6,022 ·1023cząsteczek ·mol^-1
Mol jest jednostką bezwymiarową, użycie mola, ze względu na jego wielkość, jest ograniczone do zliczania obiektów mikroskopowych.
n = m/M dla substancji chem.
n = N/Na dla licznosci materii, gdzie N to calkowita liczba czasteczek lub atomow sub. a Na to stała avogadra
Masa molowa - masa jednego mola materii. Często mylona z masą cząsteczkową, lecz liczbowo jest równa tej wartości.
Jednostką masy molowej w układzie SI jest kg/mol, chociaż częściej wyrażana jest w jednostce pochodnej g/mol (tak wyrażona masa molowa jest liczbowo równa względnej masie molowej oraz podobna do wartości liczby masowej)
Defekt masy - różnica pomiędzy masą Z-protonów i N-neutronów a masą danego jądra atomowego o liczbie masowej A=N+Z.
Brakująca masa odpowiada energii wiązania uwalnianej w trakcie łączenia się nukleonów w jądro.
7. Zdefiniuj pojęcia: pierwiastek, związek chemiczny
Pierwiastek chemiczny - zbiór wszystkich atomów posiadających jednakową liczbę protonów w jądrze lub taka substancja chemiczna, która składa się wyłącznie z atomów posiadających jednakową liczbę protonów w jądrze.
Mogą łączyć się z sobą tworząc związki chemiczne.występują albo w stanie wolnym albo w formie związków chemicznych i ich mieszanin jak rownież w formie czystej stosunkowo rzadko i poza nielicznymi przypadkami (takimi jak np. miedź rodzima) trzeba je celowo wyodrębniać z mieszanin.
Związek chemiczny - jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania.
Związki chemiczne zapisuje się w formie wzorów chemicznych, w których podaje się liczbę i rodzaj atomów tworzących je cząsteczek.
Podział, ze względu na to, czy związek chemiczny spełnia prawo stałości składu, czy też nie:
• bertolidy - to związki nie spełniające tego prawa - czyli posiadające zmienny skład pierwiastkowy, co oznacza w praktyce,
że składają się nań cząsteczki o różnych proporcjach atomów różnych pierwiastków - przykłady to tlenek żelaza(II) i liczne polimery syntetyczne
• daltonidy - to związki spełniające prawo stałości składu - składają się one z jednego rodzaju cząsteczek.
Ze względu na dominujący rodzaj wiązań chemicznych:
• jonowe - w których dominują wiązania jonowe
• kowalencyjne - w których dominują wiązania kowalencyjne
• kompleksowe - w których występują wiązania koordynacyjne
Organika i nieorganika:
• Związki organiczne są to połączenia węgla, wodoru i innych pierwiastków, poza kwasem węglowym i jego pochodnymi.
• Wszystkie pozostałe związki przyjęło się nazywać związkami nieorganicznymi.
• Na styku tych dwóch wielkich grup znajdują się związki metaloorganiczne oraz związki kompleksowe, zawierające ligandy organiczne.
Ogólna reaktywność:
• ze względu na kwasowość:
o kwasy
o zasady
o związki amfoteryczne
o sole - będące wynikiem reakcji kwasów z zasadami
Ze względu na ogólną skłonność do przyjmowania lub udostępniania elektronów:
o elektrofile
o nukleofile
Ze względu na zachowanie w reakcjach redoks:
o utleniacze
o reduktory
8. Wyjaśnij dlaczego masa atomowa tlenu wynosi 15.9999 u (mniej niż 16u), chociaż składa się trzech izotopów 16O, 17O, 18O
Z tego co kojarze, to jest to usrednienie mas wszystkich izotopów, dlatego nie wynosi to pelnego 16. KTOŚ MNIE LEPIEJ SPRAWDZI I TO EDYTUJE :D
9. Definicja właściwości i znaczenie pojęcia masy atomowej.
a)Czy można zmienić masę atomową pierwiastka. Jeśli tak to jak
Średnią masę atomową np. C(o izotopach 12Ci 13C) obliczymy wiedząc, że w 10 000 atomów jest:
9889 atomów 12Co masie 12,000000 [u]
111 atomów 13Co masie 13,003355 [u]
M = (9889*12,000000 + 111*13,003355)/10 000 = 12,011[u]
Masy atomowe pierwiastków nie zmieniają się w sposób okresowy, jak inne właściwości, bowiem nie zależą od liczby elektronów tylko od jądra.
Masa atomowa jest bowiem uzależniona od składu jądra
CHYBA..
b) Czy można zmienić skład izotopowy pierwiastka. Czy skład izotopowy zależy od pochodzenia. Jeśli nie/tak to dlaczego?
zmiany składu izotopowego pierwiastków zachodzące pod wpływem naturalnych bodźców środowiska są zwykle bardzo niewielkie, wyrażanie ich w liczbach bezwzględnych
byłoby kłopotliwe i mało czytelne. Dlatego zamiast podawać duże liczby określające stosunek dwóch izotopów, wprowadza się wielkość delta zdefiniowaną jako stosunek
różnicy zawartości danego izotopu w badanej próbce i pewnego standardu do zawartości tego izotopu w standardzie. Wielkość delta wyrażamy w promilach a dla tlenu
jako standard przyjęto stosunek 18O/16O w wodzie oceanicznej, który wynosi 0,19934%. Na przykład delta18O=-10%o oznacza, że tlen-18 stanowi 0,1969 zamiast
standardowej zawartości 0,1989%. Oczywiście potrzebne są niezwykle precyzyjne metody analityczne, by tak drobne różnice można było mierzyć. Najczęściej stosuje
się w tym celu
spektroskopię masową.
c)Dlaczego masa atomu nie jest równa sumie mas cząstek elementarnych stanowiących składniki atomu?
Masa atomowa helu powinna byc równa sumie mas dwóch protonów i dwóch neutronów tj. 4,0319 u. Jednak najdokladniejsze eksperymentalne oznaczenia masy atomowej
helu daja wartosc 4,0015 u. Róznica 0,03039 u nosi nazwe defektu (niedoboru) masy. Stosujc równanie Einsteina (E=mc2) mozna okreslic ilosc energii, jaka zostanie
wyzwolona przy zmniejszaniu sie masy ukladu o 0,03039 u.
d) Podaj definicje defektu masy i jego znaczenie we praktyce ziemskiej i wszechświata tworzenie gwiazd i planet
Defekt masy - różnica pomiędzy masą Z-protonów i N-neutronów a masą danego jądra atomowego o liczbie masowej A=N+Z.
Brakująca masa odpowiada energii wiązania uwalnianej w trakcie łączenia się nukleonów w jądro.
Pewnie jakies znaczenie ma, ale chuj wie jakie, nie moge znalezc..
e)czy defekt masy atomu oznacza jego ułomność. Wyjaśnij dlaczego masa atomowa tlenu wynosi 15,9995 u (mniej niż 16 u), chociaż składa się z trzech izotopów 16O, 17O 18O
f)Ile waży jednostka skali masy atomowej u? Czy jest cięższy niż proton, a może lżejszy niż neutron? Czy elektron powstaje w reakcji n p+e. Czy elektrony mogą pochodzić z jądra atomu.
Z tego co kojarze, to jest to usrednienie mas wszystkich izotopów, dlatego nie wynosi to pelnego 16. KTOŚ MNIE LEPIEJ SPRAWDZI I TO EDYTUJE :D
f)Ile waży jednostka skali masy atomowej u? Czy jest cięższy niż proton, a może lżejszy niż neutron? Czy elektron powstaje w reakcji n ?p+e.
Czy elektrony mogą pochodzić z jądra atomu.
Jednostką masy atomowej jest unit (u), który jest definiowany jako dwunasta część masy jądra atomu węgla. Masa jądra atomu węgla wyrażona w gramach wynosi
mC = 1,993*10-23 g = 0,00000000000000000000001993 g.
1 u (unit) = 1/12 masy atomu 12C = 1.66054 x 10^-24 grama = 1.66054 x 10^-27 kg
1,6725 10^-24 grama - proton
1,6749 10^-24 grama - neutron
Myśle, ze moze, a jego emisja spowoduje powstanie kationu..
10. Zagadnienia do prawa stałych stosunków wagowych (prawo stałości składu, związków chemicznych Prousta) Czy woda otrzymana poprzez zmieszanie i „wody zwykłej” i wody cięzkiej spełnia podstawowe prawo chemiczne prawo stałych stosunków wagowych Prousta? (Prawo stałości składu) Odpowiadając na to pytanie weź pod uwagę następujące wskazówki.
Prawo stałości składu lub prawo stosunków stałych - fundamentalne prawo chemiczne odnoszące się do składu związków chemicznych. Mówi ono, że każdy związek chemiczny niezależnie od jego pochodzenia albo metody otrzymywania ma stały skład jakościowy i ilościowy
Związki chemiczne Prousta - W 1802 wyodrębnił (opublikował w 1806) z soku winogron glukozę (cukier gronowy). Wykazał istnienie różnych rodzajów cukrów.
Odkrył leucynę. Udowodnił, że metale mogą tworzyć z tlenem i siarką więcej niż jeden związek. Odkrył, że ługi to wodorotlenki metali alkalicznych.
Badał też materiały wybuchowe.
Daltonidy - to zwyczajowa nazwa grupy związków chemicznych spełniających prawo stałości składu. Zaliczają się do niej prawie wszystkie związki, zarówno organiczne jak i nieorganiczne, z wyjątkiem pewnej grupy niestechiometrycznych stałych związków nieorganicznych,
tzw. bertolidów
Bertolidy - to związki chemiczne niestechiometryczne (nie spełniające prawa stałości składu).
Bertolidy można spotkać wśród stałych związków nieorganicznych oraz wielu syntetycznych polimerów. Przyczyną zmiennej zawartości różnych pierwiastków w związku mogą być defekty sieci krystalicznej lub występowanie nadmiaru atomów jednego ze składników, nietworzących wiązań chemicznych
a) Zwróć uwagę na użyty cudzysłów
W przyrodzie istnieją trzy izotopy wodoru (wodór, deuter i tryt), z których dwa są trwałe, oraz trzy izotopy tlenu (16O, 17O, 18O), a sztucznie wytworzono j
eszcze pięć innych, nietrwałych izotopów. W konsekwencji tego może istnieć 48 różnych wód, z których dziewięć to wody trwałe.
H216O, H217O, H218O, HD16O, HD17O, HD18O, D216O, D217O, D218O
WIEC PEWNIE NIE
c)Czy w przyrodzie skład izotopowy pierwiastków jest stały.
Nie, a to miedzyinnymi przez naturalny rozpad. Okres polowicznego zaniku itp.
d)czy woda z Wisły spełnia prawo Prousta tak jak woda z amazonki. Czy to pytanie ma związek z podziałem związków chemicznych daltonidy bertolidy. Czy woda jest daltonidom. Czy znasz jakieś przykłady bertolidów?
"Mówi ono, że każdy związek
chemiczny niezależnie od jego pochodzenia albo metody otrzymywania ma stały skład jakościowy i ilościowy" - więc pewnie tak, woda to woda..
Mysle, ze spelnia i nalezy do daltonidow.
Przyklady Bertolidow:
tlenek żelaza(II)
liczne polimery syntetyczne
e) Będąc w laboratorium izotopowym masz nieograniczony dostęp do izotopów wodoru i tlenu ile trwałych związków wody z tych nuklidów (stosunek liczby atomów do 1X/8O = 2/1) i jakie mógłbyś otrzymać? (Zapisz je wzorami wykorzystując liczby masowe i liczby atomowe izotopów tlenu i wodoru
Powyższe wskazówki mają również związek z definicjami masy atomowej (tlenu i wodoru) i masy cząsteczkowej (wody). Czy potrafisz go wyrazić?
Sorry ale nie wiem o co chodzi
f) Czy znasz jakieś prawo chemiczne które nie da się zakwestionować .
Skoro prawo stałości składu jest fundamentalne to to chyba moze byc to...
11. Prawo zachowania masy. Prawo zachowania energii. Czy zmiana masy może spowodować zmianę energii układu? Prawo równoważności masy i energii - prawo Einsteina. Przedyskutuj prawo zachowania masy w równaniach chemicznych i przemianach jądrowych. Czy prawo zachowania masy jest spełnione w reakcjach? Odpowiedź uzasadnij:
Syntezy jądrowej 22H→4He + energia (porównaj liczbę i rodzaj nukleonów)
Syntezy jądrowej na Słońcu 41H→4He + energia (porównaj liczbę i rodzaj nukleonów)
Syntezy wody 2H2+O2→2H2O + energia
Syntezy węgla 12C: 6 protonów + 6 neutronów + 6 elektronów → 12C + energia; masa (u): protonu 1,0072764, neutronu 1,0086650, elektronu 0,0005486
Fotosyntezy 6CO2 + 6H2O + energia słoneczna → C6H12O6 + 6O2
Prawo zachowania masy w układzie zamkniętym - masa powstałych produktów jest równa masie substratów wziętych do przeprowadzenia reakcji. Wynika ono stąd, że liczba atomów danego pierwiastka chemicznego podczas reakcji chemicznej nie zmienia się (łączna masa atomów w układzie reakcyjnym po reakcji jest taka sama jak przed jej zajściem - jest to tzw. mikroskopowa interpretacja prawa zachowania masy).
W świetle prawa równoważności masy i energii (E = mc2) prawo zachowania masy nie jest ściśle spełnione. Jednakże podczas reakcji chemicznych wymieniane ilości energii są na tyle małe, że zmiana masy układu nie jest wykrywalna standardowymi metodami, stąd przyjmuje się stałość masy układu reakcyjnego:
Przemiana 1 g masy na energię to równoważność energii Δm·c2 = 9·1010 kJ. Trudny do zmierzenia deficyt masy rzędu 0,000001 (10-6) jednostki masy atomowej odpowiada ok. 90 MJ/mol czyli 90000 kJ/mol, a więc około 100 do 1000 razy więcej niż energia typowej reakcji chemicznej.
Zasada zachowania energii zwana prawem zachowania energii - empiryczne prawo fizyki. Stwierdza, że całkowita ilość energii w systemie pozostaje stała w czasie. Konsekwencją tego prawa jest, że energia w systemie zamkniętym nie może być utworzona, ani zniszczona. Jedyne może zmienić się forma energii np. podczas spalania wodoru w tlenie energia chemiczna zmienia się w energię cieplną.
W układzie izolowanym suma wszystkich rodzajów energii układu jest stała (nie zmienia się w czasie).
Prawo równoważności fotochemicznej (Einsteina-Starka) głosi, że absorpcja jednego fotonu powoduje zajście pierwotnego procesu (fizycznego lub chemicznego) w jednej cząsteczce absorbującej substancji.
12.. Prawo stałych stosunków wagowych - Pierwiastki chemiczne tworzace stechiometryczne zwiazki chemiczne lacza sie w scisle okreslonych i stalych stosunkach wagowych.
Daltonidy (nazwa pochodzi od nazwiska Johna Daltona) to zwyczajowa nazwa grupy związków chemicznych spełniających prawo stałości składu. Zaliczają się do niej prawie wszystkie związki, zarówno organiczne jak i nieorganiczne.
Bertolidy można spotkać wśród stałych związków nieorganicznych oraz wielu syntetycznych polimerów. Przyczyną zmiennej zawartości różnych pierwiastków w związku mogą być defekty sieci krystalicznej lub występowanie nadmiaru atomów jednego ze składników, nietworzących wiązań chemicznych. Brak stechiometrii jest powszechny wśród tlenków metali przejściowych, zwłaszcza gdy metal nie jest na swoim najwyższym stopniu utlenienia. Np. choć idealny wzór tlenku żelaza(II) to FeO, rzeczywista stechiometria odpowiada w przybliżeniu wzorowi Fe0,95O. Niedobór jonów żelaza kompensowany jest zwiększeniem stopnia utlenienia niektórych atomów do Fe3+.
Zw. Chemiczny - zbiór czasteczek tego samego rodzaju powstałych poprzez połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania.
Nie każdy bedzie wykazywal, np. H20 i H202.
13.. Jeżeli dwa pierwiastki tworzą ze sobą dwa lub więcej związków, to ilości wagowe jednego z nich, łączące się w tych związkach z tą samą ilością wagową drugiego, mają się do siebie jak proste liczby naturalne.
np.: w tlenkach azotu N2O NO N2O3NO2 N2O5
Na 1 atom N przypadaO,5: 1 : 1,5 : 2 : 2,5 atomów O
Na stałą liczbę jednostek wagowych azotu przypada
X tlenu / constazotu= 1 : 2 : 3 : 4 : 5
14. Model atomu Daltona - opublikowany w 1808 roku przez Johna Daltona model budowy materii. Dalton przyjął że materia zbudowana jest z atomów. Dalton przyjął, że atom jest niepodzielną idealną i sprężystą kulą. Stąd często używana nazwa "model kuli bilardowej".
Podstawowe założenia teorii atomowej Daltona:
* Pierwiastki chemiczne składają się z atomów. - POPRAWNE i AKTUALNE
* Atomy danego pierwiastka różnią się od atomów innego pierwiastka. Atomy różnych pierwiastków mogą być odróżnione od siebie po ich masie atomowej. - POPRAWNE i AKTUALNE
* Wszystkie atomy danego pierwiastka są identyczne. - NIEAKTUALNE
Atomy jednego pierwiastka mogą połączyć się z atomami innego pierwiastka tworząc związki chemiczne. - POPRAWNE i AKTUALNE
Związek chemiczny ma zawsze taką samą ilość atomów tworzących go pierwiastków. - NIEAKTUALNE
Atom nie może zostać stworzony, podzielony na mniejsze części lub zniszczony w wyniku działania reakcji chemicznej. Reakcja zmienia jedynie sposób połączenia ze sobą poszczególnych atomów. - POPRAWNE i AKTUALNE
15. Gazy mieszają się ze sobą we wszystkich możliwych stosunkach. Prawo Daltona opisuje zachowanie się mieszanin gazów doskonałych. Prawo to stwierdza, że ciśnienie wywierane przez mieszaninę gazów równe jest sumie ciśnień cząstkowych (parcjalnych) poszczególnych jej składników. Oznaczamy ciśnienie całkowite mieszaniny przez p a ciśnienia parcjalne przez p1, p2, p3, …, pi.
Możemy zatem zapisać: p= p1+ p2+ p3, + pi.
Wyrażenia n1/n, n2/n, n3/n podają stosunek ilości moli danego składnika do całkowitej ilości moli wszystkich substancji obecnych w mieszaninie, nazywamy ułamkami molowymi.
Możemy zatem napisać, że ciśnienie cząstkowe danego składnika mieszaniny jest iloczynem ułamka molowego tego składnika i ciśnienia
p=n1d1RT/m1
pm1=n1d1RT
pm1/n1RT=d1
pm2/n2RT=d2
d1 : d2 m1 : m2 153,81 : 2,016 76,3 : 1 CCl4 : H2
pm2/n2RT : pm1/n1RT
m2/n2 : m1/n1
n1=n2
16. Równanie van der Waalsa - równanie stanu gazu wiążące parametry stanu gazu (ciśnienie p, objętość V i temperaturę T).
Wyprowadzone przez Van der Waalsa w roku 1873 jako rozszerzenie równania stanu gazu idealnego (równanie Clapeyrona), Van der Waals wprowadził poprawkę uwzględniającą objętość cząsteczek gazu (b) oraz oddziaływanie wzajemne cząsteczek gazu (a/V²).
Najczęściej podawane jest dla objętości molowej gazu (dla 1 mola gazu, V = Vm):
Gdzie:
a - stała charakterystyczna dla danego gazu, uwzględniająca oddziaływanie między cząsteczkami gazu (cząsteczki gazu przyciągają się, w wyniku czego rzeczywiste ciśnienie gazu na ścianki naczynia jest mniejsze niż w przypadku, gdyby tego oddziaływania nie było),
b - stała charakterystyczna dla danego gazu, uwzględniająca skończone rozmiary cząsteczek, ma wymiar objętości, przez co uznawana jest za objętość mola cząsteczek gazu,
p - ciśnienie,
Vm - objętość molowa,
T - temperatura bezwzględna,
R - uniwersalna stała gazowa
Parametry a i b, zgodnie z teorią, powinny być związane z parametrami punktu krytycznego gazu, zwanymi też stałymi krytycznymi, które mogą być też w zastosowaniach praktycznych traktowane jako parametry dopasowania. W punkcie krytycznym na wykresie p(v) krzywa powinna być pozioma, co odpowiada, że jej pochodna powinna wynosić 0.
,
gdzie:
Tc - temperatura krytyczna
pc - ciśnienie krytyczne
Dla dowolnej ilości moli gazu n w objętości V równanie van der Waalsa przybiera postać:
Równanie van der Waalsa stanowi na ogół bardzo dobre przybliżenie równania stanu gazów rzeczywistych, szczególnie dla dużych ciśnień i w temperaturach i ciśnieniu zbliżonych do parametrów skraplania gazu i powyżej.
Jeśli można zaniedbać oddziaływanie między cząsteczkami (a=0) i rozmiary samych cząsteczek (b=0) czyli traktować gaz jako gaz doskonały, to równanie Van der Waalsa przechodzi w równanie Clapeyrona.
17. Dualizm korpuskularno-falowy - cecha obiektów kwantowych (np. fotonów, czy elektronów) polegająca na przejawianiu, w zależności od sytuacji, właściwości falowych (dyfrakcja, interferencja) lub korpuskularnych (dobrze określona lokalizacja, pęd).
Zgodnie z mechaniką kwantową cała materia charakteryzuje się takim dualizmem, chociaż uwidacznia się on w bardzo małej skali, gdy iloczyn pędu i długości fali jest rzędu stałej Plancka.
Dualizm korpuskularno-falowy jest ściśle związany z falami de Broglie'a.
18. Wyjaśnij istotę widma emisyjnego i adsorpcyjnego wodoru na przykładzie serii Balmera.
Seria Balmera, seria linii widmowych powstająca w wyniku emisji fotonów przez elektron w atomie wodoru przechodzący z wyższego orbitalu na orbital 2 (seria L).
19. Jakie są konsekwencje zasady nieoznaczoności Heisenberga w ocenia położenia elektronów w atomie.
Elektron można przedstawić tylko jako punkt materialny bądź pęd (dla atomów innych niż wodoru).
20. Rola i znaczenie liczb kwantowych w opisie struktury elektronowej atomu
Symbole liczb kwantowych są ustalone tradycją. Na przykład elektronowi w atomie wodoru lub wodoropodobnym (mającym tylko jeden elektron) przypisane są następujące liczby kwantowe:
* główna liczba kwantowa (n = 1,2,3...) opisuje energię elektronu, a w praktyce oznacza numer jego orbity (powłoki elektronowej),
* poboczna liczba kwantowa (l = 0,1,...,n − 1) oznacza wartość bezwzględną orbitalnego momentu pędu, którą obliczyć można używając relacji J2 = l(l + 1)(h / 2π)2, gdzie h jest stałą Plancka, a w praktyce oznacza numer podpowłoki, do której przypisany jest elektron,
* magnetyczna liczba kwantowa (m = − l,..., − 1,0,1,...,l) opisuje rzut orbitalnego momentu pędu na wybraną oś, którego długość oblicza się używając wzoru Jz = mh / 2π,
* spinowa liczba kwantowa s oznacza spin elektronu, stały dla danej cząstki elementarnej i w przypadku elektronu wynoszący 1/2 (ze względu na stałą wartość tej liczby kwantowej jest ona niekiedy pomijana),
* magnetyczna spinowa liczba kwantowa (ms = − s,s = 1 / 2, − 1 / 2) pokazuje, w którą stronę skierowany jest spin, danej cząstki elementarnej (tu elektronu).
21. Reguła Hunda. Wykaż, rozbudowując powłokę walencyjną pierwiastków bloku p.
Reguła Hunda - reguła mówiąca, że w atomie, w celu uzyskania najbardziej korzystnego energetycznie zapełnienia orbitali atomowych, powinno być jak najwięcej elektronów niesparowanych. Elektrony ulegają sparowaniu po pojedynczym zapełnieniu wszystkich form przestrzennych danych orbitali danej powłoki elektronowej
Podaj definicję reguły Hunda. Podaj rozmieszczenie elektronów walencyjnych w atomach pierwiastków trzeciego okresu układu okresowego.
Orbitale atomowe. Konfiguracja elektronowa pierwiastków: 7X, 73X, 17X, 43X.
Orbital - powierzchnia opisana funkcją falową, będącą rozwiązaniem równania Schrödingera dla szczególnego przypadku układu jednego elektronu znajdującego się na jednej z powłok atomowych lub tworzących wiązanie chemiczne.
Orbital jest powierzchnią opisaną funkcją falową jednego elektronu, której kwadrat modułu (zgodnie z interpretacją Maxa Borna) określa gęstość prawdopodobieństwa napotkania elektronu w danym punkcie przestrzeni.
Pojęcie orbitalu jest często utożsamiane z kształtem obszaru, obliczonym z funkcji orbitalowej, w którym prawdopodobieństwo napotkania elektronu jest bliskie 1 (zwykle przyjmuje się wartość 0,9).
24.Uzasadnij szereg reaktywności chemicznej pierwiastków F2>O2>Cl2. Podaj schematy orbitali molekularnych cząsteczek i określ rząd wiązania.
25.Dlaczego cząsteczki O2 są paramagnetyczne?
Paramagnetyzm - zjawisko magnesowania się makroskopowego ciała w zewnętrznym polu magnetycznym w kierunku zgodnym z kierunkiem pola zewnętrznego. Substancja wykazująca takie własności to paramagnetyk, jest on przyciągany przez magnes, jednak znacznie słabiej niż ferromagnetyk. W niezbyt niskich temperaturach oraz dla niezbyt silnych pól magnetycznych paramagnetyki wykazują liniową wielkość namagnesowania od pola zewnętrznego, co wyraża wzór:
M = xH
gdzie:
* M - namagnesowanie (moment magnetyczny jednostki objętości substancji)
* χ - objętościowa podatność magnetyczna
* H - natężenie pola magnetycznego.
W niskich temperaturach lub dla bardzo silnych pól magnetycznych namagnesowanie traci liniową zależność od pola zewnętrznego i wykazuje nasycenie.
Podatność magnetyczna zależy od temperatury, zjawisko to ujmuje prawo Curie. Niektóre paramagnetyki w temperaturach niższych od pewnej charakterystycznej dla każdej substancji wartości, nazywanej punktem Curie, stają się ferromagnetykami.
Przyczyną paramagnetyzmu jest porządkowanie się spinów elektronów ciała zgodnie z liniami zewnętrznego pola magnetycznego, uporządkowaniu przeciwdziałają drgania cieplne cząsteczek. W niskich temperaturach lub w silnych polach magnetycznych dochodzi do uporządkowania niemal wszystkich dipoli magnetycznych elektronów w wyniku czego dochodzi do nasycenia. Właściwości paramagnetyczne posiadają substancje o niesparowanych elektronach.
Paramagnetyki mają przenikalność magnetyczną μ niewiele większą od jedności. Dla ferromagnetyków μ jest wielokrotnie większe od 1.
Przykłady paramagnetyków:
* tlen O2
* aluminium
* platyna Pt
* tlenek azotu (II) NO
26. Zastosowanie modelu LCAO do opisu cząsteczek gazów dwuatomowych
Liniowa Kombinacja Atomowych Orbitali - LCAO
Podstawy metody Orbitali Molekularnych opisu budowy cząsteczki związku chemicznego można zawrzeć w następujących punktach:
Cząsteczkę traktuje się jako całość, w której nie są zachowane indywidualne cechy atomów wchodzących w jej skład. Każdy elektron w cząsteczce porusza się w polu wszystkich jej jąder i elektronów.
Stan elektronu opisuje jednoelektronowa funkcja falowa charakteryzująca się określonymi liczbami kwantowymi. Funkcję tą nazywamy orbitalem molekularnym (MO). Orbital ten jest wielocentrowy w odróżnieniu od orbitalu atomowego, gdyż ilość jąder w cząsteczce nie może być mniejsza niż dwa. Podobnie jak w atomie kwadrat funkcji falowej określa gęstość prawdopodobieństwa znalezienia elektronu lub gęstość chmury elektronowej.
Każdy MO zawiera określoną energię w przybliżeniu równą potencjałowi jonizacji z danego orbitalu.
Wszystkie orbitale cząsteczki, obsadzone elektronami nazywają się jej konfiguracją elektronową. Konfiguracja ta, podobnie jak dla atomu, jest określona dwoma zasadami: zasadą najmniejszej energii zgodnie z którą elektron obsadza najniżej energetyczny orbital, i zakazem Pauliego - na jednym orbitalu nie mogą się znaleźć więcej niż dwa elektrony, przy czym ich spiny muszą być antyrównoległe.
Funkcję falową podstawowego stanu cząsteczki określa się jako iloczyn funkcji falowych obsadzonych orbitali molekularnych przez co energia układu jest równa sumie energii obsadzonych orbitali molekularnych.
Przejście nawet jednego elektronu z zajętego na wyżej położony MO jest równoznaczne ze wzbudzeniem cząsteczki czyli przejściem ze stanu podstawowego do wzbudzonego.
Jednym z powszechnie stosowanych sposobów przybliżonego opisu funkcji falowej elektronu w cząsteczce jest metoda liniowej kombinacji atomowych orbitali (LCAO MO). Zgodnie z tą metodą MO można zapisać jako:
c1 c2 gdzie c1 i c2 są niezależnymi parametrami. Korzystając z konturów orbitali atomowych można ten wzór matematyczny przedstawić graficznie:
W przypadku a) współczynniki c1 i c2 mają ten sam znak, a w b) przeciwny. Biorąc do kombinacji dwa orbitale atomowe otrzymuje my dwa orbitale molekularne: jeden o niższej energii - wiążący i o wyższej energii antywiążący. Gęstość elektronowa na orbitalu wiążącym jest zlokalizowany w przestrzeni pomiędzy jądrami (przypadek a), na antywiążącym gęstość elektronowa w obszarze pomiędzy jądrami cząsteczki jest obniżona. Formułując orbital molekularny w tej metodzie należy zachować pewne warunki:
użyte do kombinacji orbitale atomowe powinny mieć porównywalne energie;
orbitale atomowe powinny się efektywnie nakładać;
orbitale atomowe tworzące orbital molekularny powinny mieć taką samą symetrię względem osi łączącej jądra w cząsteczce.
Poza orbitalami wiążącymi i antywiążącymi w cząsteczkach istnieją też orbitale niewiążące, których energia niewiele różni się od energii orbiatlu atomowego, z którego się wywodzą. Częstym sposobem przedstawiania budowy elektronowej cząsteczki jest diagram orbitali molekularnych zgodnie z ich wzajemną energią. Dla prostych dwuatomowych cząsteczek pierwiastków drugiego okresu można przedstawić takie diagramy następująco:
Diagram a) obowiązuje dla cząsteczek homojądrowych 2 okresu cięższych od azotu, dla których występuje znaczna różnica energii pomiędzy atomowymi orbitalami 2s i 2p. Diagram b) dla cząsteczek od Li2 do N2, dla których różnica energii orbitali atomowych 2s i 2p jest stosunkowo nieznaczna.
27.Według jakich reguł elektrony obsadzają poszczególne poziomy energetyczne w atomie. Podaj konfigurację pierwiastka 28X.
Według reguł Hunda.
28X - 1s22s2p6 3s2p6d84s2
28.Podaj reguły Slatera i ich znaczenie
Zachowanie się elektronów w atomach wieloelektrodowych można opisać także, posługując się orbitalami obliczonymi dla atomu wodoru pod warunkiem jednak, że wprowadzi się do obliczeń skorygowaną na drodze empirycznej wartość liczby atomowej, tzw. efektywną liczbę atomową Z*. Energię danego elektronu wyraża się podówczas skorygowanym wzorem:
Slater podał kilka reguł empirycznych umożliwiających obliczenie stałej ekranowania, S, wyrażającej różnicę pomiędzy wartościami Z i Z*, Z*=Z-S. W celu przeprowadzenia takiego obliczenia zapisujemy najpierw konfigurację elektronową atomu przy zachowaniu następujących ugrupowań orbitali i następującej ich kolejności:
(1s)(2s, 2p)(3s, 3p)(3d)(4s, 4p)(4d)(4f)(5s, 5p) itd.
Obliczając stałą S dla elektronu ns lub np przyjmujemy, iż:
Elektrony położone w ugrupowaniach w prawo od ugrupowania (ns, np) nie wnoszą żadnego udziału do stałej,
Pozostałe elektrony w ugrupowaniu (ns, np) wnoszą udział po 0,35; wyjątek: elektrony 1s (udział 0,3)
Każdy z elektronów w powłoce (n-1) wnosi udział 0,85
Każdy z elektronów w powłoce (n-2) i w powłokach położonych jeszcze bliżej jądra wnosi udział 1,0.
Reguły Slatera:
1.ladunek dzialajacy na elektron zalezy od typu orbitalu obsadzonego przez ten elektron oraz od pozostalych elektronow w atomie.dla danej liczby n najbardziej trwaly(najnizsza energia) jest orbital s dalej p,d i f.
2.elektrony na poziomie wyzszym od badanego elektronu nie ekranuja,
3.udzial elektronow o tej samej liczbie kwantowej n wnosi do liczby Q 0.35 ilosci elektornow udzial elektornow z powloki n-1 wynosi 0.85 ilosci elektronow
4.elektrony na glebszych powlokach oraz elektrony d i f wnosza udzial rowny ilosci elektronow.
5.przesuwajac sie w okresie w prawo efektywny ladunek dzialajacy ma ostatni elektron jest coraz wiekszy.
29. Konfiguracja elektronowa pierwiastków 16X, 20X, 17X, 37X, 79X, 1X, 8X, 56X. Co oznaczają poszczególne cyfry i symbole? Określ położenie pierwiastków w układzie okresowym i znane Ci podstawowe właściwości fizyczno-chemiczne.
16X - 1s22s2p63s2p4 - 16 (VI główna) - tlenowce
20X - 1s22s2p63s2p64s2 - 2 (II główna) - berylowce
17X - 1s22s2p63s2p5 - 17 (VII główna) - fluorowce
37X - 1s22s2p63s2p6d104s2p65s1 - 1 (I główna) - litowce
79X - 1s22s2p63s2p6d104s2p6d10f145s2p6d66s2p3 - (X poboczna)
1X - 1s1 - 1 (I główna)
8X - 1s22s2p4 - 16 (VI główna) - tlenowce
56X - 1s2 2s2p63s2p6d104s2p6d105s2p66s2 - 2 (II główna) - berylowce
30. Dlaczego jon NO3- jest płaski, a cząsteczka NH3 piramidalna?
NO3-
a) Trzeba skorzystać ze wzorów :
LwpE= 0,5 * Lwal - 4n-m
Lp= Lwpe + n + m
NO3- LwpE=0,5*23-4*3-0 = -0,5
Lp= -0,5+3+0=2,5 czyli około 3 to znaczy że cząsteczka jest płaska trygonalna
NH3
b) LwpE=0,5*8-0-3=1
Lp=1+3=4 to oznacza tetraedryczna
31. Dlaczego jon NO3- jest płaski, a cząsteczka SF6 oktaedrowa?
NO3-
a) Trzeba skorzystać ze wzorów :
LwpE= 0,5 * Lwal - 4n-m
Lp= Lwpe + n + m
NO3- LwpE=0,5*23-4*3-0 = -0,5
Lp= -0,5+3+0=2,5 czyli około 3 to znaczy że cząsteczka jest płaska trygonalna
SF6
b) Lwpe=0,5*48-4*6=0
Lp=0+6=6 cząsteczka jest oktaderyczna,
32. Dlaczego cząsteczka kwasu HNO3 jest płaskim trójkątem, cząsteczka CH4 tetraedrem, a cząsteczka SF6 oktaedrem?
HNO3:
a)LwpE=0,5*24-4*3-1=-1
Lp=-1+3+1=3
SF6
b) Lwpe=0,5*48-4*6=0
Lp=0+6=6 cząsteczka jest oktaderyczna,
CH4
c)LwpE=0,5*8-4=0
Lp=4
33. Dlaczego cząsteczka CO2 jest liniowa, SO2 zaś trójkątna? Określ typ hybrydyzacji i wzory strukturalne.
CO2
LwpE=0,5*16-4*2=0
Lp=2
SO2
Lwpe=0,5*18-4*2=1
Lp=1+2=3
Typ hybrydyzacji określamy względem Lp
Czyli
Lp=2 to hybrydyzacja sp
3 sp2
4 sp3
5 sp3d
34. Dlaczego cząsteczka SO3 jest płaska, a PCl3 piramidalna (VSEPR)?
35. Dlaczego cząsteczka CO2 jest liniowa, natomiast cząsteczka H2O kątowa?
Lwp H20 =0,5*8-2=2
Lp=2+2=4
36. Podaj hybrydyzację atomów węgla w cząsteczkach: CO, CO2, H2CO, H2CO3 i CH4 - narysuj wzory strukturalne tychże cząsteczek z uwzględnieniem ich geometrii.
37. Określ typ hybrydyzacji orbitali atomów centralnych w cząsteczkach: H2O, H2SO4, CO2, SO3, SF6 - narysuj wzory strukturalne tych cząsteczek z uwzględnieniem ich geometrii.
Właściwości i geometrię cząsteczek typu ABn można opisać, przyjmując że:
A jest atomem centralnym i n atomów B (jednakowych bądź różnych), zwanych roboczo ligandami, uczestniczy w tworzeniu orbitali molekularnych z atomem A
cząsteczka zawiera pierwiastki grup głównych układu okresowego
hybrydyzacji ulegają orbitale atomu centralnego A
jeżeli cząsteczka zawiera więcej niż jeden atom centralny to hybrydyzacji ulegają wszystkie atomy centralne (jak np. C w etenie CH2=CH2)
Wśród elektronów walencyjnych atomu centralnego wyróżnia się:
wolne pary elektronowe danego atomu (zlokalizowane w polu jednego jądra) - stanowią pary niewiążące
elektrony, które są wspólne dla dwóch sąsiadujących atomów - stanowią pary wiążące (pary zlokalizowane w polu dwóch sąsiadujących jąder)
Wśród par wiążących wyróżnić można pary σ i pary π, które mogą tworzyć:
wiązania typu σ (o symetrii względem osi łączącej jądra)
wiązania typu π (o obszarze orbitalnym złożonym z dwóch fragmentów leżących poza osią łączącą jądra)
Określonym wartościom liczby przestrzennej oznaczanej symbolem Lp, równej liczbie orbitali zhybrydyzowanych (LH), odpowiada określona geometria cząsteczka. O kształcie cząsteczki decyduje liczba wiążących par elektronowych (PW) i wolnych par elektronowych (WPE). Ich suma wskazuje typ hybrydyzacji, a tym samym podstawowy wielościan koordynacyjny, którego naroża zajmują atomy lub wolne pary elektronowe:
gdzie:
σPW - liczba par elektronowych tworzących wiązanie a; wynosi ona tyle, ile atomów B jest przyłączonych do atomu centralnego A. Przykład: dla PCl5 σPW = 5, dla H2O σPW = 2, dla COCl2 σPW = 3,
WPE - liczba wolnych par elektronowych atomu centralnego; oblicza się ją odejmując od liczby elektronów walencyjnych atomu centralnego A, taką liczbę elektronów, jaka jest potrzebna do uzupełnienia konfiguracji wszystkich atomów B i dzieli przez 2, czyli WPE = 1/2 [liczby elektronów walencyjnych atomu A pomniejszona o liczbę elektronów potrzebną do uzupełnienia oktetów (lub dubletów dla wodoru) dla n atomów B]. Dla jonów ujemnych zwiększa się, a dla jonów dodatnich zmniejsza się liczbę elektronów walencyjnych o ładunek jonu. Przykład: Dla H2O WPE = (6 − 2) / 2 = 2, dla SO42- WPE = (6 + 2 − 8) / 2 = 0
Wartość liczby przestrzennej możemy ustalić:
ze wzoru elektronowego cząsteczki
lub przez obliczenie:
najpierw liczby wolnych par elektronowych atomu centralnego,
a następnie liczby przestrzennej,
ostatni etap opisu budowy przestrzennej cząsteczki opiera się na fakcie, że do każdej wartości Lp jest przyporządkowana charakterystyczna struktura przestrzenna. Można więc powiedzieć, że przestrzenna budowa cząsteczki, a zatem kierunki, w jakich ustawiają się ligandy i wolne pary elektronowe, są określone liczbą przestrzenną.
38. Napisz wzory strukturalne kwasów tlenowych fosforu (III) i (V) (H3PO3, H3PO4, HPO3).
39. Napisz wzór strukturalny kwasu ortofosforowego (V) i ortofosforowego (III).
40. Budowa przestrzenna XeCl2. Odpowiedź uzasadnij.
Niemożliwe do otrzymania
41. Konfiguracja przestrzenna atomów w cząsteczce H2O i CO2. Określ typ hybrydyzacji orbitali atomu centralnego oraz rodzaje powstałych wiązań.
Wiązania kowalencyjne spolaryzowane.
42. Konfiguracja przestrzenna atomów w cząsteczce BF3 i NF3. Określ typ hybrydyzacji orbitali atomu centralnego oraz rodzaje powstałych orbitali cząsteczkowych tudzież momenty dipolowe cząsteczek.
43. Co to jest moment dipolowy? Wyznacz go schematycznie dla cząsteczek: CO2 i SO2.
Formalnie rzecz biorąc, na moment magnetyczny atomu składają się: wypadkowy moment magnetyczny elektronów oraz moment magnetyczny jądra. W praktyce rolę odgrywa głównie moment magnetyczny elektronów
44. Co to jest moment dipolowy? Wyznacz go schematycznie dla cząsteczek: NH3 i SO3.
Moment dipolowy towarzyszy cząsteczkom, w których występuje nierównomierne i niesymetrycznie rozłożony ładunek. Opisuje on pośrednio ?wypadkowe rozłożenie ładunku? i charakteryzuje bezpośrednio dipol. Duży wpływ na wielkość momentu dipolowego ma elektroujemność pierwiastków oraz geometria cząsteczki. Tak na przykład woda dzięki budowie kątowej posiada moment dipolowy a dwutlenek węgla już nie, ponieważ posiada budowę liniową. Moment dipolowy jest wartością wektorową, a cząsteczki posiadające trwały, niezerowy moment dipolowy nazywamy polarnymi.
45. Dlaczego wraz ze wzrostem liczby atomowej pierwiastków w poszczególnych okresach układu okresowego promienie atomowe maleją?
Wielkość atomu lub jonu określa promień najbardziej zewnętrznej powłoki elektronowej. W obrębie okresu promienie atomów zmniejszają się malejąc w danym okresie od strony lewej do prawej. Wiąże się to ze wzrostem liczby protonów w jądrze, tzn. z silniejszym przyciąganiem elektronów przez jądro. Tak więc w poszczególnych okresach litowce mają największe promienie atomów, a flourowce najmniejsze.
W obrębie grup promienie atomów wzrastają wraz ze wzrostem liczb atomowych. Wiąże się to ze wzrostem liczby powłok elektronowych, których wpływ na wielkość średnicy atomu przewyższa wpływ wzrostu ładunku jądra, decydującego o zmniejszeniu średnicy atomu
46. Zasady budowy sfery elektronowej atomów i ich powiązanie z układem okresowym. Prawo okresowości w chemii. Liczby kwantowe elektronów w atomie i ich sens fizyczny.
Prawo okresowości: pierwiastki chemiczne ułożone zgodnie ze wzrastająca liczbą atomową wykazują okresowe powtarzanie się właściwości.
Prawo okresowości jest podstawą konstrukcji układu okresowego. W czasach Mendelejewa nie było logicznego uzasadnienia tego prawa. Dopiero po odkryciu struktury atomu nabrało ono fizycznego znaczenia. Współcześnie wiadomo, że numer okresu odpowiada numerowi powłoki walencyjnej atomu. Liczba pierwiastków w jednym okresie wynika z liczby orbitali na powłoce walencyjnej, z których każdy może być wypełniony maksymalnie dwoma elektronami
47. Jakie korzyści daje znajomość położenia pierwiastka w układzie okresowym.
Znajomość ta umożliwia nam poznanie właściwości poszczególnych atomów. Mówi nam o ilości powłok, il ekektrónów walencyjnych o elektroujemności.
48. Zdefiniuj i omów wiązania chemiczne: jonowe, kowalencyjne i metaliczne.
Wiązania kowalencyjne- polega na uwspólnieniu elektronów. Wiązanie te występują miedzy atomami najczęściej tego samego. Pierwiastki dążą do osiągnięcia struktury oktetu lub dubletu. Różnica elektroujemności wynosi 0 dla wiązań kowalencyjnych
Wiązania jonowe- polega na przenoszeniu nieelektronów od atomu do metalu do atomu niemetali, związane jest to z oddawaniem elektronów przez metale, tworzą się również kationy metali i pobieranie elektronów przez niemetale(tworzą się aniony nie metali. Wiązanie jonowe tworzy się miedzy atomami metali i niemetali, najczęściej z następujących grup:
I A i VI A -Na S
IA i VIIA- K, Br
IIA i VIA-MgS, CaO,
IIA i VIIA-CaCl ,SrCl.
Wiązanie metaliczne - ogólna nazwa dla wszelkich wiązań chemicznych występujących bezpośrednio między atomami metali.
Wiązania między atomami metalu, jeśli występują w izolowanej formie (np. w związkach metaloorganicznych) są w zasadzie typowymi wiązaniami kowalencyjnymi, wyróżniają się jednak w stosunku do analogicznych wiązań między niemetalami dwiema istotnymi cechami:
ulegają one łatwiejszej polaryzacji pod wpływem np. pola elektrycznego ze względu na to, że ogólnie w metalach elektrony walencyjne są słabiej związane z jądrami atomów niż w niemetalach
nawet jeśli formalnie są wiązaniami pojedynczymi, ze względu na występowanie w metalach dużej liczby walencyjnych orbitali d zachodzi zjawisko ich nakładania się, co powoduje że wiązania te nabierają często charakteru częściowo wielokrotnego.
Cechy te powodują, że w kryształach metali powstają pasma zdelokalizowanych elektronów, które mogą swobodnie się przemieszczać pod wpływem przyłożonego napięcia elektrycznego, dzięki czemu metale są dobrymi przewodnikami elektrycznymi. Ubocznym skutkiem tej delokalizacji jest też istnienie w metalach trójwymiarowej sieci silnych wiązań, co warunkuje dużą wytrzymałość mechaniczną metali, wysokie temperatury topnienia, kowalność, duży współczynnik rozszerzalności cieplnej i inne cechy charakterystyczne dla metali
49. Dlaczego wiązanie jonowe (Na-Cl) jest silniejsze niźli wiązanie kowalencyjne (H-Cl)?
Roznica wynikajaca z elektroujemnosci jonu wodorowego i jonu sodowego.
50. Dlaczego wiązanie H-F jest silniejsze od wiązania kowalencyjnego H-H bądź F-F?
Ponieważ to wiązanie kowalencyjne spolaryzowane i jest bardziej elektroujemne.
51. Oddziaływania międzycząsteczkowe (typy, znaczenia).
Oddziaływania międzycząsteczkowe - inne niż wiązania chemiczne siły wiążące atomy i cząsteczki.
Do oddziaływań tych zalicza się (w kolejności od najsilniejszych do najsłabszych):
oddziaływania jon-jon (elektrostatyczne) - zachodzą między dwiema różnoimiennie naładowanymi cząsteczkami; od wiązań jonowych różni je to, że ładunek w oddziałujących ze sobą cząsteczkach nie jest skoncentrowany na jednym atomie, lecz jest zdelokalizowany na kilku-kilkunastu atomach. Siła ich oddziaływania jest proporcjonalna do 1/r2 (gdzie r - odległość między cząsteczkami). W przypadku ośrodka zawierającego inne ładunki (np. roztworu elektrolitu) efekt oddziaływania jest mniejszy. (Zobacz też: para jonowa.)
wiązania wodorowe - tworzą się, gdy atom wodoru z cząstkowym ładunkiem dodatnim jest współdzielony przez dwie cząsteczki, które posiadają atomy z cząstkowym ładunkiem ujemnym. Wiązania wodorowe, jeśli występują w obrębie jednej cząsteczki, są często traktowane jak słabe wiązanie chemiczne; jeśli jednak wiąże ono dwie lub więcej cząsteczek, można je traktować jako oddziaływanie międzycząsteczkowe.
oddziaływania trwały dipol - trwały dipol - tworzą się między cząsteczkami posiadającymi trwałe momenty dipolowe. Cząsteczki takie posiadają w jednych miejscach nadmiar ładunku ujemnego, a w innych jego niedomiar. Oddziałują one ze sobą tak jak jony - tyle, że oddziaływanie to jest słabsze, gdyż w grę wchodzą cząstkowe, a nie całkowite ładunki elektryczne, a także przyciąganiu pomiędzy ładunkami różnoimiennymi towarzyszy zawsze odpychanie pomiędzy ładunkami jednoimiennymi.
oddziaływania van der Waalsa, zwane też oddziaływaniami Londona lub oddziaływaniami dyspersyjnymi - są to oddziaływania między trwałym dipolem i wzbudzonym dipolem lub między dwoma wzbudzonymi dipolami. W cząsteczkach, które nie posiadają trwałego momentu dipolowego, może on być wzbudzany przez cząsteczki z trwałym momentem; następnie taki wzbudzony dipol i trwały dipol oddziałują na siebie podobnie jak dwa trwałe dipole, tyle że znacznie słabiej. W cząsteczkach bez trwałego momentu dipolowego występują natomiast stochastyczne fluktuacje ich chmur elektronowych, powodujące powstawanie chwilowych momentów dipolowych. Cząsteczka posiadająca chwilowy moment dipolowy może go wzbudzić w cząsteczce sąsiadującej, wskutek czego obie cząsteczki mogą się nawzajem chwilowo przyciągać lub odpychać. Uśrednienie sił odpychających i przyciągających daje w wyniku oddziaływanie przyciągające proporcjonalne do 1/r6. Oddziaływania van der Waalsa wynikają m.in. z korelacji ruchów elektronów pomiędzy oddziałującymi atomami - dlatego w metodach obliczeniowych nieuwzględniających korelacji elektronowej sił tych praktycznie nie ma.
Należy również uwzględnić fakt, że dla małych odległości pomiędzy atomami czy cząsteczkami pojawia się oddziaływanie odpychające pomiędzy powłokami elektronowymi, wynikające z obowiązywania zakazu Pauliego.
52. Wiązanie wodorowe (definicja, znaczenie).
Wiązanie wodorowe - rodzaj stosunkowo słabego wiązania chemicznego polegającego głównie na przyciąganiu elektrostatycznym między atomem wodoru i atomem elektroujemnym zawierającym wolne pary elektronowe. Klasyczne wiązanie wodorowe powstaje, gdy atom wodoru jest połączony wiązaniem kowalencyjnym z innym atomem o dużej elektroujemności (np. tlenem) i w ten sposób uzyskuje nadmiar ładunku dodatniego. W wyniku tego oddziaływania pierwotne, kowalencyjne wiązanie wodór - inny atom ulega częściowemu osłabieniu, powstaje zaś nowe, stosunkowo słabe wiązanie między wodorem i innym atomem (akceptorem wiązania wodorowego).
Znaczenie:
W biologii wiązanie wodorowe pełni zasadniczą rolę, ponieważ wartość jego energii jest pośrednia pomiędzy oddziaływaniem Van der Waalsa a wiązaniem kowalencyjnym. Wiązania wodorowe mogą stosunkowo szybko powstawać i zanikać, co ma szczególne znaczenie w reakcjach biochemicznych, które zachodzą zwykle w temperaturze pokojowej.
Przykładem znaczenia wiązań wodorowych jest ich wpływ na budowę cząsteczki DNA, główny nośnik informacji genetycznej wszystkich organizmów żywych. Składa się ona z dwóch łańcuchów nukleotydowych, które są skręcone jeden dookoła drugiego, tworząc podwójną helisę. Oba łańcuchy są utrzymywane razem przez wiązania wodorowe pomiędzy komplementarnymi parami zasad azotowych.
Inny przykład to białka. Główny łańcuch polipeptydowy białek składa się z jednostek, do których przyłączone są różne podstawniki, charakterystyczne dla 20 różnych istniejących w przyrodzie aminokwasów biogennych. Grupy aminowa i karbonylowa tworzą wewnątrzcząsteczkowe wiązanie wodorowe N-H...O=C, które determinuje konformację głównego łańcucha peptydowego odpowiedzialnego za tworzenie helikalnej, bądź płaskiej struktury.
Również w przypadku polisacharydów wiązania wodorowe pomiędzy grupami hydroksylowymi stabilizują ich strukturę, znacząco wpływając na ich właściwości.
substancje o małej masie molowej posiadają anomalnie wysokie temperatury wrzenia i topnienia w porównaniu z ich cięższymi analogami. Ta nieoczekiwanie wysoka temperatura potrzebna jest do zniszczenia silnych wiązań wodorowych przy uwalnianiu cząsteczek w czasie zmian stanu skupienia.
53. Typy oddziaływań międzycząsteczkowych. Wiązanie wodorowe (definicja i znaczenie).
Oddziaływania międzycząsteczkowe:
Siły międzycząsteczkowe są odpowiedzialne za odstępstwa gazów rzeczywistych od praw gazów doskonałych. Siły te są siłami słabymi w porównaniu z siłami powodującymi wytworzenie wiązań chemicznych wewnątrz cząsteczki. Energia oddziaływania jest rzędu 1-10 kcal/mol a więc około 10 -100 razy słabsza od energii wiązań chemicznych. Oddziaływania międzycząsteczkowe możemy podzielić na trzy główne rodzaje.
•orientacji; dipol -dipol,
dipol-kwadrupol
•indukcyjne;
dipol indukowany - dipol
•Dyspersyjne;
dipol chwilowy - dipol chwilowy
54. Definicja i znaczenie elektroujemności. 55. Elektroujemność - definicje i sposoby określania. Znaczenie elektroujemności w chemii.
Elektroujemność, elektronegatywność, zdolność atomów danego pierwiastka do przyciągania elektronów. Według R.S. Mullikena, wartość elektroujemności jest średnią arytmetyczną z powinowactwa elektronowego i pierwszej energii jonizacji.
Według L.C. Paulinga różnica elektroujemności między pierwiastkami A i B wyraża się wzorem: ExA - ExR = =[DAR - (DAADRR)1/2]1/2, gdzie DAR, DAA, DRR są energiami dysocjacji połączeń chemicznych A-B, A-A, B-B. Obie miary elektroujemności są do siebie w przybliżeniu proporcjonalne. Elektroujemność wzrasta w okresach układu okresowego od litowców do fluorowców i maleje w poszczególnych grupach ze wzrostem liczby atomowej.
Elektroujemność pierwiastków przejściowych zmienia się nieznacznie i nieregularnie, co związane jest z efektem przesłonowym (ekranowaniem) elektronów (n-1)d. Największą elektroujemnością charakteryzują się F, O, Cl. Najmniejszą Cs, Fr.
56. Dlaczego stopień utlenienia azotu w jonie NH4+ wynosi -3, natomiast w jonie NO2+ +3?
bo tlen jest bardziej elektroujemny od azotu, a azot od wodoru
57. Wyjaśnij, dlaczego stopień utlenienia azotu w azotanie (III) amonu jest równy zero.
jw., tylko mamy 2 atomy azotu, liczymy średnią . Jeden azot jest na -3 stopniu utlenienia, drugi na +3. ( -3+3)/2=0
58. Określ stopień utlenienia węgla w CH4 i CF4.
CH4 -IV,
CF4 +IV
59. Wyjaśnij, dlaczego stopień utlenienia siarki wynosi +2 w H2S2O3, a +6 w H2SO4.
ponieważ w kwasie tiosiarkowym stopień utl. siarki wynosi (-2)x3+(+1)x2 + S= 0, skąd S=+2, a w siarkowym jest jeden
60. Zdefiniuj stopień utlenienia oraz określ go dla siarki w: H2S, S8, SO2, SO3, H2SO4 i H2S2O3.
Stopień utlenienia - w chemii jest definiowany jako liczba elektronów, które dany atom przekazał lub przyjął od innego atomu w ramach tworzenia z nim wiązania chemicznego. Termin przekazanie lub przyjęcie może tu oznaczać zarówno pełne przekazanie elektronu innemu atomowi (lub ich grupie), co prowadzi do powstawania wiązania jonowego lub tylko częściowe przekazanie elektronów w formie wiązania kowalencyjnego:
stopień utlenienia pierwiastków w stanie wolnym wynosi zero, niezależnie od tego, czy substancja występuje w postaci pojedynczych atomów, czy w postaci cząsteczek, np. Fe0, N20, O0, O20, O30;
suma stopni utlenienia wszystkich atomów w cząsteczce obojętnej równa jest zero, a w jonie złożonym równa jest jego ładunkowi;
stopień utlenienia pierwiastka w jonie prostym jest równy ładunkowi jonu, np. Pb2+ - (+2), Ag+ - (+1), Pb4+ - (+4), Cl- - (-1),
stopień utlenienia fluoru we wszystkich związkach wynosi -1;
stopień utlenienia wodoru w związkach jest równy +1, z wyjątkiem wodorków metali, w których wynosi on -1, np. NaH;
stopień utlenienia tlenu w związkach wynosi -2, z wyjątkiem fluorków tlenu, w których wynosi +2 (OF2) lub +1 (O2F2) oraz związków zawierających wiązania tlen-tlen (nadtlenki, ponadtlenki);
metale zazwyczaj przyjmują dodatnie stopnie utlenienia;
pierwiastki pierwszych dwóch grup głównych występują wyłącznie na jednym stopniu utlenienia, i tak dla grupy 1 (litowce) na +1, grupy 2 (berylowce) na +2.
H2S -II, S8 0, SO2 +IV, SO3 +VI, H2SO4 +VI , H2S2O3 +II
61. Jaki jest stopień utlenienia azotu w amoniaku i azotanie (III) amonu? Napisz wzory i uzasadnij odpowiedź.
62. Dlaczego węgiel występuje na +4 stopniu utlenienia w czterochlorku węgla, a na -4 w metanie?
63. Jaki jest stopień utlenienia węgla w glukozie? Napisz wzór i uzasadnij.
64. Wyjaśnij podział ciał stałych na metale, izolatory i półprzewodniki.
Metale przewodzą prąd, ciepło, są kowalencyjne ciągliwe i łatwo obrabialne.
Izolatory nie przewodzą prądu i ciepła to je właśnie odróżnia od metali
Półprzewodniki są jak by pomiędzy izolatorami a metalami. Nie przewodzą tak dobrze ciepła iak metale ale też go nie izolują.
65. Dlaczego tylko jedna na około 10 milionów cząsteczek wody ulega dysocjacji elektrolitycznej? Odpowiedź uzasadnij.
Woda jest słabym elektrolitem, a tylko te ulegają całkowitej dysocjacji.
66. Omów znaczenie i właściwości fizykochemiczne wody, podaj przykłady.
Woda jest dobrym rozpuszczalnikiem i można w środowisku wodnym przeprowadzać różne reakcje.
Jest najbardziej rozpowszechnionym związkiem na ziemi.
Mieszanina jednorodna, wykorzystywana w produkcji, jest roztworem.
Cząsteczka wody jest bardzo trwała i zaczyna dysocjować dopiero powyżej 1800 K. Pomimo dużej trwałości woda jest substancją chemiczną aktywną.
67. Czy w cząsteczce wody potrzebne są „uszy” - dwa orbitale niewiążące atomu tlenu?
Tak bo cząsteczki wody mogą tworzyć wiązania wodorowe,
68. Wyjaśnij, dlaczego woda ma niezwykłe właściwości fizykochemiczne. Podaj przykłady.
Woda jest dobrym rozpuszczalnikiem i można w środowisku wodnym przeprowadzać różne reakcje.
Jest najbardziej rozpowszechnionym związkiem na ziemi.
Mieszanina jednorodna, wykorzystywana w produkcji, jest roztworem.
Cząsteczka wody jest bardzo trwała i zaczyna dysocjować dopiero powyżej 1800 K. Pomimo dużej trwałości woda jest substancją chemiczną aktywną.
69. Dlaczego lód nie tonie? Odpowiedź uzasadnij.
Lód ma mniejszą gęstość od wody
70. Definicja alotropii. Uzasadnij różnice we właściwościach fizykochemicznych tlenu O2 i ozonu O3. Podaj no schematy orbitali molekularnych cząsteczek
Alotropia - zjawisko występowania różnych odmian tego samego pierwiastka chemicznego różniących się właściwościami fizycznymi i chemicznymi. Odmiany alotropowe pierwiastka mogą różnić się między sobą budową kryształów lub liczbą atomów w cząsteczce[1].
Alotropia jest szczególnym przypadkiem polimorfizmu czyli różnopostaciowości substancji.
Odmiany alotropowe nie są różnymi stanami skupienia materii, ale przejścia z jednej odmiany alotropowej do drugiej są przemianami fazowymi pierwszego rzędu. Nie zachodzą one jednak w ściśle określonych temperaturach lecz są zależne od termicznej historii próbek. Powoduje to, że dany pierwiastek może występować w dwóch różnych odmianach alotropowych w tej samej temperaturze.
Ozon O3 zatrzymuje niebezpieczne promieniowanie UV, powstaje podczas burzy, tlen jest niezbędny do procesu oddychania.
Orbitale te, nazywane orbitalami
zdelokalizowanymi zdelokalizowanymi, są więc orbitalami wielocentrowymi, których
, kontur obejmuje wszystkie jądra atomowe obecne w cząsteczce.
Orbitale cząsteczkowe
można również wyznaczyć stosując teorię orbitali zhybrydyzowanych zhybrydyzowanych. Zakłada się, że w pierwszym etapie . następuje wymieszanie (hybrydyzacja) orbitali molekularnych atomnastępuje atomu
centralnego, a w drugim - liniowe nakładanie się zhybrydyzowanych
orbitali atomu centralnego z orbitalami atomowymi (lub również hybrydyzowanymi) pozostałych atomów. W ten sposób tworzą się orbitale dwucentrowe (których kontur obejmuje tylko dwa jadra
sąsiadujących ze sobą atomów) zwane orbitalami zlokalizowanymi
71. Definicja alotropii. Uzasadnij różnice we właściwościach fizykochemicznych grafitu tudzież diamentu. Omów strukturę przestrzenną kryształów diamentu i grafitu. Dlaczego właściwości fizykochemiczne diamentu i grafitu są odmienne?
Grafit jest miekki, można nim pisać, przewodzi prąd, diament jest najtwardszym znanym na ziemi materiałem , wykorzystuje się go do obróbki innych kamieni.
Diament i grafit są odmianami alotropowymi węgla.
kryształ
grafit
Różną się budową krystaliczną, dlatego ich właściwości fizykochemiczne są odmienne.
72. Charakterystyka fizykochemiczna stanu gazowego.
Stan gazowy, cząsteczki mają pełną swobodę ruchu, gaz przyjmuje każy kształt naczynia w jakim się znajduje. Cząsteczkiw stanie gazwoym zderzając się ze sobą mogą tworzyć nowe związki.
Gaz może mieć różne ciśnienie, co może zwiększać bądź zmienjszać szybkość powstawa nowych cząsteczek.
73. Budowa i znaczenie wody.
Woda jest najbardziej znanym związkiem, rozpuszczalnikiem, bez obecnośći wody nie można przeprowadzić znacznej ilości rekacji także tych zachodzących w organizmie człowieka, min. W komórkach ciała.
Woda składa się z 2 atomów wodoru i jednego atomu tlenu. W cząsteczce wody występują wiązania kowalencyjne spolaryzowane. Cząsteczka ma kształt tetraedryczny.
74. Napisz równania spalania paliw: węgla, metanu, benzyny (C7H16) i glukozy.
No chyba pod wpływem tlenu będzie się to spalalo do dwutlenku wegla, tlenku wegla i wegla..
75. Napisz równanie reakcji rozpuszczania gazowego dwutlenku węgla w ciekłej wodzie. Narysuj wzory strukturalne cząsteczek substratów i produktów i wyjaśnij, dlaczego roztwór uległ zakwaszeniu
CO2 + H2O = H2CO3 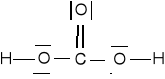
H2CO3 + H2O = H3O+ +HCO3- 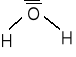
HCO3- + H2O = H3O+ + CO32- ![]()
Roztwór uległ zakwaszeniu ponieważ kwas węglowy jest bardzo nietrwały w środowisku wodnym i ulega dwustopniowej dysocjacji elektrolitycznej w której powstają jony H3O+ które warunkują kwasowość.
76. Napisz równanie utleniania i redukcji pomiędzy metaliczną miedzią i rozcieńczonym kwasem azotowym (V).
77. Napisz ogólne równanie fotosyntezy, zakładając powstanie glukozy.
6CO2 + 6H2O = C6H12O6 + 6O2
78. Napisz równanie sodu w wodzie (cząsteczkowo i jonowo).
Na + H2O = NaOH + ½ H2
Na + H2O = Na+ + OH- + ½ H2
79. Napisz równanie roztwarzania potasu w wodzie (cząsteczkowo i jonowo).
K + H2O = KOH + ½ H2
K + H2O = K+ + OH- + ½ H2
80. Napisz równanie spalania heptanu (C7H16) w nadmiarze powietrza.
C7H16 +11O2 = 7CO2 + 8H2O
81. Napisz symbole izotopów: a. argonu, b. wapnia, które mają taką samą liczbę neutronów, jak 40K.
82. Wyjaśnij, na czym polega promieniotwórcza przemiana α.
reakcja jądrowa rozpadu, w której emitowana jest cząstka α (jądro helu 24He2+). Strumień emitowanych cząstek alfa przez rozpadajace się jądra to promieniowanie alfa.
W wyniku tej reakcji powstające jądro ma liczbę atomową mniejszą o 2, a liczbę masową o 4 od rozpadającego się jądra.
83. Wyjaśnij, na czym polega promieniotwórcza przemiana β.
Rozpad beta to przemiana nukleonu w inny nukleon, zachodząca pod wpływem oddziaływania słabego. Wyróżnia się dwa rodzaje tego rozpadu: rozpad β − (beta minus) oraz rozpad β + (beta plus).
Rozpad β − polega na przemianie neutronu w proton poprzez emisję bozonu pośredniczącego W − przez jeden z kwarków d neutronu. W − rozpada się następnie na elektron i antyneutrino elektronowe według schematu:
Rozpadowi beta minus towarzyszy emisja promieniowania beta (elektronów), promieniowania gamma i antyneutrin elektronowych.
Rozpad β + polega na przemianie protonu w neutron, jednak aby reakcja ta mogła zaistnieć, konieczne jest dostarczenie energii z zewnątrz. Proton przemienia się w neutron poprzez emisję bozonu W + , który rozpada się na pozyton oraz neutrino elektronowe według równania:
84. Promieniowanie γ.
wysokoenergetyczna forma promieniowania elektromagnetycznego. Za promieniowanie gamma uznaje się promieniowanie o energii kwantu większej od 10 keV, co odpowiada częstotliwości większej od 2,42 EHz, a długości fali mniejszej od 124 pm. Zakres ten częściowo pokrywa się z zakresem promieniowania rentgenowskiego. W wielu publikacjach rozróżnienie promieniowania gamma oraz promieniowania X opiera się na ich źródłach, a nie na długości fali. Promieniowanie gamma wytwarzane jest w wyniku przemian jądrowych albo zderzeń jąder lub cząstek subatomowych, a promieniowanie rentgenowskie, w wyniku zderzeń elektronów z atomami. Promieniowanie gamma jest promieniowaniem jonizującym i przenikliwym. Nazwa promieniowania gamma pochodzi od greckiej litery γ.
85. Reguła Fajansa i Soddy'ego. Napisz równania przemian α i β dla pierwiastka AZX.
Prawo przesunięć, inaczej prawo lub reguła Soddy'ego i Fajansa, określa w jaki sposób określony typ przemiany pierwiastka promieniotwórczego wpływa na rodzaj wytworzonego nuklidu:
W przypadku rozpadu α (przemiany α) powstaje pierwiastek o liczbie atomowej mniejszej o 2 oraz liczbie masowej mniejszej o 4 (przesunięcie w układzie okresowym o 2 miejsca w lewo):
W przypadku rozpadu β- (przemiany β-) powstaje - nuklid izobaryczny - jądro pierwiastka o liczbie atomowej większej o 1 oraz tej samej liczbie masowej (przesunięcie w układzie okresowym o 1 miejsce w prawo):
W przypadku rozpadu β+ (przemiany β+) powstaje - nuklid izobaryczny - jądro pierwiastka o liczbie atomowej mniejszej o 1 oraz tej samej liczbie masowej (przesunięcie w układzie okresowym o 1 miejsce w lewo):
alfa
beta minus
- beta plus
86. Wychwyt elektronów K przez jądro.
Wychwyt elektronu (zwany też odwrotną przemianą beta) - reakcja jądrowa, w której jeden z elektronów atomu jest przechwytywany przez proton z jądra atomowego, w wyniku czego powstaje neutron (pozostający w jądrze) i neutrino elektronowe, które jest emitowane:
87. Zastosowania praktyczne promieniotwórczości.
reakcje jądrowe (rozszczepianie atomów)
otrzymywanie energii (prądu)
medycyna (prześwietlenia rentgenowskie)
wskaźniki promieniotwórcze
śledzenie wędrówki i przemian w organizmach żywych
badanie dyfuzji
określanie rozpuszczalności substancji trudno rozpuszczalnych
badanie mechanizmów reakcji chemicznych
sterylizacja żywności
badanie wieku rzeczy (zaw. Izotopu węgla 14C)
88.Zagrożenia promieniotwórczości.
brak możliwości stałego kontrolowania rozpadu
odpady radioaktywne
zagrożenie awarią/ wybuchem np. elektrowni jądrowych
zanieczyszczenie środowiska
choroba popromienna
89.Rodzaje reakcji promieniotwórczych.
Procesy rozpadu jądrowego
Rozpad alfa
Rozpad beta
Rozpad beta minus
Rozpad beta plus
Wychwyt elektronu
Emisja gamma
Emisja neutronu
Emisja protonu
Rozszczepienie jądra atomowego
Procesy syntezy jądrowej
Wychwyt neutronu
Proces r
Proces s
Wychwyt protonu
Proces p
90.Kryteria stabilności jąder atomowych.
Wielkością charakteryzującą stabilność jąder atomowych jest energia wiązania jądra. Im wyższa energia tym wyższa trwałość jądra atomowego.
Trwałe jądra mają pierwiastki, w których:
Ln/Lp=(1-1,6)
gdzie Ln- liczba neuronów
Lp- liczba protonow
Liczba masowa A < 209
W innych przypadkach jądra ulegają samorzutnym rozpadom.
Wyszukiwarka
Podobne podstrony:
pyt egz chemia, chemia
PYT EGZ MASZYNY OPRACOWANIE, Polibuda, III semestr, Maszyny Elektryczne
prawo konstytucyjne opracowane zagadnienia, temty,pyt egz 2AXWBIM454BFJSNIZVIONOCPKAPNFIQFHU3C2TI
PYT-EGZ-MASZYNY-OPRACOWANIE, Politechnika Poznańska, 2 rok, III, Maszyny el
Historia USA opracowane pyt egz 2
NOM ( I kolokwium II semestr) opracowane przez Piaska, Politechnika Poznańska ZiIP, II semestr, nom
chemia zywnosci pyt egz
Badania marketingowe - wszystkie tematy z całego semestru (opracowane), WSFiZ Białystok - zarządzani
Wartość odżywcza, semestr 6-7, opracowanie nowych prod
pyt - egz - konsolidacja1, UEK, FiR IV SEMESTR, Konsolidacja Sprawozdań Finansowych
pyt egz calosc, Geodezja, semestr VI, Fotogrametria i teledetekcja II
pyt egz nieorganiczna, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, pytania na e
Historia nauki II semestr opracowane zagadnienia
Fizjologia zaliczenie ćwiczeń w II semestrze (opracowane zagadnienia)
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
więcej podobnych podstron