Imię i nazwisko
Paweł Zmora |
Wydział
Rolniczy |
Grupa
A3 |
Numer ewidencyjny
7 |
Temat ćwiczenia
Konduktometria
|
Data wykonania
14.03.2006 |
Data zaliczenia |
|
5. Konduktometria
Cel ćwiczenia
Oznaczenie stężenia roztworu metoda miareczkowania konduktometrycznego.
Oznaczenie stopnia i stałej dysocjacji oraz pH słabego elektrolitu.
MIARECZKOWANIE KONDUKTOMETRYCZNE
Zasada pomiaru
Oznaczanie zawartości kwasu metodą miareczkowania konduktometrycznego polega na pomiarze zmian przewodności roztworu podczas reakcji zobojętniania. Podczas miareczkowania mocnego kwasu solnego mocną zasadą sodową przebiega reakcja:
H+ + Cl- + Na+ + OH- ⇔ Na+ + Cl- + H2O
W reakcji tej jony wodorowe o wysokiej przewodności są stopniowo zastępowane przez jony sodowe. Dodawanie zasady powoduje, więc gwałtowny spadek przewodności (ryc. I). Po przekroczeniu punktu równoważności miareczkowania opór roztworu maleje - wzrasta przewodność, co spowodowane jest zwiększeniem się liczby ruchliwych jonów wodorotlenowych. Minimum krzywej miareczkowania konduktometrycznego wskazuje punkt równoważności miareczkowania.
Na rycinie I przedstawiono również krzywą miareczkowania słabego kwasu mocną zasadą. W pierwszej fazie przewodność miareczkowania roztworu spada, w wyniku zmniejszania się obecnych w roztworze niewielkich ilości jonów wodorowych. W następnej fazie w miejsce słabo dysocjowanego kwasu octowego pojawia się całkowicie dysocjowany octan sodowy, w związku z tym przewodność roztworu wzrasta. Po przekroczeniu punktu równoważności przewodność wzrasta szybciej wskutek wzrostu liczby jonów wodorotlenowych.
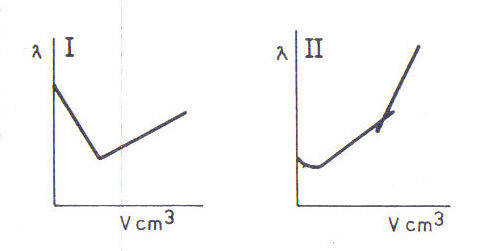
Ryc. I Krzywe miareczkowania konduktometrycznego: I - mocnego kwasu mocną zasadą, II - słabego kwasu mocną zasadą.
Wykonanie ćwiczenia
Przed rozpoczęciem pomiarów naczyńko oporowe przemywamy kilkakrotnie wodą destylowaną w zlewce na 250 cm3. Otrzymany do analizy roztwór rozcieńcza się w kolbie miarowej do 100 cm3 i po dokładnym zmieszaniu odmierza pipetą 10 cm3 tego roztworu do zlewki na 400 cm3. Do zlewki dodaje się tyle wody destylowanej, żeby dolna część czujnika konduktometrycznego (w rozszerzonej osłonie szklanej) była całkowicie zanurzona. Odległość między spodem czujnika a dnem zlewki powinna wynosić około 3 cm.
Pokrętło „rodzaj pracy” ustawić w położeniu K. Włączyć zasilanie przez przyciśnięcie klawisza z lewej strony przyrządu, co sygnalizowane jest podświetleniem klawisza.
Pokrętłem „regulacja K” ustawić wskazówkę na wartość 0,48 cm-1, odpowiadającą stałej czujnika zastosowanego w przyrządzie (dolna podziałka od 0,4 do 1,2 cm-1). Położenie pokrętła K zawsze wpływa na wskazania, dlatego podczas pomiarów nie należy go zmieniać. Po ustaleniu wartości K pokrętło „rodzaj pracy” ustawić w położeniu „aut” (pomiar z automatyczną kompensacją zmian temperatury).
Pokrętło „współczynnik temperaturowy” ustawić na wartość 2,2%.
Pokrętło „zakres” ustawić w takiej pozycji, żeby wychylenie wskazówki było możliwe jak największe, w granicach górnej skali przyrządu.
Zanotować położenie pokrętła „zakres” oraz położenie wskazówki na górnej skali konduktometru (0-100) jako punkt wyjścia pomiarów (0 cm3 NaOH).
Napełnić biuretę roztworem NaOH o stężeniu 0,1 mol⋅dm-3. Roztwór ten wprowadzać do zlewki z miareczkowanym kwasem po 0,2 cm3, ciągle mieszając i notować wskazania konduktometru w tabeli I.
Sposób przedstawienia wyników
Tabela I. Wyniki miareczkowania konduktometrycznego.
Liczba cm3 roztworu NaOH zużytego do miareczkowania |
Przewodność roztworu miareczkowanego (mS⋅cm-1) |
|
|
Wyniki z tabeli I przedstawiamy na wykresie (na osi odciętych całkowita objętość dodanej zasady, w centymetrach sześciennych, na osi rzędnych przewodność roztworu, w milisiemensach na centymetr). Z wykresu znajdujemy objętość roztworu zużytą do zobojętnienia kwasu (minimum przewodności). Miareczkowanie powtarzamy trzykrotnie, na podstawie średniej liczby centymetrów sześciennych roztworu zasady zużytej do miareczkowania, obliczamy liczbę gramów kwasu w badanej próbce. Po zakończeniu pomiarów naczyńko pomiarowe konduktometru przemywamy i pozostawiamy w zlewce z woda destylowaną.
2. OZNACZANIE STOPNIA I STAŁEJ DYSOCJACJI ORAZ pH SŁABEGO ELEKTROLITU
Zasada pomiaru
Stopień dysocjacji jest zdefiniowany równaniem:
![]()
gdzie x - stężenie cząstek zdysocjowanych, c - stężenie ogólne. Z tego równania można wyznaczyć stężenie cząstek zdysocjowanych (α⋅c) i nie zdysocjowanych (1-α)c. Dla nierozcieńczonego roztworu słabego kwasu (np. octowego) w stanie równowagi stężenia reagentów wynoszą:
CH3COOH ⇔ H+ + CH3COO−
(1-α)c α⋅c
z definicji pH = -log H+, stąd
pH = -log α⋅c
Stała dysocjacji wyrażona za pomocą stężeń jest określona równaniem:
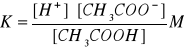
stąd:
![]()
Po przekształceniu otrzymujemy prawo rozcieńczeń Ostwalda:
![]()
Metodę konduktometryczną można wykorzystać do oznaczenia stopnia dysocjacji, następnie pH roztworu oraz stałej dysocjacji. W tym celu należy zmierzyć przewodność właściwą roztworu o znanym stężeniu c w temperaturze 25°C, obliczyć przewodność równoważnikową i uwzględniając przewodność graniczną ( w temperaturze 25°C jest to wielkość tabelaryczna) oznaczyć wartość stopnia dysocjacji α.
Metodę traktujemy jako przybliżoną i wykorzystujemy do roztworów elektrolitów słabych o niskich stężeniach, w których współczynniki aktywności są bliskie 1.
Wykonanie ćwiczenia
W pięciu kolbach miarowych na 100 cm3 przygotowujemy roztwory badanego elektrolitu o różnych stężeniach (np. 0,0025, 0,005, 0,01, 0,02, 0,05M). Kolby umieszczamy w termostacie w temp. 25°C. Oznaczamy przewodność właściwą najpierw wody destylowanej użytej do rozcieńczania roztworów (), a następnie poszczególnych roztworów (κr), rozpoczynając od najbardziej rozcieńczonego. Przed każdym pomiarem naczyńko oporowe konduktometru przemywamy badanym roztworem. Wyniki przedstawiamy w tabeli II. Jako przewodność właściwą elektrolitu traktujemy różnicę między przewodnością roztworu (κr) a przewodnością wody destylowanej (κ0).
Tabela II. Oznaczenie stałej dysocjacji metodą konduktometryczną.
Nr |
c [M] |
κ [S⋅m-1] |
λ [S⋅m2⋅mol-1] |
α |
K [M] |
pH |
|
|
|
|
|
|
|
Obliczenia
Przewodność właściwa roztworu kwasu octowego o stężeniu 0,1 M (po uwzględnieniu przewodności wody destylowanej użytej do rozcieńczania) w temperaturze 25°C wynosi 0,52 mS⋅cm-1. obliczyć pH i wartość stałej dysocjacji K, znając przewodność graniczna kwasu octowego w temperaturze 25°C: λ0 = 0,03907 S⋅m2⋅mol-1.
![]()
Wyszukiwarka
Podobne podstrony:
Imię i nazwisko
fizyka dynamika - pr klasowa, Imię i nazwisko:
okulistyka wejsciowki gielda, Test+z+anatomii+grupa++++++październikowa, Imię nazwisko…&helli
Sprawozdanie 11, Imię i nazwisko
III Klasa, 4.IIIB.Grupa B(PP), Grupa B Imię i nazwisko ucznia
test-pokarmowy-1, IMIĘ I NAZWISKO:
test, Imię i nazwisko
testy, MobCom 2006 F, Imię i nazwisko
Ćw nr 45, 45, Imie Nazwisko
testy, MobCom 2006 D, Imię i nazwisko
7 Chromatografia jonowymienna, 7. chromatografia jonowzmienna, Imię i nazwisko
kartkowka 4, obwód prostokąta i kwadratu, Imię i Nazwisko:
fizyka-energia, Imię i nazwisko:
Wersja B Nerwy i zmysły 2010 Imię i Nazwisko, Spradziany
GPw UE Zestaw pytan 2011 Heffner, Imię i Nazwisko:
S2, 1.Grupa A, Grupa A Imię i nazwisko ucznia
Zadania dr Marty Kuc, spr4, Imię i nazwisko: ………………&hellip
HODOWLA ROŚLIN-test, Imię i nazwisko……………………
więcej podobnych podstron