I BD 1999-03-05
1998/99r.
Rybak Krzysztof
SPRAWOZDANIE Z ĆWICZENIA NR 5 .
TEMAT : WYZNACZANIE WARTOŚCI DLA POWIETRZA METODĄ
CLEMENTA I DESORMESA .
Zagadnienia teoretyczne .
Termodynamika to dział fizyki zajmujący się zjawiskami cieplnymi (termicznymi) zachodzącymi w układach makroskopowych.
Gazami nazywamy substancje charakteryzujące się dużą ściśliwością (sprężystością objętościową - dużymi zmianami objętości pod działaniem sił zewnętrznych) oraz dużą rozprężliwością (dążnością do wypełnienia całej objętości).
Stan gazu określany jest przez podanie trzech jego parametrów:
- T [K] - temperatury bezwzględnej,
- p [N/m2] - ciśnienie,
-V [m3] - objętość.
Są trzy podstawowe zasady termodynamiki :
I zasada termodynamiki - to prawa zachowania energii dla układów termodynamicznych. Z zasady tej wynika istnienie funkcji stanu U zwanej energią wewnętrzną. W dowolnej przemianie termodynamicznej układu zamkniętego zmiana energii wewnętrznej jest równa ciepłu dostarczonemu do układu i pracy wykonanej nad układem.
dU = dQ + dW (W i Q zależą od rodzaju procesu).
Z mikroskopowego punktu widzenia U jest równe sumie średnich wartości energii kinetycznej bezładnego ruchu (postępowego, obrotowego, drgań) cząsteczek układu oraz energii oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych (energii potencjalnej).
II zasada termodynamiki - prawo określające kierunek procesów zachodzących w układach makroskopowych. Można ją sformułować jako niemożność zrealizowania perpetum mobile II-giego rodzaju, tj. że niemożliwe jest pobieranie ciepła z jednego termicznie jednorodnego ciała i zamiana go na pracę bez wprowadzenia zmian w otoczeniu (tj. niemożliwy jest proces, którego jednym wynikiem jest przekazywanie energii w postaci ciepła od ciała o niższej temperaturze, bez wprowadzania zmian w otoczeniu).Z zasady tej wynika istnienie funkcji stanu S zwanej entropią. (definicja: zmiana ΔS w izotermicznym procesie odwracalnym jest równe stosunkowi ciepła dostarczonego układowi do temperatury bezwzględnej układu - prawo wzrostu entropii).
III zasada termodynamiki - przy T > 0 K entropia dąży do zera.
Dla gazu doskonałego parametrów gazu nie można zmieniać dowolnie. Jeśli masa gazu jest stała są one ze sobą związane tzw. równaniem stanu:
![]()
Lub równaniem stanu Mendelejewa - Clapyerona:
![]()
Gdzie:
n - liczba moli gazu, n=m/μ
m- masa gazu,
μ - masa kilomola gazu,
R - uniwersalna stała gazowa (R = 8.314* 10 J/kmol*K);
Równanie stanu gazu wynika z doświadczalnie znalezionych praw w sytuacjach, gdy jeden z parametrów gazu jest stały, a mianowicie przemian gazowych:
gdy T = const.
zachodzący proces nazywa się izotermicznym; zależność
ciśnienia od objętości podaje prawo Boylea'a i Mariotte'a
p ⋅ v = const.
gdy p = const.
Zachodzący proces nazywa się izobarycznym; zależność objętości od temperatury podaje prawo Gay - Lussaca
![]()
.
gdy V = const.
Zachodzący proces nazywa się izochorycznym; zależność ciśnienia od temperatury podaje prawo Charlesa
![]()
.
Przemiana adiabatyczna - bez wymiany ciepła z otoczenia; zależność ciśninia od
objętości podaje prawo Poissona
(p.* V![]()
gdzie χ - wykładnik adiabatyczny)
Cząsteczki każdego gazu w tenperaturze T poruszają się zawsze z pewnymi prędkościami. Wzór opisujący ruch cząsteczek jako pierwszy wprowadził Maxwell
ΔN = ![]()
gdzie:
N - liczba wszystkich cząsteczek
Energia kinetyczna całej masy gazu, czyli N cząsteczek wynosi Ek =N ⋅f ⋅ ![]()
gdzie: f - ilość stopni swobody cząsteczki gazu.
Ciepłem właściwym nazywamy stosunek ilości ciepła pobranego do masy układu oraz do zmiany temperatury wywołanej pobraniem ciepła
c = ![]()
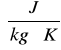
Wartość c zależy od rodzaju substancji a w szczególności od stanu skupienia.
Pomiędzy ciepłem przy stałej objętości Cv i stałym ciśnieniu Cp zachodzi związek.
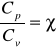
![]()
- wykładnik adiabatyczny
2). Wykonanie ćwiczenia:
Zamknąć kurek K1 i zagęszczać w butli powietrze za pomocą pompki do momentu, gdy różnica poziomu cieczy wyniesie kilka podziałek.
Odczekać kolka minut, by różnica poziomów w monometrze ustaliło się, odczytać ją i oznaczyć h1 .
Otworzyć kurek K1 , aby ciśnienie w butli wyrównało się z ciśnieniem atmosferycznym.
Odczekać kilka minut, aż wskazania monometru ustalą się. Zapisać nadwyżkę ciśnienia h2 .
Obliczyć wartość
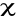
.Tabelka.
Lp. |
h1 |
h2 |
h1 - h2 |
|
|
- |
[m] |
[cm] |
[cm] |
[-] |
- |
1. |
14,7 |
3,4 |
11,3 |
|
|
2. |
7,4 |
1,6 |
5,8 |
|
|
3. |
6,6 |
1,5 |
5,1 |
|
|
4. |
14,3 |
3,3 |
11,0 |
|
|
5. |
12,1 |
2,7 |
9,4 |
|
|
6. |
10,6 |
2,5 |
8,1 |
|
|
1,2944 |
Obliczenia:
![]()
Obliczenie błędu:
![]()
![]()
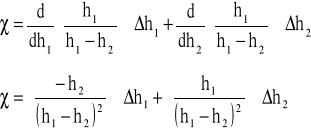
![]()
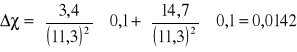
Wnioski.
Można stwierdzić, że ćwiczenie zostało prawidłowo wykonane, albowiem różnica pomiędzy wartością ![]()
0,0142 wyliczonego przez nas, a wyczytaną z tablic ![]()
jest niewielką. Zważywszy na to, że nie zostały zachowane wszystkie warunki pomiarowe.
1
3
Wyszukiwarka
Podobne podstrony:
Ćw nr 1, 01., I BD
Ćw nr 1, 01., I BD
Ćw nr 5, 05.., 03
Biofizyka kontrolka do cw nr 05 Nieznany (2)
Ćw nr 5, 05.
Biofizyka instrukcja do cw nr 05
Biofizyka instrukcja do cw nr 05
Cw nr 05 Pneumatyczne sterowanie wysuwan
Ćw nr 5, FIZ5, Chowaniec Aleksander
Ćw nr 9, 9, Chowaniec Aleksander
Ćw nr 8, 8, Chowaniec Aleksander
więcej podobnych podstron