Motto wieczoru: ,,Proszę brać się do nauki aby lepiej zgłębić tajniki tej magicznej sztuki!”
Dygresja do wykładu wcześniejszego

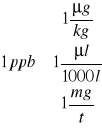
Zadanie:
U babci w piwnicy znaleziono tajemniczą butelkę 0,5l z napisem 12N AuCl3. Czy gra jest warta świeczki?

Układ okresowy
Pytania egzaminacyjne
Wymienić pierwiastki takiej i owakiej grupy. Podać konfigurację elektronową oraz stopnie utlenienia.
Omówić właściwości pierwiastków danej grupy układu okresowego.
Podać własności jakiegoś pierwiastka metal/niemetal omówić rozpowszechnienie, otrzymywanie, sposoby wykrywania, znaczenie ekologiczne, znaczenie gospodarcze i całą resztę, jakieś reakcje, wzory itp. (odpuścić sobie lantanowce i aktynowce)
Rys historyczny
1869 rok - Prawo okresowości: własności pierwiastków zmieniają się w sposób okresowy w miarę wzrostu masy atomowej (we współczesnym prawie okresowości mówimy o liczbie atomowej).
Budowa materii
1911 Model atomu Rutherforda - układ planetarny dodatnie naładowane jądro i elektrony krążą po orbitach
1913 Model atomu Bohra - jak wyżej, tylko że wprowadził pojęcie kwantowania, jak elektron zmienia orbitę z wyższej na niższą to oddaje energię E=hf.
Ciekawostka: Bohr dostał stypendium od koncernu piwowarskiego Carlsberg1920 MECHANIKA KWANTOWA, równanie Schrödingera
Proton + |
1,007u |
10-15m |
1,6·10-19C |
Neutron |
1,0087u |
10-15m |
- |
Elektron |
0,00055u |
10-16m |
1,6·10-19C |
1u to jest 1/12 atomu węgla
1u=1,66·10-24g
neutron rozpada się na proton, elektron i neutrino - cząstkę bardzo małą o ogromnej przenikalności
Jakiej długości powinien być pręt ołowiany, który wyhamowałby pędzące neutrino?
Odpowiedź - jeden rok świetlnyW sześcian o objętości 1cm3 ułożymy jeden obok drugiego protony/neutrony. Ile ważyłaby taka kostka?
Odpowiedź ok. 100mln t
Pojęć kilka:
Liczba atomowa - jest to liczba protonów w jądrze (liczba porządkowa pierwiastków)
Liczba masowa - suma protonów i neutronów
Pierwiastek chemiczny - zbiór atomów posiadających tą samą liczbę atomową
Izotop - odmiana pierwiastka posiadająca taką samą liczbę protonów w jądrze ale różną liczbę neutronów np. dla wodoru są to prot, deuter i tryt
Masa atomowa - średnia masa izotopów danego pierwiastka
![]()
Liczby kwantowe
Główna liczba kwantowa - (n=1,2,3,…,∞) kwantuje energię elektronów w atomie, decyduje o wielkości obszaru orbitalnego ; zbiór stanów kwantowych o tej samej wartości głównej liczby kwantowej nazywa się powłoką elektronową
Wzór 2n2 K2 L8 M18 N32 O50 P72 Q98
Poboczna liczba kwantowa - kwantuje orbitalny moment pędu oraz decyduje o kształcie obszaru orbitalnego. Moment pędu = mvr l=(0,1,2…) tj. (n-1)
s2 |
sharp |
|
p6 |
principal |
|
d10 |
diffuse |
|
f14 |
fundamental |
|
Magnetyczna liczba kwantowa - kwantuje orientację przestrzenną orbitalnego momentu pędu - decyduje o orientacji przestrzennej podpowłoki 2l+1 m=-1,0,1,…
Spinowa liczba kwantowa - kwantuje wewnętrzny moment pędu elektronu s=0,5 wynika z ruchu wirowego wokół osi
Magnetyczna spinowa liczba kwantowa - określa orientację przestrzenną wektora spisnu ms=0,5 ms=-0,5
W rzeczywistości wystarczy znajomość 4 liczb kwantowych, ponieważ spinowa liczba kwantowa = const.
W obrębie podpowłoki wartość energii elektronu zmieniają się w sposób s < p < d < f
Chemia ogólna i nieorganiczna wykład dr inż. Bogdan Wyrwas 20.10.2009r.
Wyszukiwarka
Podobne podstrony:
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia Wykład 6
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Chemia Wyklad 4 id 111675
chemia wykłady (6)
Chemia Wykład 9
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
chemia wykład
(CHEMIA WYKŁAD 7)
chemia wyklady wskrzynka(1), BUDOWNICTWO PŁ, Semestr I, chemia wykład
10.dysocjacja wykład, AGH różne, chemia wykłady
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
chemia wykład 2
3 chemiaogolna wyklad 061009
chemia wykłady (2)
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
więcej podobnych podstron