Opracowanie pomiarów Michalak Michał
1. Obliczam stężenie roztworów kwasu octowego przed podziałem ci i po podziale ciα w warstwie wodnej korzystając ze wzoru:
![]()
gdzie:
ck - stężenie roztworu kwasu octowego
cz - stężenie NaOH
Vk - objętość kwasu octowego wzięta do miareczkowania
Vz - objętość roztworu NaOH zużyta na zmiareczkowanie kwasu octowego.
Obliczenia podaję dla stężenia kwasu octowego 0,2 mol/dm3. Pozostałe wyniki obliczeń umieściłem w tabeli poniżej
- przed podziałem
![]()
- po podziale
![]()
2. Obliczam stężenie kwasu octowego zaadsorbowanego na węglu aktywnym c2:
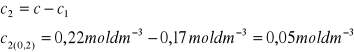
3. Obliczam adsorpcję a, czyli liczbę moli kwasu octowego zaadsorbowanego przez 1 kg adsorbenta. W tym celu korzystam z zależności Guggenheima-Adama, słusznej w przypadku roztworów rozcieńczonych:
![]()
gdzie:
V = 0,020 dm3 - objętość kwasu octowego użyta do adsorpcji
mw = 0,0009 kg - masa węgla aktywnego użytego do adsorpcji
![]()
4. Wykreślam zależność adsorpcji od stężenia kwasu octowego a=F(c)
5. Wykreślam zależność lga = f(lgc), a następnie metodą graficzną i metodą najmniejszych kwadratów wyznaczam stałe n i k równania: ![]()
- dla metody graficznej
Współczynnik podziału k jest równy: ![]()
, gdzie lg k odczytuję z wykresu. Jest to wartość liczbowa przecięcia prostej z osią y. Wartość lg k jaką odczytałem z wykresu wynosi: 0,535.
![]()
Stała n powiązana jest ze współczynnikiem nachylenia prostej i równa jej odwrotności.
![]()
![]()
- dla metody najmniejszych kwadratów
Równanie linii prostej wyznaczam przy pomocy funkcji REGLINP w edytorze Microsoft Excel. Równanie, które otrzymałem ma postać: y = 0,7805x + 0,5344. Współczynnik podziału k jest równy: ![]()
, gdzie k wyrazowi wolnemu równania, czyli lg k = 0,5344.
![]()
Stała n powiązana jest ze współczynnikiem nachylenia prostej i równa jej odwrotności.
![]()
![]()
6. Przedstawiam równanie izotermy uwzględniając stałe uzyskane w ćwiczeniu:
- dla metody graficznej
![]()
- dla metody najmniejszych kwadratów
![]()
Tabela wyników obliczeń:
Objętość kwasu zużyta do adsorpcji V = 0,020 dm3 |
|||||
Masa węgla aktywnego mw = 0,0009 kg |
|||||
c [mol dm-3] |
c1 [mol dm-3] |
c2 [mol dm-3] |
a [mol kg-1] |
lgc |
lga |
0,22 |
0,17 |
0,05 |
1,178 |
-0,6517 |
0,0711 |
0,32 |
0,27 |
0,05 |
1,156 |
-0,4949 |
0,0628 |
0,55 |
0,45 |
0,10 |
2,278 |
-0,2616 |
0,3575 |
0,66 |
0,54 |
0,12 |
2,611 |
-0,1838 |
0,4168 |
0,88 |
0,73 |
0,15 |
3,333 |
-0,0539 |
0,5229 |
0,96 |
0,83 |
0,14 |
3,000 |
-0,0177 |
0,4771 |
Stałe równania Freundlicha |
1/n |
n |
k |
||
Metoda graficzna |
0,786 |
1,272 |
3,428 |
||
Metoda najmniejszych kwadratów |
0,7805 |
1,281 |
3,423 |
||
Celem ćwiczenia było wyznaczenie stałych k i n równania Freundlicha na podstawie badań adsorpcji kwasu octowego na węglu aktywnym.
Do sprawozdania dołączyłem wykres wykonany na papierze milimetrowym.
Po wykonaniu ćwiczenia stwierdzam, że stała k wynosi w metodzie graficznej 3,428, a najmniejszych kwadratów 3,423. Wartości te zbliżone są do siebie, a wręcz są prawie identyczne tak jak wartości stałej n (metoda graficzna - 1,272, metoda najmniejszych kwadratów - 1,281).
2
Wyszukiwarka
Podobne podstrony:
24 Adsorpcja kwasu octowego na węglu aktywnym
ADSORPCJA W UKŁADZIE ROZTWÓR – CIAŁO STAŁE NA PRZYKŁADZIE?SORPCJI KWASU OCTOWEGO NA WĘGLU AKTYWNYMx
Wyznaczanie izotermy?sorpcji ?osprcja kwasu octowego na węglu aktywnym
Adsorpcja kwasu octowego na w�glu aktywowanym
Adsorpcyjne usuwanie zanieczyszczeń na węglu aktywnym
Sprawko+ +Adsorpcja+na+granicy+faz+ciało+stałe ciecz +Wyznaczanie+adsorpcji+barwnika+na+węglu+aktywn
ADSORPCJA PARACETAMOLU NA WEGLU AKTYWNYM
Adsorpcja na granicy faz ciało stałe ciecz Wyznaczanie izotermy adsorpcji na węglu aktywnym
Usuwanie?rwy ścieku metodą?sorpcji na węglu aktywnym sprawko
Wyznaczanie izoterm?sorpcji jednokarboksylowych kwasów organicznych na węglu aktywnym
19 ADSORBCJA NA GRANICY FAZ CIAŁO STAŁE CIECZ WYZNACZANIE ADSORBCJI BARWNIKA NA WĘGLU AKTYWNYM
kubica,biofizyka L,?sorpcja błękitu metylenowego na węglu aktywnym w obecności?etonux
D19231027 Rozporządzenie Rady Ministrów z dnia 3 grudnia 1923 r w przedmiocie zmian w postanowienia
więcej podobnych podstron