tHubert Kowalczyk
Wpływ rodzaju kwasu na szybkość inwersji sacharozy Ćwiczenie nr 18 |
||
Data wykonania ćwiczenia 29.04.2004
|
Zaliczenie |
Potwierdzenie zdania sprzętu |
Tabela wyników
Katalizator: HCl (c= 1mol/dm3) Stała dysocjacji HCl: Ka = 107 mol/dm3
t [min] |
t [s] |
αt [deg] |
|
kobl [S-1] |
kobl [S-1] |
Kgraf [S-1] |
Knum [S-1] |
10 |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
75 |
|
|
|
|
|
|
|
90 |
|
|
|
|
|
|
|
105 |
|
|
|
|
|
|
|
Tabela wyników
Katalizator: H2SO4 (c= 0,5mol/dm3) Stała dysocjacji H2SO4: Ka = 107 mol/dm3
t [min] |
t [s] |
αt [deg] |
|
kobl [S-1] |
kobl [S-1] |
Kgraf [S-1] |
Knum [S-1] |
10 |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
75 |
|
|
|
|
|
|
|
90 |
|
|
|
|
|
|
|
105 |
|
|
|
|
|
|
|
Temperatura otoczenia tp [oC] = ...........................
Zarys teoretyczny:
Reakcja inwersji sacharozy jest typowym przykładem katalizy kwasowej, w której rolę katalizatora spełniają jony wodorowe (H+).W trakcie przebiegu tej reakcji w roztworze wodnym, sacharoza (S) rozpada się na dwa cukry proste glukozę (G) i fruktozę (F), które tworzą tzw. cukier zinwertowany (B). Badania mechanizmu reakcji inwersji sacharozy wykazały, że zachodzi ona w dwóch etapach:
Tworzenie produktu pośredniego (kompleksu SH+) sacharozy z jonami wodorowymi zgodnie z równaniem
gdzie k1,k2 - stałe szybkości reakcji tworzenia i rozpadu kompleksu (SH+), v1,v2 - szybkości tych reakcji
Tworzenie cukru zinwertowanego (B) według równania:
gdzie k1,v2 - stała szybkości i szybkość reakcji tworzenia cukru zinwertowanego
Utworzony produkt pośredni (SH+) jest bardzo reaktywny i z dużą stałą szybkości rozpada się na produkty końcowe reakcji. W celu wyznaczenia stężeń [SH+] stosuje się metodą stanu stacjonarnego (zasada Bodensteina) która zakłada, że stężenie produktu przejściowego jest zawsze bardzo mała (może być on np. niewykrywalny). Szybkość wzrostu jego stężenia musi być również mała. Można więc założyć, że wypadkowa szybkość powstawania kompleksu vSH+ jest równa zeru, czyli:
![]()
Szybkość tę można powiązać z wcześniej zdefiniowanymi pojęciami - v1,v-1,v2 następującą zależnością vSH+ = v1 - v-1, -v2. Stąd
![]()
Wyrażenia: [S],[H+],[SH+],[H2O] oznaczają stężenia poszczególnych reagentów. Z ostatniego równania można wyznaczyć stężenie kompleksu [SH+], które wynosi:
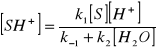
OPRACOWANIE I DYSKUSJA WYNIKÓW POMIARÓW
Jako pierwsze obliczyłem kąt skręcania płaszczyzny światła w momencie zakończenia reakcji inwersji
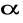
z empirycznej zależności
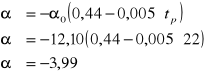
Następnie obliczyłem wartość
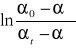
oraz stałą szybkości kobl dla poszczególnych pomiarów i wyniki zamieściłem w tabeli na początku sprawozdania
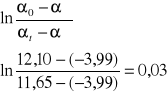
i
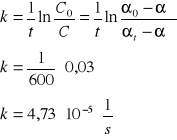
Potem sporządziłem wykresy dla obydwu pomiarów. Wykres dołączyłem na końcu sprawozdania
Wyznaczyłem metodą graficzną i metodą najmniejszych kwadratów stałą szybkości. Wyniki zamieściłem w tabeli na początku sprawozdania.
Wnioski
Działanie katalityczne kwasu zależy od łatwości odszczepiania protonu tzn. od stałej równowagi dysocjacji , a nie od rodzaju kwasu
Lepszym katalizatorem jest kwas solny, ponieważ ma wyższą stałą dysocjacji niż kwas siarkowy. Potwierdzają to także stałe szybkości jakie otrzymałem.
Kinetykę procesu inwersji sacharozy bada się wykorzystując pomiar kąta skręcania płaszczyzny światła spolaryzowanego. Sacharoza jest prawoskrętna, natomiast cukier zinwertowany lewoskrętny.
Wyszukiwarka
Podobne podstrony:
2961
2961
2961
2961
2961
2961
2961
2961
więcej podobnych podstron