Zagadnienia egzaminacyjne z Chemii
CHEMIA NIEORGANICZNA
Co nazywamy iloczynem jonowym wody?
Co to jest układ okresowy pierwiastków i jak jest zbudowany?
O czym decyduje wartość potencjału jonizacyjnego i powinowactwa elektronowego?
Jaka jest różnica między wiązaniem jonowym a kowalencyjnym?
Jaka jest różnica między wiązaniem jonowym a kowalencyjno-spolaryzowanym?
Przedstaw istotę wiązania metalicznego.
W jakich warunkach występują wiązania Van der Waalsa?
Wiązanie wodorowe - w jakich warunkach występuje?
Ogniwo galwaniczne. Opisz na dowolnym przykładzie.
Od czego zależy położenie metalu w szeregu napięciowym? Wyjaśnij na dowolnym przykładzie.
Warunki powstawania korozji chemicznej i elektrochemicznej.
Jakie znasz sposoby ochrony metali przed korozją elektrochemiczną?
Co to jest ogniwo galwaniczne? Opisz jego działanie.
Na czym polega proces elektrolizy soli?
Jaka jest różnica pomiędzy ogniwem galwanicznym a elektrolizerem?
Co to są izotopy? Wyjaśnij na dowolnie wybranym przykładzie.
Co to jest okres półtrwania?
Jak powstają cząstki α podczas rozpadu promieniotwórczego?
Jak powstają cząstki β i γ podczas rozpadu promieniotwórczego?
Uzupełnij równania reakcji:
a) oraz podaj nazwy powstających związków chemicznych
..... Cu + ..... HNO3 (stęż.) --> ......... + ..............
.... Al(OH)3 + ... NaOH --> .......... + ................
..... Zn + .... H2SO4 --> ......... + .................
..... Pb + ...... HNO3 (stęż.) --> ......... + ..............
.... Pb(OH)2 + ... NaOH --> .......... + ................
..... Pb + .... H2SO4 --> ......... + .................
b) z zastosowaniem bilansu elektronowego, zaznacz reduktor i utleniacz:
....... Cu + ....... HNO3 --> ...... Cu(NO3)2 + ...... NO + ..... H2O
....... HClO3 + ...... H2SO3 --> ....... H2SO4 + ....... HCl
...... NH3 + ........ O2 --> ........ NO + ......... H2O
...... KMnO4 + ...... HCl --> ..... KCl + ..... MnCl2 + ..... H2O + ..... Cl2
Podaj nazwy następujących związków: [Ag(NH3)2]Cl, [Zn(NH3)4]Br2, [Cr(H20)6](OH)3, K[AgCl2], Fe[Zn(CN)4], Na3[Al(OH)6], Na[Ag(CN)2], K2[Zn(OH)4], K3[Fe(CN)6]
Zadania typu:
Jakie jest stężenie procentowe roztworu użytego:
doprzemywania oczu, który można otrzymać przez rozpuszczenie 4,5g kwasu borowego w 145,5 g wody destylowanej?
do dezynfekcji, jeżeli można go otrzymać przez rozpuszczenie 26,5g jodu w 625 cm3 alkoholu etylowego o gęstości 0,8 g/ cm3 ?
Jakie jest stężenie procentowe roztworów otrzymanych po dodaniu:
a) 15 g azotan (V) potasu
b) 25 g wody
do 120 g roztworu tej soli o stężeniu 30% ?
Oblicz stężenie procentowe roztworu otrzymanego przez zmieszanie 150g roztworu soli kuchennej o stężeniu 18% ze 120g roztworu tej soli o stężeniu 22%.
Ile gramów wody trzeba zmieszać z 80 cm3 stężonego kwasu siarkowego (VI) o stężeniu 70% i gęstości 1,6 g/cm3, aby otrzymać kwas o stężeniu 37% - potrzebny do akumulatora?
Oblicz stężenie molowe roztworu siarczanu (VI) sodu zawierającego 426 g tej soli w 2500 cm3 roztworu. Jakie będzie stężenie molowe tego roztworu, jeżeli dodamy 1,5 dm3 wody?
Do 400 cm3 roztworu kwasu azotowego(V) o stężeniu 1,2 mol/dm3 dodano 110 cm3 roztworu tego kwasu o stężeniu 2 mol/dm3 i całość uzupełniono wodą do 1 dm3. Oblicz stężenie molowe otrzymanego roztworu.
W 150g wody rozpuszczono 15 g substancji o masie cząsteczkowej 56u. Otrzymano roztwór nasycony o gęstości 1,4 g/cm3. Oblicz stężenie procentowe i molowe otrzymanego roztworu.
Oblicz stężenie procentowe i molowe roztworu otrzymanego przez zmieszanie 150 cm3 roztworu kwasu siarkowego(VI) o stężeniu 75% i gęstości 1,671 g/cm3 ze 150 cm3 wody.
Jaka objętość gazowego chlorowodoru potrzebna jest do sporządzenia 150 cm3 kwasu solnego o stężeniu 0,2 mol/dm3 ?
Oblicz stężenie molowe roztworu wodorotlenku sodu otrzymanego przez zmieszanie 40g roztworu o stężeniu 10% i gęstości 1,098 g/cm3 ze 120 cm3 roztworu tego wodorotlenku o stężeniu 0,2 mol/dm3.
Zmieszano 100 cm3 roztworu mocnego kwasu o pH = 2 i 100 cm3 roztworu tego samego kwasu o pH = 3. Obliczyć pH i pOH otrzymanego roztworu.
Do 100 cm3 roztworu o stężeniu 0,1 mol/dm3 kwasu solnego dodano 150 cm3 roztworu zasady sodowej o stężeniu 0,15 mol/dm3. Jakie jest pH tego roztworu.
Oblicz pH i pOH roztworu H2SO4 o stężeniu 0,01 mol/dm3 (stopień dysocjacji α=100%).
Oblicz pH i pOH roztworu Al(OH)3 o stężeniu 0,01 mol/dm3 (stopień dysocjacji ၡ=90%).
Iloczyn rozpuszczalności siarczku baru (II) Ir = 4,2·10-28 mol/dm3. Oblicz rozpuszczalność tej soli w mol/dm3 oraz w g/dm3.
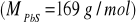
Rozpuszczalność PbSO4 w wodzie wynosi 7,95·10-3 g/250 cm3. Oblicz iloczyn rozpuszczalności siarczanu (VI) ołowiu (II).
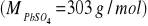
.Ile gramów AgBr można rozpuścić w 15 dm3 wody, jeżeli Ir = 7,1·10-9?
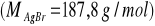
Oblicz rozpuszczalność chlorku srebra w g/dm3, wiedząc, że iloczyn rozpuszczalności AgCl wynosi Ir = 1,1·10-10.
Wyszukiwarka
Podobne podstrony:
Przykładowe+pytania+egzaminacyjne Rolnictwo2013, SGGW Rolnictwo Materiały, Botanika Materiały do egz
pytania egzamin, Rolnictwo, Rachunkowość
chemia egzamin dobre pytania, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Chema
Pytania egzaminacyjne z Agrometeorologii, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Agromet
Chemia pytania egzaminacyjne
Chemia organiczna i fizyka pytania egzaminacyjne
chemia leków pytania egzamin
Egzamin SZUR 2007 pytania, Notatki Rolnictwo, 4 rok, IV rok
pytania egzamin biochemia, STUDIA, WSR - Fizjoterpia, Rok I, Semestr 1, Semestr I, Biochemia, Wykład
BIOCHEMIA - PYTANIA EGZAMINACYJNE, niezbędnik rolnika 2 lepszy, biochemia, biochemia22
Pytania-egzamin, Inżynieria Środowiska [PW], sem 1, chemia
chemia, ywno ci pytania na egzamin www.przeklej.pl, Chemia Żywności – pytania na egzamin
Przykładowe pytania egzamin chemia
opracowane pytania egzaminacyjne chemia
Chemia Fizyczna exam pytania, egzamin
Chemia budowlana - Pytania na egzamin, Budownictwo S1, Semestr I, Chemia budowlana, Egzamin, Materia
pytania z egzaminu z biochemii, Biologia, biochemia
więcej podobnych podstron