Warszawa,dn.
Ćw. 7.1 Miareczkowanie konduktometryczne( mocnego kwasu mocną zasadą oraz słabego kwasu mocną zasadą)
Cel ćwiczenia: Zapoznanie się z zagadnieniami takimi jak: ruchliwość jonów, przewodnictwo( elektryczne, właściwe, molowe, równoważnikowe, jonowe), oddziaływanie danego typu i ilości jonów na przewodnictwo. Wykonanie miareczkowania konduktometrycznego dało możliwość zapoznania się z technikami pomiaru przewodnictwa roztworu elektrolitów oraz zmianami w przewodnictwie jakie zachodzą podczas wzrastającej objętości roztworu miareczkującego.
Wstęp:
Przewodnictwo w roztworach wodny zależy od stężenia elektrolitów. Ponieważ przewodnictwo dwóch elektrolitów można porównywać tylko wtedy gdy ich stężenia są sobie równe. W celu ułatwienia porównywania przewodnictw używa się przewodnictwo molowe i równoważnikowe.
Przewodnictwo molowe definiujemy jako stosunek przewodnictwa właściwego roztworu do jego stężenia molowego. Natomiast przewodnictwo równoważnikowe definiujemy jako stosunek przewodnictwa wł. do stężenia równoważnikowego roztworu. Przewodnictwo równoważnikowe dla mocnych elektrolitów zmienia się nieznacznie ze stężeniem roztworu, a w elektrolitach słabych te zmiany są bardzo duże. Oba pojęcia wprowadził Kohlrausch, a także prawo niezależnej wędrówki jonów. ![]()
, istotą prawa jest to, że graniczne przewodnictwo równoważnikowe jest równe sumie przewodnictw jonowych kationu i anionu występujących w roztworze![]()
.
Miareczkowanie konduktometryczne , jest typem miareczkowania polegającym na oznaczaniu końcowego punktu miareczkowania , na podstawie obserwacji zmian przewodnictwa elektrycznego miareczkowanego roztworu. Punkt odpowiadający najniższemu przewodnictwu jest punktem krytycznym lub punktem końcowym miareczkowania.
Podczas dodawania kolejnych porcji mianowanego roztworu miareczkującego widoczne są zmiany przewodnictwa wynikające z pojawiania się nowych jonów o innym przewodnictwie jonowym niż jony znajdujące się w roztworze na samym początku doświadczenia( bardzo ruchliwe jony, o wysokim przewodnictwie zastępowane są mniej ruchliwymi). Miareczkowanie konduktometryczne przeprowadza się gdy stężenie jonu usuwanego w wyniku reakcji jest wysokie w stosunku do pozostałych składników miareczkowanego roztworu. Miareczkowanie tego typu przeprowadza się w celu analizy roztworów zawierających jeden lub kilka elektrolitów o ile różnią się wartościami stałych dysocjacji lub wartościami iloczynu rozpuszczalności. Przewodnictwo [λ] jest to odwrotność oporu, który wyrażany jest stosunkiem przyłożonego do przewodnika napięcia do natężenia płynącego w nim prądu. Jednostką przewodnictwa jest simens[S]. Przewodnictwo właściwe[χ] jest to odwrotność oporu właściwego, który jest wielkością charakterystyczną materiału w określonych warunkach. Jednostką przewodnictwa właściwego jest S*m-1. Przewodnictwo molowe[λm] jest stosunkiem przewodnictwa właściwego do stężenia molowego roztworu.
Miareczkowanie konduktometryczne ma zastosowanie w alkacymetrii i analizie strąceniowej . W alkacymetrii (miareczkowaniu kwasu zasadą lub na odwrót ) Badamy zmiany przewodnictwa roztworu w wyniku dodawania porcjami odczynnika .
W wyniku pomiarów dostajemy wykres zależności przewodnictwa od objętości , po znalezieniu punktu krytycznego możemy z wykresu odczytać objętość roztworu miareczkowane go i obliczyć jego masę jeśli znamy jego stężenie. W Analizie strąceniowej stosujemy podobne metody , nie chodzi tutaj o zobojętnienie roztworu tylko o wytrącenie określonego jonu co powoduje zmiany przewodnictwa roztworu w wyniku ubytku jonów w roztworze, co w konsekwencji powoduje spadek przewodnictwa roztworu elektrolitu.
Wykonanie ćwiczenia :
Przygotowujemy w kolbach miarowych na 100 cm3 roztwory HCl i kwasu octowego kolby napełniamy do kreski i dokładnie mieszamy.
pobieramy pipetą 20 cm3 roztworu (HCl) i wlewamy do zlewki.
zlewkę z roztworem umieszczamy na mieszadełku magnetycznym ,a do zlewki wstawiamy naczynko konduktometryczne.
dolewamy wody destylowanej aby poziom roztworu był na wysokości elektrod w naczynku konduktometrycznym.
Włączamy konduktometr i odczytujemy początkową wartość przewodnictwa.
Następnie dodajemy po centymetrze roztworu NaOH o cm=0,1003 M i po każdym centymetrze odczytujemy wartość przewodnictwa.
Czynności powtarzamy do wykonania 15 pomiarów.
Po zakończeniu miareczkowania odczytujemy punkt krytyczny.
Ponawiamy miareczkowanie zwiększając dokładność pomiarów w okolicach punktu krytycznego wyznaczonego w poprzedniej próbie(+/- 2cm3) miareczkowano dodając po 0,5cm3 zasady, w celu dokładniejszego uchwycenia punktu końcowego
Po wykonaniu pomiarów sporządzamy wykres przewodnictwa od objętości dodanego NaOH
Wszystkie wyżej wymienione czynności powtarzamy dla roztworu kwasu octowego.
1.Miareczkowaliśmy za pomocą mocnej zasady NaOH o Cm=0,1003 M, mocny kwas HCl i mierzyliśmy przewodnictwo elektrolitu.
V dod NaOH [cm3] |
Przewodnictwo[mS] |
0 |
0,480 |
1 |
0,448 |
2 |
0,394 |
3 |
0,349 |
4 |
0,299 |
5 |
0,250 |
6 |
0,195 |
6,5 |
0,173 |
7,0 |
0,151 |
7,5 |
0,128 |
8 |
0,136 |
8,5 |
0,147 |
9 |
0,160 |
9,5 |
0,175 |
10 |
0,190 |
11 |
0,203 |
12 |
0,217 |
13 |
0,275 |
14 |
0,304 |
15 |
0,334 |
Na podstawie wyników pomiaru i wykresu wyznaczam punkt końcowy miareczkowania ( w którym nastąpiło całkowite zobojętnienie kwasu.
Z wykresu odczytujemy że potrzebna objętość NaOH wynosi 7,5 cm3 na podstawie tych danych wyliczamy stężenie kwasu i jego masę w kolbie miarowej na 100 cm3.
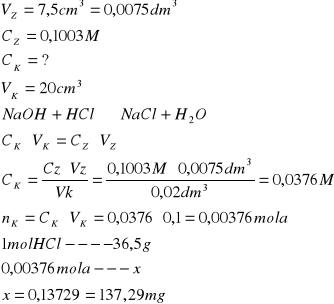
Miareczkowaliśmy za pomocą mocnej zasady NaOH o Cm=0,1003 M, słaby kwas CH3COOH i mierzyliśmy przewodnictwo elektrolitu.
Na podstawie wyników pomiaru i wykresu wyznaczam punkt końcowy miareczkowania ( w którym nastąpiło całkowite zobojętnienie kwasu.
Na podstawie wyników pomiarów i obliczeń , stwierdzamy że masa kwasu solnego wynosiła 137,29 mg, masa kwasu octowego 210,63 mg w kolbach miarowych.
Miareczkowanie konduktometryczne polega na wyznaczaniu punktu końcowego miareczkowania na podstawie przewodnictwa roztworu;
W pierwszej kolejności miareczkowaliśmy mocny kwas solny za pomocą mocnej zasady NaOH zgodnie z przykładem przytoczonym w podręczniku „Eksperymentalna chemia Fizyczna” przewodnictwo na początku przy dodawaniu zasady malało do najmniejszej wartości odpowiadające punktowi zobojętnienie kwasu (7,5 cm3),a następnie rosło do końca wykonywania pomiaru, świadczy to o zobojętnieniu kwasu i szybkiemu wzrostowi jonów OH- w badanym roztworze.
W drugiej części doświadczenia miareczkowaliśmy słaby kwas octowy za pomocą tej samej zasady sodowej. Wartości przewodnictwa zgodnie z przewidywaniami na początku wolno rosły do punktu końcowego który z wykresu 2. odpowiada (7,00cm3), a po zobojętnieniu przewodnictwo zaczęło szybko wzrastać , podobnie jak w przypadku 1 wskazując szybki wzrost stężenia jonów OH- w badanym roztworze.
Szybki wzrost przewodnictwa wynika z dużej ruchliwości jonów OH- i ich zdolności do przenoszenia ładunku.
V dod. NaOH [cm ] |
Przewodnictwo [mS] |
0 |
0,0238 |
1 |
0,0207 |
2 |
0,0280 |
3 |
0,0381 |
4 |
0,0492 |
5 |
0,0605 |
5,5 |
0,0668 |
6 |
0,0716 |
6,5 |
0,0804 |
7 |
0,0938 |
7,5 |
0,108 |
8 |
0,123 |
8,5 |
0,138 |
9 |
0,152 |
9,5 |
0,168 |
10 |
0,181 |
11 |
0,208 |
12 |
0,237 |
13 |
0,264 |
14 |
0,294 |
15 |
0,320 |
Z wykresu odczytujemy że potrzebna objętość NaOH wynosi 7,5 cm3 na podstawie tych danych wyliczamy stężenie kwasu i jego masę w kolbie miarowej na 100 cm3.
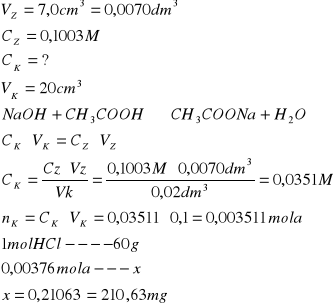
3.Wnioski:
Wyszukiwarka
Podobne podstrony:
7478
7478
7478
7478
7478
7478
7478
praca magisterska 7478
więcej podobnych podstron