Sobiesław Torliński 23.03.2002
Ćwiczenie 3
ENTROPIA MIESZANIA ROZTWORÓW NA PODSTAWIE
POMIARÓW SEM OGNIW STĘŻENIOWYCH
Wyniki pomiarów:
masa naważki k4[Fe(CN)6] - m1= 8,4480g,
stężenie roztworu k4[Fe(CN)6] - c1=0,100 [mol/dm3],
masa naważki k3[Fe(CN)6] - m2=6,5846g,
stężenie roztworu k3[Fe(CN)6] - c2=0,100 [mol/dm3],
Nr roztworu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
SEM [V] |
0,2360 |
0,1488 |
0,1197 |
0,0711 |
0,0436 |
0,0223 |
0,0003 |
|
0,2362 |
0,1489 |
0,1198 |
0,0712 |
0,0437 |
0,0224 |
0,0004 |
|
0,2364 |
0,1490 |
0,1199 |
0,0712 |
0,0438 |
0,0225 |
0,0005 |
SEMśr. |
0,2362 |
0,1489 |
0,1198 |
0,0712 |
0,0437 |
0,0224 |
0,0004 |
Przykład obliczeń dla roztworu 1:
V1 = 20 [cm3] = 0,02 [dm3], V2 = 0,2 cm3 = 0,0002 dm3,
c1 = 0,1 [mol/dm3], c2 = 0,1 [mol/dm3],
n1 = V1c1 = 0,002 mol, n2 = V2c2 = 0,00002 mol.
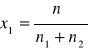
x2 = 1 - x1
x1 = 0,002 / (0,002 + 0,00002) x2 = 0,0099
x1 = 0,9901
Nr roztworu |
n1 |
n2 |
x1 |
x2 |
1 |
0,0020 |
0,00002 |
0,9901 |
0,0099 |
2 |
0,0020 |
0,0001 |
0,9524 |
0,0476 |
3 |
0,0020 |
0,0002 |
0,9091 |
0,0909 |
4 |
0,0016 |
0,0004 |
0,8000 |
0,2000 |
5 |
0,0014 |
0,0006 |
0,7000 |
0,3000 |
6 |
0,0012 |
0,0008 |
0,6000 |
0,4000 |
7 |
0,0010 |
0,0010 |
0,5000 |
0,5000 |
Całkowanie funkcji SEM = f(n*):
Punkty zostały aproksymowane wielomianem czwartego stopnia.
SEM = 17,666 n*4 - 21,737 n*3 + 9,4561n*2 - 1,9156 n*2 + 0,2253 n*
Całkowanie przeprowadzono w granicach od n* = 0 do n* = 0,5.
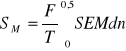
F = 96485 [C/mol]
T = 298,6 [K]
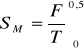
(17,666 n*4 - 21,737 n*3 + 9,4561 n*2 - 1,9156 n* + 0,2253)dn
![]()
[ (17,666n*5 / 5) - (21,737 n*4 / 4) +( 9,4561 n*3 / 3) - (1,9156 n*2 / 2) + 0,2253 n*)]
SM = (96485 / 298,6) (0,1104 - 0,33960 + 0,3940 - 0,2395 + 0,1127)
SM = (96485 / 298,6) ∗ 0,03798 = 12,27 [ J / K mol]
Całkowanie wykresu metodą trapezów:
Całkowanie od n*i do n*i + 1,
![]()
W obliczeniach korzystam ze wzoru:
![]()
Przykład obliczenia dla przedziału - 0,5 - 0,4:
P1 = 0,5 (0,0004 + 0,0224) 0,1 = 0,00114
Przedział |
0,5 - 0,4 |
0,4 - 0,3 |
0,3 - 0,2 |
0,2 - 0,1 |
0,1 - 0,05 |
0,05 - 0,01 |
Pole |
0,00114 |
0,00445 |
0,0102 |
0,01975 |
0,02647 |
0,03417 |
Przez graficzną ekstrapolację wartości (SM/F)T do n* = 0 na wykresie zależności (SM/F)T = f(n*) wyznaczona została wartość entropii mieszania SM
SM = (0,03417 ∗ 96485) / 298,6 = 8,271 [ J / mol K]
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna 20-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 8
Chemia fizyczna 18-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 10
Chemia fizyczna 15 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 15
Chemia fizyczna 27-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 23
Chemia fizyczna 04 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 4
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
Chemia fizyczna 05 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 5
Chemia fizyczna 03, chemia fizyczna, chemia, FIZYCZNA, 3, Ćwiczenie 03
Chemia fizyczna 19 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 19
wyniki zaliczenia w I term. gr 3.x, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stac
Wyniki pomiar+-w dla ¦çwiczenia 19, chemia fizyczna, chemia, Chemia fizyczna
Wyniki 8, chemia fizyczna, chemia, Chemia fizyczna
Chemia fizyczna 02 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 2
Chemia fizyczna 01 - wyniki, chemia fizyczna, chemia, FIZYCZNA, 1
Chemia fizyczna 16-wyniki, chemia fizyczna, chemia, FIZYCZNA, 16
moment dipolowy poprawa 03.12.11 bw, fizyczna, chemia fizyczna, Fizyczna, laborki
Chemia fizyczna 07 - wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 16
Chemia fizyczna 20-wyniki, chemia fizyczna, chemia, FIZYCZNA - raporty, Ćwiczenie 8
więcej podobnych podstron