Sobiesław Torliński 16.03.2002
Ćwiczenie 3
ENTROPIA MIESZANIA ROZTWORÓW NA PODSTAWIE
POMIARÓW SEM OGNIW STĘŻENIOWYCH
1. Wstęp teoretyczny:
Specjalny rodzaj ogniw stanowią tzw. ogniwa stężeniowe. Są to ogniwa zestawione z dwóch jednakowych półogniw różniących się jedynie stężeniami reagentów. Przykładem ogniwa stężeniowego jest ogniwo:
Cu|Cu2+(a+,1)||Cu2+(a+,2)|Cu
SEM tego ogniwa przedstawia wzór:
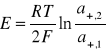
W którym a+,1 i a+,2 oznaczają aktywności jonów Cu2+ w obu półogniwach. SEM jest dodatnia, gdy a+,2 > a+,1. W czasie pracy ogniwa zachodzi wówczas w prawym półogniwie reakcja:
Cu2+(a+,2) + 2e = Cu
a w lewym:
Cu = Cu2+(a+,1) + 2e
W wyniku tych reakcji stężenia w obu półogniwach wyrównują się, a SEM maleje w końcu do zera.
Rola klucza elektrolitycznego jest tu dwojaka. Po pierwsze, stanowi on kontakt elektryczny między obiema częściami ogniwa, po drugie, w znacznym stopniu eliminuje niepożądany w pomiarze SEM efekt „potencjału dyfuzyjnego”.
Ogniwo elektrochemiczne tego typu nawet w warunkach kompensacji nie znajduje się, ściśle biorąc, w stanie termodynamicznej równowagi. Przyczyną tego jest samorzutny proces dyfuzji, jaki zachodzi na granicy zetknięcia się dwóch roztworów różniących się składem lub stężeniem. Efekt ten przedstawię teraz na szczególnie prostym przykładzie ogniwa stężeniowego, którego oba półogniwa różnią się jedynie stężeniem rozpuszczonego, jednowartościowego elektrolitu:
Pt, H2|H3O+ (a+,1), Cl - (a -,1) ¦ H3O+ (a+,2), Cl - (a -,2)| H2, Pt
Oba roztwory stykają się w tym ogniwie bezpośrednio, np. w ten sposób, że na roztwór o większym stężeniu został nawarstwiony roztwór bardziej rozcieńczony. Taką granicę dwóch roztworów zaznaczyłem na schemacie ogniwa pionową linią przerywaną. Związaną z nieodwracalnym procesem elektrochemicznym SEM ogniwa stężeniowego przybiera postać:
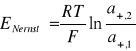
gdzie: a+,1 i a+,2 oznaczają aktywności kationów w obu półogniwach.
Obliczenie wartości potencjału dyfuzyjnego w przypadku ogólnym wymaga zastosowania termodynamiki procesów nieodwracalnych i jest sprawą złożoną, toteż usiłuje się wyeliminować go w pomiarze SEM. Jedną z możliwości stwarza właśnie użycie klucza elektrolitycznego wypełnionego stężonym roztworem elektrolitu, którego jony wskazują zbliżone ruchliwości (t+ ≈ t - ≈ 0,5). Ze względu jednak na przybliżony charakter wzoru Hendersona oraz niedokładne spełnienie warunku t+ = t - = 0,5, klucz elektrolityczny nie eliminuje całkowicie potencjału dyfuzyjnego, pozostawiając resztkowy potencjał rzędu 1 mV. Z taką zatem dokładnością spełnione są w zwykłych warunkach wzory na SEM ogniwa.
2. Literatura:
„Chemia fizyczna” - Sobczyk, Kisza, PWN W - wa, 1977
„Chemia fizyczna” - Pigoń, Ruziewicz, PWN W - wa, 1980
3.Wykaz substancji chemicznych stosowanych w zadaniu:
żelazocyjanek potasu
żelazicyjanek potasu
Oświadczenie:
Oświadczam, że zapoznałem się z kartami charakterystyk wyżej wymienionych substancji i znane mi są właściwości tych substancji, sposoby bezpiecznego postępowania z nimi oraz zasady udzielania pierwszej pomocy w nagłych wypadkach.
Wyszukiwarka
Podobne podstrony:
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
Kolokwium zaliczeniowe 1, Technologia chemiczna, Chemia fizyczna, Ćwiczenia
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Chemia fizyczna 05, chemia fizyczna, chemia, FIZYCZNA, 5, Ćwiczenie 05
Chemia fizyczna 04, chemia fizyczna, chemia, FIZYCZNA, 4, Ćwiczenie 04
chemia fizyczna-ćwiczenie 13, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
oddziaływania, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 5 I 6 CHEMIA FIZYCZNA, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
fala świetlna-cechy, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 13 I 14, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
Chemia fizyczna 07, chemia fizyczna, chemia, FIZYCZNA, 7, Ćwiczenie 07
napięcie powierzchniowe, Studia, Chemia, fizyczna, ćwiczenia
Przykl Zad Koll 3-cie sem3 HD CD 2010, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium
więcej podobnych podstron