Sobiesław Torliński 20.04.2002
Ćwiczenie 5
POMIAR SIŁY ELEKTROMOTORYCZNEJ OGNIW GALWANICZNYCH I STĘŻENIOWYCH
1. Wstęp teoretyczny:
Ogniwo galwaniczne jest układem, który może wykonać pracę elektryczną kosztem redoksowych przemian chemicznych. Przykładem takiego ogniwa może być ogniwo Daniella. Ogniwo to składa się z blaszki lub pręta cynkowego zanurzonego w roztworze ![]()
i blaszki (pręta wykonanego z miedzi-w roztworze ![]()
. Obydwa roztwory kontaktują się ze sobą przez przegrodę porowatą umożliwiającą przepływ jonów a zapobiegającą mieszaniu się roztworów. Po połączeniu cynku z miedzią przewodnikiem elektronowym popłynie prąd elektryczny. Przepływ prądu elektrycznego jest wynikiem reakcji chemicznej zachodzącej w obydwu częściach ogniwa tzw. półogniwach na granicy pomiędzy metalem a roztworem, różnica potencjałów . na anodzie zachodzi utlenianie ![]()
uwolnione elektrony przekazywane są na katodę gdzie zachodzi reakcja redukcji ![]()
. Bieg powyższych reakcji powoduje, że anoda zyskuje elektrony ma więc potencjał ujemny, natomiast katoda potencjał dodatni. Sumarycznie w ogniwie zachodzi reakcja utleniania i redukcji.
![]()
Budowę elektrody zapisujemy :
(-)|![]()
![]()
Cu|⊕
Ogniwa galwaniczne to ogniwa, które mogą wykonywać pracę prace elektryczną kosztem redoksowych przemian przykładem takiego ogniwa jest ogniwo daniel przedstawione wyżej. Ogniwa stężeniowe powstają w wyniku dwóch jednakowych elektrod, różniących się jedynie aktywnością jonów w reakcjach elektrodowych. Przykładem takiego ogniwa jest ogniwo amalgamatowe (-)Hg|Cd(a1)|Cu![]()
|Cd(a2)|Hg⊕ w których aktywność Cd a1>a2. Przykładem ogniwa z różnica roztworów elektrodowych jest ogniwo składające się z dwóch elektrod srebrowych zanurzonych w roztworach o a1 ia2 gdziea1<a2 połączonych kluczem elektrolitycznym. (-)Ag|![]()
(a1)|| ![]()
|Ag⊕ SEM równa się:
![]()
![]()
Ogniwo bez przenoszenia - jeżeli w ogniwie nie ma granicy pomiędzy roztworami poszczególnych elektrod przykładem może być ogniwo
(-)Pt,![]()
(![]()
)|![]()
![]()
|![]()
(![]()
); gdzie elektrody mają wspólny roztwór HCl>
Wzór Nernsta:
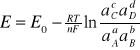
reprezentuje siłę elektromotoryczną danego ogniwa. SEM można również obliczyć z potencjałów obydwu elektrod.
Siła elektromotoryczna jest równa różnicy pomiędzy pootencjałem przewodnika przyłączonego do elektrody prawej a potencjałem przewodnika wykonanego z tego samego metalu dołączonego do elektrody lewej tzn. ![]()
W ten sposób wyliczona SEM jest prawdziwa jedynie wtedy gdy pomiędzy elektrodami roztworami nie występuje dodatkowy spadek potencjału nazywany potencjałem dyfuzyjnym. Potencjał dyfuzyjny można wyeliminować poprzez wprowadzenie do ogniwa klucza elektrolitycznego. Potencjał dyfuzyjny nie ma miejsca w ogniwach bez przenoszenia.
Wzór Nernsta opisuje również reakcje elektrodowe
![]()
![]()
![]()
M=1więc
![]()
![]()
- potencjał standardowy jest on równy potencjałowi danej elektrody w przypadku aktywności ![]()
<1.
Potencjału elektrody nie można wyznaczyć, można wyznaczyć wartość bezwzględną jest on równy sile elektromotorycznej ogniwa złożonego z danej elektrody oraz standardowej elektrody wodorowej zestawionej w ten sposób by elektroda wodorowa znajdowała się po lewej stronie ogniwa i w którym nie występuje potencjał dyfuzyjny ![]()
jest standardową SEM ogniwa w którym aktywności reagentów są równe jedności.
Rodzaje elektrod
a) elektrody I rodzaju - odwracalne względem jonów materiału ele.
+względem kationu (metaliczne, wodorowe)
+względem anionu (chlorowa, bromowa, jodowa)
c) elektrody II rodzaju - przykładem jest elektroda chlorosrebrowa
b) redoksowe - utleniająco-redukujące zbudowane z nośnika elektronów (Pt, Au) zanurzonego w roztworze zawierający jakikolwiek układ redoksowy. Przykladem jest elektroda żelazowo-żelazowa.
d) jonoselektywne
zastosowanie membran jonoselektywnych wykazujących wysoką selektywność względem przenikania określonego rodzaju jonów.
Literatura:
„Chemia fizyczna” - L. Sobczyk, A. Kisza, PWN W - wa, 1977
„Chemia fizyczna” - K. Pigoń, Z. Ruziewicz, PWN W - wa, 1980
Wykaz substancji chemicznych stosowanych w zadaniu:
roztwór chlorku potasu
roztwór bromku potasu
roztwór jodku potasu
roztwór siarczanu cynku
roztwór siarczanu miedzi
roztwór azotanu srebra
Wyszukiwarka
Podobne podstrony:
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
Kolokwium zaliczeniowe 1, Technologia chemiczna, Chemia fizyczna, Ćwiczenia
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Chemia fizyczna 03, chemia fizyczna, chemia, FIZYCZNA, 3, Ćwiczenie 03
Chemia fizyczna 04, chemia fizyczna, chemia, FIZYCZNA, 4, Ćwiczenie 04
chemia fizyczna-ćwiczenie 13, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
oddziaływania, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 5 I 6 CHEMIA FIZYCZNA, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
fala świetlna-cechy, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 13 I 14, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
Chemia fizyczna 07, chemia fizyczna, chemia, FIZYCZNA, 7, Ćwiczenie 07
napięcie powierzchniowe, Studia, Chemia, fizyczna, ćwiczenia
Przykl Zad Koll 3-cie sem3 HD CD 2010, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium
więcej podobnych podstron