GRUPA |
TEMAT |
OCENA |
DATA |
|
Spektrofotometria absorpcyjna |
|
06.12.2002 |
1.Wstęp teoretyczny.
Spektrofotometria w świetle widzialnym i nadfiolecie polega na pomiarze absorpcji promieniowania elektromagnetycznego. Zjawisko absorpcji wiąże się z przejściami między poziomami elektronów powłok zewnętrznych oraz zmianą energii cząsteczki lub atomu. Zmiana energii jest wprost proporcjonalna do częstotliwości drgań promieniowania elektromagnetycznego. Zależność tą wyraża wzór :
E =h·ν , gdzie:
-h -stała Plancka,
-ν -częstotliwość drgań.
Wiązka światła monochromatycznego przechodząc przez warstwę roztworu zostaje osłabiona, ponieważ ulega częściowo odbiciu i rozproszeniu a częściowo pochłonięciu. W wyniku tego tylko część przechodzi przez roztwór. Można to przedstawić za pomocą równania:
I 0=Ir+Ip+It, gdzie:
-Ir -natężenie promieniowania rozproszonego i odbitego,
-Ip -natężenie promieniowania pochłoniętego,
-It -natężenie promieniowania przechodzącego przez roztwór.
W przypadku roztworów nie zawierających zawiesin wartość Ir jest niewielka, dlatego można ją zaniedbać. Wówczas wzór przyjmuje następującą postać:
I0=Ip+It
Wartość Ip możemy obliczyć znając I0 oraz It.. Wartość It zależy od natężenia źródła światła-I0 oraz grubości warstwy roztworu. Zależność tę wyraża wzór Lamberta (1):
It=I0 10-kb, gdzie:
-b - grubość warstwy roztworu,
-k - współczynnik proporcjonalności.
Podobną zależność- między natężeniem światła przechodzącego It, a stężeniem substancji barwnej `c' w roztworze opisuje prawo Beera (2) :
It=I0 10-kc, gdzie:
-k - współczynnik proporcjonalności.
Po zestawieniu równań (1) i (2) otrzymujemy równanie Lamberta-Beera :
It=I0 10-abc, gdzie:
-a - współczynnik absorpcji.
Prawo to jest podstawowym prawem spektrofotometrii absorpcyjnej. Wyrażenie It/I0 nazywamy przepuszczalnością lub transmitacją T :
T=It/I0 .
Logarytm odwrotności tego wyrażenia nazywamy ekstynkcją lub absorbancją :
A= log I0/It = abc.
2.Wykonanie ćwiczenia:
1.Przygotowujemy roztwór roboczy zawierający 0.01 mg Mg/ ml.
Odpipetowujemy 2 ml roztworu wzorcowego do kolbki miarowej o pojemności 200 ml i uzupełniamy wodą destylowaną do kreski.
2.Do kolbek miarowych o pojemności 50 ml odmierzamy biuretą: 0, 2, 5, 10, 15, 20 ml roztworu roboczego.
3.Do kolejnej kolbki o takiej samej pojemności odmierzamy 10 ml wody wodociągowej, w której będziemy badać stężenie magnezu. Do wszystkich kolb dodajemy po 2 ml roztworu chlorku wapniowego 2%, 5 ml żółci tytanowej, 5 ml roztworu żelatyny. Następnie mieszamy. 4.Dopełniamy wszystkie kolby wodą destylowaną do objętości około 35 ml.
5.Mieszając dodajemy kroplami z pipety roztwór NaOH- do zmiany zabarwienia, po czym dodajemy jeszcze po 5 ml roztworu NaOH.
6.Zawartość kolbek mieszamy i uzupełniamy wodą destylowaną (do kreski).
7.Po upływie 15 minut mierzymy absorpcję poszczególnych roztworów przy długości fali równej 545 nm, względem odnośnika o stężeniu Mg równym zero.
WYNIKI POMIARÓW:
Lp. |
Objętość roztworu roboczego [ml] |
Zawartość Mg w kolbce 50 ml [mg/50 ml] |
Odczytana wartość absorbancji |
Średnia wartość absorbancji |
||
1 |
2 |
0.02 |
0.02 |
0.02 |
0.02 |
|
2 |
5 |
0.05 |
0.10 |
0.10 |
0.10 |
|
3 |
10 |
0.1 |
0.195 |
0.195 |
0.195 |
|
4 |
15 |
0.15 |
0.305 |
0.305 |
0.305 |
|
5 |
20 |
0.2 |
0.45 |
0.45 |
0.45 |
|
6 |
Próbka badana |
0.265 |
0.265 |
0.265 |
||
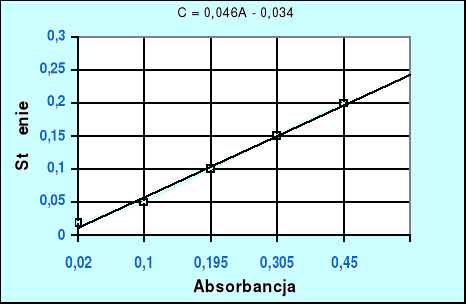
WYKRES 1.Krzywa wzorcowa do ilościowego oznaczania magnezu żółcienią tytanową.
3.Opracowanie wyników.
Parametry krzywej wzorcowej:
C = 0.046A - 0.034
A=0,265
Ilość magnezu w wodzie wodociągowej jest równa:
C = 0.046A- 0.034
C=0,125[mg/10ml]
C = 12.5[mg/ml]
Wyszukiwarka
Podobne podstrony:
MAZDA 929 1993
Gb 0,506,929 Absorbing Material For Nitroglycerine From Potatoes
928 929
929
929
929
Honda 929 fireblade '00 parts info&drawings
929
MAZDA 929 1995
MAZDA 929 1993
marche 929
foxtrot 929
MAZDA 929 1991
akumulator do mazda 929 ii hb 20i glx
akumulator do mazda 929 i la 20 20 variabel
928 929
więcej podobnych podstron