Amina Bassil 22.04.2005
WTŻ
Rok 1 wieczorowe gr. 2
Piątek, 16.00.
Sprawozdanie z ćwiczenia:
Przemiany gazowe (ćw. C 07/09)
Fizyka zjawiska:
W naszym doświadczeniu wykorzystujemy przemiany, jakim podlegają gazy. Aby opisać te przemiany wprowadzono pojęcie gazu doskonałego.
![]()
Za gaz doskonały uważać będziemy gaz spełniający łącznie prawa Boyle'a-Mariotte'a, Gay-Lussaca i Charlesa, które zostaną omówione poniżej. Jest to gaz, dla którego w stałej temperaturze iloczyn objętości i ciśnienia jest odwrotnie proporcjonalny, dla określonej objętości ma stały stosunek ciśnienia do temperatury, a pod stałym ciśnieniem - proporcjonalne są objętość i temperatura.
Przemiany, którym podlegają gazy są następujące:
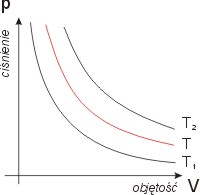
Przemiana izotermiczna to proces, w którym temperatura gazu pozostaje stała T = const więc pV = const
Zależność ta znana jest jako prawo Boyle'a - Mariotte'a
Parametrami mogącymi się zmieniać w tym procesie są objętość V i ciśnienie p. Nie mogą one się jednak zmieniać niezależnie.
Na rys. - wykres izotermy dla różnych temperatur, gdzie T1 < T < T2.
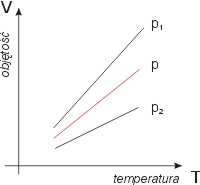
Przemiana izobaryczna, to proces, w którym ciśnienie gazu pozostaje stałe
p = const. Zależność ta znana jest jako prawo Gay - Lussaca
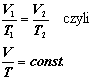
Na rys. - wykres izobary dla różnych ciśnień, gdzie p1 < p < p2.
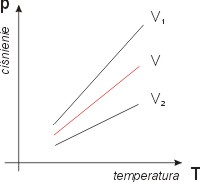
Przemiana izochoryczna, to proces, w którym objętość gazu pozostaje stała
V = const
Zależność ta znana jest jako prawo Charlesa
Na rys. - wykres izochory dla różnych objętości, gdzie V1 < V < V2.
Cel ćwiczenia:
Celem ćwiczenia C07 było sprawdzenie prawa Boyle'a, badaliśmy związek między ciśnieniem i objętością próbki powietrza przy stałej temperaturze,
Celem ćwiczenia C09 było sprawdzenie związku między ciśnieniem gazu i temperaturą, przy stałej objętości, a także wyznaczenie teoretycznej granicy niskiej temperatury.
Wykonanie doświadczenia:
Przygotowaliśmy komputer do pracy, uruchomiliśmy program Science Workshop, w którym pracowaliśmy nad obydwoma ćwiczeniami.
Ćwiczenie C07:
Podłączyliśmy strzykawkę do miernika ciśnienia a ten do interfejsu.
Ustawiliśmy wszystkie zadane parametry w programie.
Ustawiliśmy objętość strzykawki na 20ml i zapisaliśmy odczyt ciśnienia, następnie po kolei zmniejszaliśmy objętość o 2ml i rejestrowaliśmy kolejne odczyty, aż do 10ml.
Na podstawie naszych pomiarów, program wygenerował wykres.
Następnie wykonaliśmy obliczenia iloczynu ciśnienia i objętości dla każdej wartości objętości. Wartości te nie są sobie równe, ale są zbliżone.
Ćwiczenie C09:
W zamkniętym i szczelnym miedzianym zbiorniku było powietrze, u wylotów zbiornika były umieszczone czujniki ciśnienia i temperatury. Całość znajdowała się w elektrycznym garnku z wodą.
Gaz podgrzewaliśmy od temperatury pokojowej do temperatury wrzenia rejestrując kolejne pomiary ciśnienia i temperatury.
Na ich podstawie został wygenerowany wykres, na podstawie obliczeń komputerowych uzyskaliśmy następujące dane:
Wartość parametru a1=94,917 (punkt przecięcia osi ciśnienia przez linię prostą p=a1+a2t)
Wartość parametru a2=0,245 (nachylenie tej prostej)
Na podstawie tych wartości obliczyliśmy punkt t0 dla którego p=0. t0=-(a1/a2)=-387,416
Wykres nr 2. Zależność p i t przy V=const.
Wnioski:
Empirycznie sprawdzono i potwierdzono prawo Boyle'a, które mówi, że przy stałej temperaturze, iloczyn pV jest stały. Dokładnie zależność parametrów badanego przez nas gazu pokazana jest na wykresie nr 1., choć w uzyskanych przez nas wynikach iloczynu pV występują niewielkie różnice dla poszczególnych wartości, to można je wytłumaczyć brakiem wprawy w obsłudze używanego programu komputerowego, czy niedokładnością ustalania objętości powietrza w strzykawce.
W drugim ćwiczeniu wykazaliśmy, że przy stałej objętości wraz ze wzrostem temperatury rośnie także ciśnienie. Dla niektórych wartości zarejestrowanych przez komputer sporządziliśmy wykres zależności, który potwierdza prawo Charlesa. Z obliczeń wykonanych przez program wyliczyliśmy temperaturę zera bezwzględnego, odpowiadającą zerowej wartości ciśnienia gazu doskonałego, wyniosła ona -387,416 °C.
Powinna ona wynieść -273,15°C, różnica najprawdopodobniej spowodowana jest niedokładnościami przy wykonywaniu pomiarów. Był to kolejny wykonywany pomiar, wcześniejsze nie zostały zarejestrowane z powodu błędu programu, restartowania się komputera, wyłączenia prądu na stanowisku, garnek elektryczny był już mocno nagrzany i pomiar był dość krótki, z czego w trakcie, temperatura spadała, a dopiero później rosła od nowa. Przyczyną tego, że nie otrzymaliśmy wyniku -273,15°C może być także to, że używany w tym doświadczeniu model gazu doskonałego nie odzwierciedla rzeczywistego zachowania się gazów a jest tylko ich wyidealizowanym modelem.
Wyszukiwarka
Podobne podstrony:
Sprawozdania z fizyki i trochę materiałów, FIZYKA, Sprawozdania
Sprawozdanie z fizyki W3a, MATERIAŁY NA STUDIA, różne cosie
LAB51~1, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, fiz
sprawozdanie z laboratorium fizyki nr 1, sprawka fizyka
Wzór sprawozdania na labolatoria z fizyki, Politechnika, Labolatoria Fizyka
LABORATORIUM PODSTAW FIZYKI222, PWr, SEMESTR 1, FIZYKA, sprawozdania
LABORATORIUM PODSTAW FIZYKI-1, PWr, SEMESTR 1, FIZYKA, sprawozdania
BADANI~1, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, fi
SPRAWOZDANIE Z FIZYKI Cw 21 2, Fizyka Sprawozdania, Ćw nr 21
więcej podobnych podstron