X. RÓWNOWAGA CHEMICZNA. PRAWO DZIAŁANIA MAS
1. Stopień przereagowania
- jest to miara zaawansowania reakcji chemicznej
Ogólnie:
gdzie: ni* - liczność i-tego substratu, który przereagował
nip - początkowa liczność
ni - liczność aktualna (po przereagowaniu)
Dla V = const.
0 ≤ αi ≤ 1 lub w procentach 0 < αi < 100%
Dla reakcji z udziałem jednego substratu, np.:
2NH3 = N2 + 3H2
αi - jest nazywane stopieniem dysocjacji termicznej
2. Reakcje odwracalne i nieodwracalne
Przykłady:
a) H2 + I2 = 2HI
ściślej: H2(g) + I2(g) ⇔ 2HI(g)
Reakcja ta jest odwracalna
b) CaCO3(s) → CaO(s) + CO2(g)↑
c) H+ + OH- → H2O
d) Fe3+ + 3OH- → Fe(OH)3↓
Reakcje b-d są praktycznie nieodwracalne
3. Pojęcie stanu równowagi chemicznej
Weźmy reakcję w stanie gazowym:
CO2 + H2 ⇔ CO + H2O
V = const. T = const.
r→ = k1 ⋅ cCO2 ⋅ cH2 r→ maleje
r← = k2 ⋅ cCO ⋅ cH2O r← rośnie
0 tr (czas)
W stanie równowagi chemicznej reakcje (w lewo i w prawo) przebiegają nadal, ale ich szybkości są jednakowe. Osiągnięta równowaga nosi charakter równowagi dynamicznej |
r→ = r←
cCO, cH2O, cCO2, cH2 - stężenia molowe w stanie równowagi (w mol/dm3)
Kc - stała stężeniowa, tj. wyrażona przy pomocy stężeń
Wprowadźmy:
co - standardowe stężenie molowe reagenta ≡ 1 mol/dm3
[i] - względne stężenie molowe danego reagenta
Ogólnie:
Stała Kc jest wielkością bezwymiarową.
Stała ciśnieniowa, tj. wyrażona przy pomocy ciśnień cząstkowych:
po ≡ 1,01325⋅105 Pa = 1 atm (ciśnienie standardowe)
Stała równowagi Kx wyrażona jest przy pomocy ułamków molowych:
Stałe Kp i Kx są też bezwymiarowe
Jak rozumieć równowagę chemiczną?
Przykład: Reakcja syntezy jodowodoru:
H2(g) + I2(g ) ⇔ 2HI(g)
Doświadczalnie stwierdzono iż dla 4-ch różnych stanów początkowych w stanie równowagi znajduje się odpowiednio:
Nr doświadczenia 1
|
Stan początkowy 1,00 mol H2 1,00 mol I2 0,00 mol HI |
Stan równowagi 0,222 mol H2 0,222 mol I2 1,56 mol HI |
2
|
0,00 mol H2 0,100 mol I2 3,50 mol HI |
0,350 mol H2 0,450 mol I2 2,80 mol HI |
3
|
0,0150 mol H2 0,00 mol I2 1,27 mol HI |
0,150 mol H2 0,135 mol I2 1,00 mol HI |
4
|
0,00 mol H2 0,00 mol I2 4,00 mol HI |
0,442 mol H2 0,442 mol I2 3,116 mol HI |
Obliczmy stałe równowagi (Kc) dla każdego z tych 4 przypadków:
Znając, że V = 100 cm3
Nr doświad-czenia |
Stężenia równowagowe (mol /dm3) |
|
|||
|
[H2] |
[I2] |
[HI] |
|
|
1 2 3 4 |
0,222 0,350 0,150 0,442 |
0,222 0,450 0,135 0,442 |
1,56 2,80 1,00 3,116 |
(1,56)2/(0,222) (0,222) (2,80)2/(0,350) (0,450) (1,00)2/(0,150) (0,135) (3,12)2/(0,442) (0,442) |
49,4 ÷ 49,8 |
Prawo działania mas: W danej temperaturze, substraty reagują ze sobą tak długo, dopóki stosunek iloczynu stężeń produktów do iloczynu stężeń substratów reakcji nie osiągnie wartości stałej, charakterystycznej dla tej reakcji. |
4. Zależność położenia stanu równowagi od ciśnienia, stężenia reagentów i temperatury
a) Wpływ ciśnienia T = const.
Rozpatrzmy reakcję w fazie gazowej
3H2 + N2 ⇔ 2NH3 V = const
4 mole → 2 mole
Jeśli reakcja przebiega w prawo to sumaryczna liczności, maleje. A więc ciśnienie ogólne też maleje.
Odwrotnie jest gdy reakcja przebiega w lewo - ciśnienie wówczas rośnie.
Jak się zachowa układ gdy zwiększymy ciśnienie?
- układ będzie się starał tej zmianie przeciwstawić,
- równowaga przesuwa się w prawo,
- ale wartość stałej Kp się nie zmieni.
Dla reakcji syntezy amoniaku:
3H2 + N2 = 2NH3:
Jeżeli przez x oznaczymy:
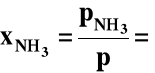
ułamek molowy amoniaku
p = ciśnienie sumaryczne
A więc dla x << 1 istnieje proporcjonalność pomiędzy ciśnieniem ogólnym (p) i ułamkiem molowym amoniaku:
0,11 Kp p2 = x2
Czyli ze wzrostem ciśnienia rośnie ułamek molowy amoniaku a tym samym wydajność reakcji syntezy NH3 zwiększa się.
Czy tak będzie też dla reakcji:
2H2O(g) ⇔ 2H2(g) + 1O2(g)
2 mole → 3 mole
Nie - tutaj będzie odwrotnie!
Czyli tutaj wraz ze wzrostem ciśnienia równowaga chemiczna przesunie się w lewo.
Dla reakcji:
CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
2 mole → 2 mole
Tutaj nie będzie wpływu ciśnienia na położenie stanu równowagi
b) Prawo przekory = Reguła LaChatelier Brauna
Przy zmianie jednego z parametrów zewnętrznych (np. ciśnienia) równowaga chemiczna przesuwa się w takim kierunku, aby przeciwdziałać tej zmianie |
c) Wpływ stężenia jednego z reagentów reakcji
Reakcja w stanie gazowym:
|
CO2 |
+ |
H2 |
⇔ |
CO |
+ |
H2O |
przed reakcją |
1,00 mola |
|
1,00 mola |
|
0,00 |
|
0,00 |
w stanie równowagi |
0,54 mola |
|
0,54 mola |
|
0,46 mola |
|
0,46 mola |
Jeżeli wzrośnie liczność wodoru z 1,00 do 9,00 moli to:
|
CO2 |
+ |
H2 |
⇔ |
CO |
+ |
H2O |
przed reakcją |
1,00 mola |
|
9,00 mola |
|
0,00 |
|
0,00 |
w stanie równowagi |
0,13 mola |
|
8,13 mola |
|
0,87 mola |
|
0,87 mola |
α = 87%
d) Wpływ temperatury
Rozważmy to na przykładzie syntezy amoniaku:
3H2 + N2 ⇔ 2NH3 ΔH298 o- = - 92 kJ/mol
Reakcja zachodząca w prawo jest egzotermiczna - w czasie syntezy NH3 wydziela się ciepło.
Odwrotna reakcja będzie endotermiczna.
Czy wzrost temperatury jest korzystny na wydajność reakcji zachodzącej w prawo? NIE !
Oto dane doświadczalne dla reakcji syntezy amoniaku:
Temp., K |
673 |
723 |
873 |
Kp |
1,8 ⋅ 10-4 |
4,7 ⋅10-5 |
2,1 ⋅ 10-6 |
Tak więc stała Kp maleje ze wzrostem temperatury.
Ze zmianą temperatury zmienia się wartość stałej Kp Kc i Kx.
5. Dobór optymalnych warunków określonej reakcji
Na przykładzie reakcji syntezy amoniaku:
N2(g) + 3H2(g) = 2NH3(g)
Reakcja powinna zachodzić:
a) szybko,
b) z wysoką wydajnością.
|
szyb -kość |
wydaj-ność |
optymalne warunki |
stała równowagi |
temperatura |
+ |
- |
umiarkowana |
- |
ciśnienie |
+ |
+ |
wysokie |
0 |
katalizator |
+ |
0 |
obecny |
0 |
stężenie substratów |
+ |
+ |
nadmiar jednego z substratów |
0 |
„+” - wpływ dodatni,
„-” - wpływ ujemny,
„0” - brak wpływu. Koniec rozdziału X-go.
Władysław Walkowiak Chemia Ogólna WPC 1002w
2 / 16
CO2 + H2 → CO + H2O
stan równowagi
CO + H2O → CO2 + H2
Szybkość reakcji chemicznej
stąd:
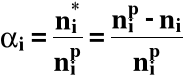
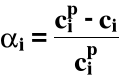
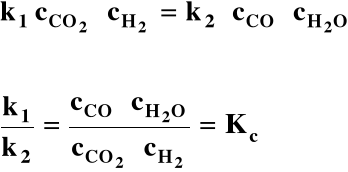
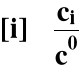
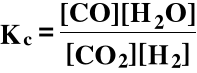
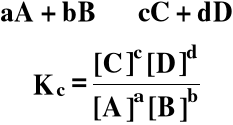
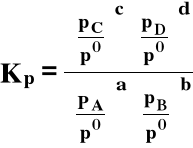
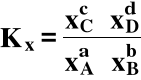
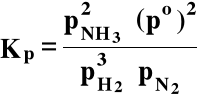
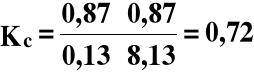
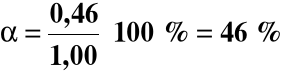
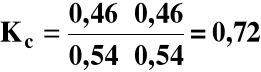
Rozdział X. Równowaga chemiczna. Prawo działania mas
Wyszukiwarka
Podobne podstrony:
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11a. Elektrolity - kwasy, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 9. Rownowaga chemiczna. Prawo dzialania mas PCHN SKP studport
Walkowiak, chemia ogólna, równowaga chemiczna i prawo działania mas
Wyklad 10. Rownowaga chemiczna, chomikowe, WYKŁADY z Chemii
7.Prawo działania mas - równowaga chemiczna, Chemia ogólna ćwiczenia
prawo dzialania mas
PRAWO WYKŁAD 10, Licencjat UE, prawo
Wykład Ch F równowagi chemiczne
WYKŁAD 10 równowaga kwasowo zasadowa
więcej podobnych podstron