Węglowodory
Podstawą klasyfikacji węglowodorów jest forma połączenia się atomów węgla (łańcuch lub pierścień) oraz rodzaj wiązań występujących w cząsteczce. Na tej podstawie dzieli się węglowodory na dwie zasadnicze grupy, aromatyczne i alifatyczne.
Węglowodory aromatyczne czyli areny to takie, których cząsteczki tworzą, połączone w pierścień, atomy węgla o hybrydyzacji sp2 więc w pierścieniu co drugie wiązanie jest podwójne. ![]()
H
|
C
/ \\
H - C C - H
|| |
H- C C - H
\ //
C
|
H
![]()
Węglowodory alifatyczne czyli alkile zbudowane są z łańcuchów lub pierścieni węglowych. Dzieli się je ze względu na rodzaj występujących w cząsteczce wiązań. Jeżeli atomy węgla połączone są wyłącznie wiązaniami pojedynczymi, czyli sigma, mówi się o węglowodorach nasyconych czyli alkanach. Jeżeli występuje jedno wiązania podwójne, mówi się o alkenach, jeżeli jest wiązanie potrójne wówczas mówi się o alkinach. Jeżeli atomy węgla połączone są w opierścień nazwę grupy poprzedza się przedrostkiem cyklo, a więc cykloalkany, cykloalkeny czy cykloalkiny. Porównując ich aktywność należy zwrócić uwagę na fakt, że w związkach tych występują bardzo trwałe wiązania atomowe, w formie definicyjnej między atomami węgla (układy homojądrowe), zaś wiązania między atomami węgla i wodoru również mieszczą się w kategorii wiązań atomowych, ponieważ różnica elektroujemności tych pierwiastków wynosi 0,4. O aktywności węglowodorów decyduje więc pojawienie się wiązania podwójnego, a w tym słabszego wiązania pi. Takie wiązanie w cząsteczkach węglowodorów stanowi miejsce zachodzenia reakcji chemicznych. Reasumując, alkile dzieli się na:
alkany - węglowodory łańcuchowe lub pierścieniowe w cząsteczkach których występują wyłącznie wiązania pojedyncze (sigma)
alkeny - węglowodory łańcuchowe lub pierścieniowe, w cząsteczkach których występuje jedno wiązanie podwójne
alkiny - węglowodory łańcuchowe lub pierścieniowe, zawierające w cząsteczce wiązanie potrójne (dwa wiązania pi)
Alkany
To szczególnie ważna grupa związków organicznych. Stanowią one punkt wyjścia do otrzymywania dalszych typów związków, również z ich nazw tworzy się tzw. nazwy systematyczne dalszych typów połączeń organicznych. Z tego względu bardzo ważne jest nauczenie się nazw i wzorów dziesięciu pierwszych przedstawicieli szeregu homologicznego alkanów. Tworzenie szeregów homologicznych jest typowe dla grup połączeń organicznych. Pod tym pojęciem rozumie się szereg związków chemicznych różniących się stałym fragmentem cząsteczki, tak zwaną różnicą homologiczną. W przypadku alkanów szereg homologiczny opisuje wzór ogólny CnH2n+2 zaś różnicę homologiczną stanowi grupa metylenowa (-CH2-) Oto nazwy, wzory sumaryczne oraz półstrukturalne dziesięciu pierwszych alkanów:
metan CH4
etan C2H6 CH3-CH3
propan C3H8 CH3-CH2-CH3
butan C4H10 CH3-CH2-CH2-CH3
pentan C5H12 CH3-CH2- CH2- CH2- CH3
heksan C6H14 CH3 -CH2 -CH2 -CH2 -CH2-CH3
heptan C7H16 CH3 -CH2 -CH2 -CH2 -CH2 -CH2 -CH3
oktan C8H18 CH3 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH3
nonan C9H20 CH3 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH3
dekan C10H22 CH3 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH2 -CH3
Zapis strukturalny jest kwestią umowną gdyż atomy węgla w tych połączeniach wykazują hybrydyzację sp3 (ponieważ każdy atom tworzy cztery wiązania sigma) i tak każdy staje się centrum tetraedru. Każda cząsteczka alkanu jest więc szeregiem połączonych narożami czworościanów, jest to więc struktura bardzo złożona i właśnie dlatego wprowadzono uproszczenie rysując atomy węgla w szeregu. Chcąc skrócić i tę niedogodność (patrz długość łańcucha np. dekanu), węglowodór ten można zapisać w formie skróconego wzoru półstrukturalnego: CH3-(CH2)8-CH3. Proszę pamiętać o takim opanowaniu nazw i wzorów węglowodorów aby móc je kojarzyć natychmiast i jednoznacznie.
Ze względu na możliwość występowania różnych form połączenia się atomów w węglowodorach występuje zjawisko izomerii. Polega ono na tym, że związkowi o określonym wzorze sumarycznym może odpowiadać kilka różnych struktur - izomerów. Podobnie jest w szeregu homologicznym alkanów.
Alkany otrzymuje się na skalę przemysłową w wyniku przetwórstwa ropy naftowej a konkretnie w wyniku jej destylacji. Otrzymuje się wówczas różne frakcje, z których do najważniejszych należy niewątpliwie frakcja benzynowa złożona głównie z węglowodorów ciekłych. Aby zwiększyć udział tej frakcji w przetwórstwie ropy stosuje się dwa szczególnie ważne procesy, są to tzw. kraking polegający na rozłamywaniu dłuższych łańcuchów węglowych na ośmioczłonowe, właściwe dla benzyn. Drugi proces to reforming, który z kolei polega na otrzymywaniu łańcuchów rozgałęzionych. Takie węglowodory posiadają wyższą liczbę oktanową i tym samym nie wymagają stosowania innych substancji antystukowych, takich jak np. tetraetyloołów czy benzen.
Pierwsze cztery węglowodory (od metanu do butanu) są gazami dalej do piętnastego to ciecze i powyżej ciała stałe. W zależności od stany skupienia znajdują różne zastosowanie techniczne, gazowe jako paliwo i surowiec w syntezie chemicznej, ciekła jako paliwa zaś substancje stałe to smary. Pierwszy w szeregu alkanów metan, na przykładzie którego omawia się alkany, otrzymuje się na skalę laboratoryjną dwoma sposobami:
W wyniku działania kwasem solnym lub wodą na węglik glinu: Al4C3+12HCl→4AlCl3+3CH4(↑)
Przez rozkład termiczny mieszaniny stałego octanu sodu i wodorotlenku sodu: CH3COONa + NaOH
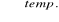
Na2CO3 + CH4(↑)
Właściwości fizyczne: gaz bezbarwny, bezwonny, lżejszy od powietrza (przypominam sposób wyliczenia tego: powietrze to przede wszystkim azot, którego masa molowa wynosi 28 g/mol, jeżeli uwzględnimy jeszcze około 20%, nieco cięższego, tlenu to „masa molowa” powietrza, a ściślej masa 22,4 dm3 powietrza wynosi w przybliżeniu 29g. Teraz wystarczy porównać masę molową interesującego nas gazu z wartością 29 i już wiemy, czy jest cięższy, czy też lżejszy od powietrza. Tak więc metan ze swą masą molową 16 g/mol jest prawie dwukrotnie lżejszy od powietrza. Metan nie rozpuszcza się w wodzie gdyż sam niepolarny nie będzie się rozpuszczał w polarnej wodzie. Metan rozpuszcza się natomiast w benzenie, który jest wzorcowym rozpuszczalnikiem apolarnym.
Właściwości chemiczne: Ze względu na występujące w cząsteczkach alkanów wiązania kowalencyjne typu sigma, związki te wykazują małą aktywność chemiczną.
A. Ulegają reakcji spalania, która może przebiegać na trzy sposoby:
Spalanie całkowite, którego produktami są para wodna i dwutlenek węgla CH4+2O2→CO2+2H2O
Półspalanie, którego produktami są tlenek węgla i para wodna: CH4+1,5O2→CO + 2H2O
Spalanie niecałkowite, prowadzące do węgla i pary wodnej: CH4+O2→C+2H2O,wydzielająca się sadza powoduje, ten typ spalania określa się również jako spalanie kopcącym płomieniem
Dla spalania alkanów na powietrzu typowe są dwa pierwsze sposoby spalania
B. Reagują z fluorowcami według schematu reakcji podstawiania czyli inaczej substytucji dając fluorowcopochodne oraz odpowiednie fluorowcowodory. Reakcja taka biegnie stopniowo podstawiając każdy z atomów wodoru:
CH4 + Cl2→CH3Cl + HCl - powstały produkt to chlorometan lub inaczej chlorek metylu
CH3Cl + Cl2→ CH2Cl2 + HCl - nazwa pochodnej to chlorek metylenu lub dichlorometan
CH2Cl2 + Cl2→ CHCl3 + HCl - trichlorometan, chlorek metylidenu, nazwa zwyczajowa chloroform
CHCl3 + Cl2→CCl4+HCl - tetrachlorometan lub zwyczajowo tetra
Reakcja substytucji jest typowa dla alkanów, charakterystyczne jest równoległe utworzenie silnego kwasu (!)
C. Nie dają charakterystycznych reakcji odbarwiania wody bromowej i zakwaszonego roztworu manganianu(VII) potasu
Fluorowcopochodne są punktem wyjścia do otrzymania innych ważnych połączeń, oto przykłady najistotniejszych reakcji fluorowcopochodnych:
Substytucja fluorowca grupą hydroksylową, reakcja taka biegnie z środowisku wodnym
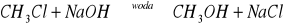
i prowadzi do alkoholuReakcja fluorowcopochodnej z zasadą w środowisku alkoholowym, następuje eliminacja fluorowcowodoru i utworzenie soli
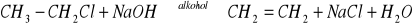
Difluorowcopochodne reagując z metalami aktywnymi powodują utworzenie alkenów, następuje eliminacja fluorowca CH2Cl-CH2Cl + Zn→CH2=CH2+ZnCl2
Synteza Würtza, polegająca na przedłużeniu łańcucha węglowego w wyniku stapiania fluorowcopochodnej z metalicznym sodem: 2CH3Cl + 2Na→CH3-CH3 + 2NaCl
Fluorowcopochodne stosuje się do tzw. alkilowania, czyli podstawienia rodnika alkilowego : CH3-CH2-CHCl-CH3 +CH4→CH3-CH2-CH(CH3)-CH3 + HCl
D. Nazewnictwo i izomery alkanów: nazwy alkanów pochodzą najczęściej od liczebników greckich lub łacińskich określających ilość atomów węgla w cząsteczce, z zastosowaniem, typowej dla alkanów, końcówki -an. Warto jednak wiedzieć, że nazwy czterech pierwszych są nazwami zwyczajowymi. Pewne trudności można zauważyć przy tworzeniu nazw węglowodorów o rozgałęzionych łańcuchach węglowych. Przy tworzeniu nazw systematycznych wg tzw. nomenklatury genewskiej musimy pamiętać o kilku zasadach
wybieramy najdłuższy łańcuch węglowy
atomy węgla numerujemy tak, aby podstawniki miały możliwie najniższe lokanty (kolejne numery atomów węgla w łańcuchu podawane cyframi arabskimi)
podstawniki podaje się w porządku alfabetycznym, jeżeli występuje kilka takich samych podstawników to podaje się lokant każdego z nich a następnie odpowiednim przedrostkiem potwierdza ich ilość np. 3,4 - dimetylo. 1,2,3 -trichloro itd.
numery lokantów, nazwy kolejnych podstawników rozdziela się myślnikami
1 2 3 4 5 6
CH3-CHCl-CH2-C(CH3)Cl-CH2-CH3 wprowadzone lokanty określają rodzaj podstawowego węglowodoru, który złożony jest z sześciu atomów węgla czyli jest to heksan. Numerujemy z od lewej, gdyż bliżej tego końca znajduje się podstawnik. Jako pierwszy podaje się chlor, gdyż c (chloro) jest w alfabecie przed m (metylo), a teraz nazwa: 2,4-dichloro-4-metyloheksan. W podręcznikach jest wiele propozycji ćwiczeń, które radzę solidnie przerobić gdyż zrozumienie zasad nazewnictwa jest jedną z podstawowych umiejętności, i ułatwia poruszanie się w tematyce połączeń organicznych.
Alkeny
To grupa węglowodorów alifatycznych, w cząsteczkach których występuje wiązanie podwójne. Pojawienie się wiązania pi oznacza większą aktywność tych węglowodorów. Wzór ogólny szeregu alkenów to CnH2n. Pierwszy w szeregu związek musi posiadać dwa atomy węgla, gdyż tylko wówczas może wystąpić wiązanie wielokrotne. Nazwy tworzy się stosując końcówkę charakterystyczną -en i tak pierwszy, zawierający dwa atomy węgla to eten znany również pod bardzo popularną zwyczajową ogólną etylen. Zagadnienie jest nieco bardziej złożone gdy weźmiemy pod uwagę buten. Podwójne wiązanie może się znaleźć między pierwszym i drugim atomem węgla lub między drugim i trzecim. Wówczas jako lokant wiazania wielokrotnego podaje się niższy numer atomu węgla i tak pierwszy będzie się nazywał but - 1-en, zaś drugi but-2-en.
Eten jest bardzo popularnym związkiem i dlatego na podstawie tego właśnie połączenia charakteryzuje się alkeny. Cząsteczka etenu jest płaska i apolarna, każdy z atomów węgla posiada po trzy wiązania sigma więc wykazuje hybrydyzację sp2, którą cechuje kształt trygonalny, płaski z kątem między wiązaniami wynoszącym 1200:
H H
\ /
C=C
/ \
H H
Cząsteczka etenu jest płaska, gdyż wzdłuż podwójnego wiązania węgiel-węgiel nie następuje rotacja, czyli wszystkie atomy tworzące cząsteczkę leżą w jednej płaszczyźnie. Układ dwóch atomów węgla o hybrydyzacji sp2 może być powodem wystąpienia tak zwanej izomerii geometrycznej zwanej również izomerią cis-trans. Izomery te rozróżnia się na podstawie położenia podstawników przy tych atomach mianowicie, czy znajdują się po jednej lub dwóch stronach płaszczyzny poprowadzonej przez podwójne wiązanie. Oto przykład izomerów geometrycznych but-2-enu
CH3 H CH3 CH3
\ / \ /
C=C C = C
/ \ / \
H CH3 H H
trans-but -2-en cis-nut-2-en
Na skalę laboratoryjną eten otrzymuje się w wyniku odwodnienia etanolu w obecności kaolinu: ![]()
Reakcja dehydratacji alkoholi jest ogólną metodą otrzymywania alkenów.
Eten jest gazem, o gęstości zbliżonej do powietrza (M=28g/mol, czyli tyle ile wyliczyliśmy wcześniej dla powietrza). Jest to gaz bezbarwny, bezwonny. Nie rozpuszcza się w wodzie gdyż jest apolarny, natomiast rozpuszcza się w benzenie.
Właściwości chemiczne zostaną omówione w kolejności podobnej do tej, którą zastosowano dla alkanów, aby w ten sposób uwypuklić ich podobieństwa i różnice.
Zacznijmy od spalania, podobnie jak alkany w zależności od ilości dostarczanego tlenu może ulegać spalaniu całkowitemu i niecałkowitemu nie wykazuje zdolności do półspalania. Jeżeli spalanie następuje na powietrzu to spala się kopcącym płomieniem i ten typ spalania uważa się za typowy dla alkenów.
Reakcje z fluorowcami Reaguje bardzo łatwo, fluorowiec atakuje podwójne wiązanie, powoduje jego pęknięcie i do uwolnionych w ten sposób wiązań przyłączają się atomy fluorowca. Ten typ reakcji z fluorowcami, charakterystyczny dla alkenów, nosi nazwę reakcji przyłączania lub inaczej addycji. CH2=CH2+Cl2→CH2Cl-CH2Cl Oddzielnego omówienia wymaga reakcja addycji, w której uczestniczą cząsteczki asymetryczne np. chlorowodór lub woda. Chcąc określić miejsce podstawienia atomów stosuje się wówczas regułę Markownikowa zgodnie z którą wodór zostaje podstawiony do atomu węgla, przy którym jest więcej atomów wodoru. Przykładowo reakcja propenu z chlorowodorem będzie miała przebieg: CH3-CH=CH2+HCl→CH3-CHCl-CH3 powstaje 2-chloropropan
Łatwość reagowania z fluorowcami powoduje, że alkeny mają zdolność odbarwiania wody bromowej zgodnie z równaniem reakcji: CH2=CH2+Br2→CH2Br-CH2Br
Etylen odbarwia również zakwaszony roztwór manganianu(VII) potasu
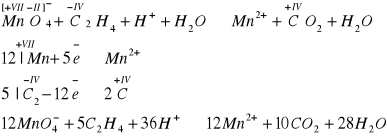
Reakcja polimeryzacji - alkeny ulegają polimeryzacji, to znaczy małe cząsteczki tzw. monomery, w wyniku pękania wiązań pi stają się dwuwartościowymi rodnikami, które łącząc się z sobą tworzą duże cząsteczki, zwane polimerami. Fazy polimeryzacji można prześledzić na przykładzie etylenu, kiedy to powstaje bardzo popularne tworzywo polimeryzacyjne - polietylen:
Etap I - pękanie wiązania pi ![]()
Etap II - tworzenia polimeru n [-CH2-CH2-]![]()
→ [-CH2-CH2-]n
Alkiny
To węglowodory alifatyczne posiadające w cząsteczce wiązanie potrójne, tak więc wzór ogólny szeregu homologicznego tych węglowodorów ma postać CnH2n-2. Nazwy tych związków charakteryzuje się końcówką -yn lub -in, gdy brzmi to lepiej po polsku. Pierwszy w szeregu etyn (lub etin) znany jest również pod bardzo popularną nazwą zwyczajową acetylen. Na podstawie tego związku charakteryzuje się tę grupę węglowodorów nienasyconych. Acetylen, tak na skalę techniczną i laboratoryjną, otrzymuje się w wyniku reakcji węglika wapnia tzw. karbidu, z wodą: CaC2 + 2H2O → Ca(OH)2 + C2H2. Cząsteczka acetylenu ma budowę liniową ponieważ każdy z atomów węgla tworzy dwa wiązania sigma więc ulega hybrydyzacji sp1, którą cechuje linearne ułożenie orbitali zhybrydyzowanych, tak więc cała cząsteczka ma budowę linearną, którą można zapisać: H-C≡C-H. Na podstawie budowy można więc wywnioskować, że acetylen, podobnie jak wszystkie alkiny będzie wykazywał cechu podobne do alkenów, jednak fakt występowania w cząsteczce aż dwóch wiązań pi oznacza ich większą aktywność.
Właściwości fizyczne Acetylen jest gazem bezbarwnym i bezwonnym(!). Powszechnie wiadomo jednak, że acetylen otrzymany z karbidu posiada charakterystyczny zapach. Pochodzi on jednak od pewnych zanieczyszczeń samego karbidu. W acetylenie technicznym pozostawia się jednak te zanieczyszczenia aromatyzujące, gdyż w ten sposób łatwo stwierdzić nieszczelności w instalacjach technicznych acetylenu. Wyliczenie jego masy molowej (26 g/mol) pozwala stwierdzić, że jest nieco lżejszy od powietrza. Apolarność cząsteczki oznacza również, że nie rozpuszcza się w wodzi a jedynie w benzynie.
Właściwości chemiczne Jak już wspomniano, dwa wiązania pi w cząsteczce oznaczają, że będzie aktywniejszy od alkenów. Oto charakterystyczne właściwości chemiczne alkinów na przykładzie acetylenu.
Reakcja spalania - w sposób typowy dla nienasyconych ulega soalaniu całkowitemu i niecałkowitemu. Nie ulega półspalaniu. Spalając się na powietrzu ulega spalaniu niecałkowitemu, czyli spala się kopcącym płomieniem. C2H2 + ½O2 → 2C + H2O
Regulując dopływ powietrza np. w palnikach, spalanie może przebiegać całkowicie, z wydzieleniem dużej ilości ciepła. Takie spalanie wykorzystuje się w palnikach acetylenowych służących tak do cięcia jak i spawania metali.
Reakcja z fluorowcami - jako węglowodór nienasycony, reaguje z fluorowcami według reakcji addycji (przyłączenia). Daje również pozytywny efekt w reakcji odbarwiania wody bromowej oraz odbarwiania zakwaszonego roztworu manganianu(VII) potasu:
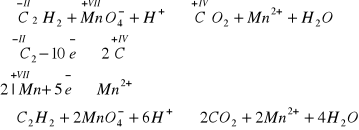
Reakcje polimeryzacji -jest to również zachowanie typowe dla węglowodorów nienasyconych. Szczególnie ważna jest reakcja trymeryzacji (gdyż połączą się trzy mole) acetylenu, która prowadzi do benzenu, głównego przedstawiciela węglowodorów aromatycznych. Cykl równań reakcji przejścia od połączenia nieorganicznego, jakim jest karbid do węglowodoru aromatycznego - benzenu, jest niezwykle często przytaczany w testach maturalnych, proszę ten cykl równań zapamiętać
Reakcja hydratacji alkinów ( synteza Kuczerowa) - polega na katalitycznym uwodnieniu alkinów. Uwodnienie 1- alkinów prowadzi do aldehydów, zaś pozostałych do ketonów. Najbardziej znana jest reakcja uwodnienia acetylenu, której produktem jest aldehyd octowy. Katalizatorem tego procesu jest siarczan(VI)rtęci(II)
C2H2+H2O ![]()
CH3-CHO
Jeżeli przykładowo uwodnienie zastanie poddany but-2-in wówczas powstaje keton (butanon)
CH3-C≡C-CH3 + H2O ![]()
CH3-CH2- C -CH3
||
O
Uwaga - porównując wzory ogólne poszczególnych grup węglowodorów alifatycznych z łatwością można zauważyć pewne prawidłowości w zakresie izomerii, i tak:
alkeny są izomerami cykloalkanów
alkiny są z kolei izomerami cykloalkenów lecz również alkadienów
Węglowodory aromatyczne - aryle
Są to związki węgla z wodorem, w których atomy węgla o hybrydyzacji sp2 tworzą pierścienie szęcioczłonowe, tak jak to pokazano na początku rozdziału. Występujące w takim pierścieniu trzy wiązania pi tworzą układ sprzężony, co oznacza, że taki sekstet elektronowy ma charakter zdelokalizowany i to stanowi o specyfice tego typu układu. Nadaje mu szczególną elektroujemność i szereg cech, które upodobniają węglowodory aromatyczne tak do nasyconych jak i nienasyconych. Omawiając więc ich właściwości chemiczne często będziemy je porównywali z olefinami (nienasyconymi) jak i parafinami (nasyconymi). Tę grupę połączeń omawia się głównie na przykładzie najprostszego i najbardziej znanego czyli benzenu. Nazwa tej grupy - aromatyczne, ma charakter historyczny, gdyż wiele połączeń z tej grupy nie posiada zapachu. Aryle są ważnymi połączeniami niezwykle cennymi w licznych syntezach chemicznych. Na skalę techniczną węglowodory aromatyczne otrzymuje się z przetwórstwa smoły koksowej. Na skalę laboratoryjną zaś, jako przykład, podaje się otrzymywanie benzenu przez trimeryzację acetylenu o czym wspomniano już przy omawianiu acetylenu. 3C2H2 → C6H6
Właściwości fizyczne - benzen jest bezbarwną ruchliwą cieczą o charakterystycznym zapachu. Jako substancja apolarna nie rozpuszcza się w wodzie, zaś ze względu na gęstość pływa po jej powierzchni. Cechuje się charakterystycznym zapachem. Pary benzenu wdychane wykazują właściwości oszałamiające. Benzen jest dodawany do paliw jako substancja antystukowa, jednak ze względu na właściwości kancerogenne (rakotwórcze) jest systematycznie wycofywany z paliw i jakichkolwiek innych zastosowań np. zupełnie wycofano niezwykle popularny dawniej klej na bazie benzenu o nawie butapren.
Reakcja spalania - ze względu na skład pierwiastkowy jest substancją łatwopalną, jednak na powietrzu spala się bardzo intensywnie kopcącym płomieniem: C6H6+1½O2→6C + 3H2O
Reakcje z fluorowcami - mimo dwóch wiązań podwójnych w cząsteczce benzen, zależnie od warunków reakcji, może z chlorowcami reagować według schematu reakcji substytucji jak i addycji.
Reakcja substytucji w obecności katalizatora np. FeCl3 lub AlCl3
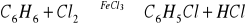
powstaje chlorobenzenreakcja addycji z obecności światła, następuje stopniowe pękanie wiązań podwójnych i przyłączania chlorowca lub wodoru, gdy ten pierwiastek jest przyłączany. Oto przykład: C6H6 + Cl2 → C6H6Cl2 powstały związek nie ma już charakteru aromatycznego, ponieważ pierścień utracił sekstet elektronów zdelokalizowanych, pozostały tylko dwa wiązania podwójne, powstała więc chlorowcopochodna cykloheksadienu. Szczególne znaczenie ma całkowite wysycenie wiązań pi benzenu wodorem, powstaje wówczas cykloalkan, o nazwie cykloheksan: C6H6+3H2→C6H12
Reakcje pochodnych benzenu - fluorowcopochodne benzenu mogą być podstawiane np. grupami hydroksylowymi dając fenole, mogą być również podstawiane grupami alkilowymi i wówczas mówimy o tzw. alkilowaniu. W ten sposób można otrzymać homologi benzenu toluen - metylobenzen oraz ksyleny dimetylobenzeny. Celowo podano ksyleny w liczbie mnogiej ponieważ dwie grupy metylowe mogą się znajdować w trzech możliwych położeniach względem siebie. W położeniu orto -gdy znajdują się przy sąsiadujących atomach węgla (Obok siebie), para, gdy są to atomy węgla 1-4 (przeciwnie położone atomy węgla) oraz meta- gdy mamy atomy węgla w położeniu między orto i para. Tak więc ksylen, w zależności od wzajemnego położenia grup metylowych może być o-ksylenem (mówi się ortoksylen), m-ksylenem (mówi się metaksylen) lub p-ksylenem (mówi się paraksylenem). Wzajemne położenie kolejnego wprowadzanego do pierścienia podstawnika zależy od rodzaju podstawnika, który już znajduje się w pierścieniu. Wyróżnia się dwa rodzaje podstawników:
podstawniki I rodzaju (np. -NH2, -OH, -OCOCH3, -CH3, -Cl, -Br) kierują nową grupę w położenie orto i para
podstawniki II rodzaju (np. -NO2, -SO3H, -COOH, -CHO)kierują nową grupę w położenie meta
w przypadku obecności podstawników obu rodzajów, dominuje wpływ kierujący podstawników I rodzaju
Reakcje z mocnymi kwasami- siarkowym(VI) i azotowym(V). Uznaje się je za reakcje charakterystyczne dla węglowodorów aromatycznych. Bardziej rozpowszechniona jest reakcja z kwasem azotowym(V), zwana reakcją nitrowania, gdyż w miejsce jednego z atomów wodoru w pierścieniu zostaje wprowadzona grupa nitrowa -NO2. Węglowodory aromatyczne ulegają nitrowaniu w obecności tzw. mieszaniny nitrującej, będącej mieszaniną stężonego kwasu azotowego(V) oraz siarkowego(VI). Kwas siarkowy w mieszaninie spełnia dwa zadania:
Powoduje specyficzną dysocjację kwasu azotowego(V) z utworzeniem grupy nitrowej:
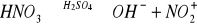
Kwas siarkowy(VI) jako substancja higroskopijna, pochłania wodę, która jest produktem reakcji i w związku z tym powoduje przesunięcie równowagi reakcji w kierunku produktów, ułatwiając jej przebieg:
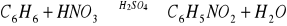
Podstawienie grupy nitrowej nadaje związkom barwę żółtą i dlatego nitrobenzen jest cieczą barwy żółtej. Posiada również charakterystyczny zapach gorzkich migdałów.
Reakcja z kwasem siarkowym(VI) zwana reakcją sulfonowania prowadzi do utworzenia kwasu sulfobenzenowego, który jest silnym kwasem:
H2SO4 + C6H6 → C6H5SO3H + H2O grupa -SO3H nosi nazwę grupy sulfonowej
Porównanie właściwości węglowodorów
Typ reakcji- cecha |
Parafiny |
Olefiny |
Aromatyczne |
Rodzaj wiązań |
Wyłącznie sigma |
Sigma oraz pi |
Sekstet elektronów zdelokalizowanych |
Spalanie |
Całkowite Półspalanie Niecałkowite |
Całkowite i niecałkowite |
Całkowite i niecałkowite |
Otrzymywanie |
Ropa naftowa, gaz ziemny W laboratorium: Al4C3+12HCl→4AlCl3+3CH4 |
Dehydratacja alkoholi
C2H5OH Reakcja karbidu z wodą CaC2+H2O→Ca(OH)2+C2H2 |
Smoła koksowa Benzen-3C2H2→C6H6 |
Reakcja z fluorowcami |
Substytucja CH4+Cl2→CH3Cl+HCl |
Addycja C2H4+Cl2→C2H4Cl2 |
Zarówno addycja (światło) jak substytucja (katalizator) |
Reakcja z wodą bromową |
Nie odbarwia |
Odbarwia |
Nie odbarwia |
Reakcja z manganianem(VII) potasu |
Nie odbarwia |
Odbarwia |
Nie odbarwia |
Polimeryzacja |
Nie ulega |
Ulega |
Nie ulega |
Reakcja nitrowania |
Nie ulegają |
Nie ulegają |
Ulegają (typowa dla aromatów) |
Reakcja sulfonowania |
Nie ulega |
Nie ulega |
Ulega |
Reakcje z wodą |
Konwersja metanu z parą wodną CH4+H2O |
Hydratacja alkenów do alkoholi w obecności kaolinu C2H4+H2O→C2H5OH Hydratacja alkinów do alkanali i alkanonów |
Brak reakcji charakterystycznych z wodą |
Przykładowe zadania z testów maturalnych
Zaproponuj cykl przemian chemicznych, które należy przeprowadzić w celu otrzymania aniliny (benzenoaminy). Substancją wyjściowa jest węglik wapnia.
Wyjaśnij, zapisując odpowiednie równania reakcji, jaki wpływ mają warunki prowadzenia procesu bromowania toluenu na przebieg reakcji. Uzasadnij czy toluen jest homologiem czy izomerem benzenu ?
Na etyn podziałano wodą w obecności jonów Hg2+ i H+. Jaki związek powstał, zapisz równanie odpowiedniej reakcji.
Napisz równania reakcji etynu z bromem i bromowodorem. Podaj nazwy powstałych produktów oraz reakcji, które zaszły używając określeń stosowanych w chemii organicznej dla tego typu połączeń.
Podaj wzory półstrukturalne i nazwy czterech związków o wzorze sumarycznym C6H12 , pamiętając aby przynajmniej jeden z nich miał rozgałęziony łańcuch węglowy.
Jednym z ważniejszych związków wapnia wykorzystywanym w syntezie chemicznej jest węglik wapnia CaC2. Otrzymuje się go w wyniku spiekania tlenku wapnia z koksem. Powstaje wówczas węglik wapnia oraz tlenek węgla(II). W równaniu reakcji węgliku wapnia z wodą powstaje etyn, zapisz odpowiednie równania reakcji.
Zapisz równania reakcji następującego ciągu przemian oraz podaj ich nazwy:
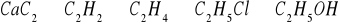
Acetylen stanowi ważny surowiec do otrzymania wielu związków. Poniżej podano schematycznie niektóre możliwości, napisz odpowiednie równania reakcji oraz podaj nazwę odpowiedniego typu równania reakcji: acetylen → benzen → chlorobenzen → hydroksybenzen → chlorofenol
Syntezie Würtza poddano mieszaninę chlorometanu i chloropropanu. Napisz odpowiednie równia reakcji oraz podaj wszystkie możliwe produkty, zakładając, że wszystkie możliwe reakcje biegną z równym prawdopodobieństwem.
Rozwiązania powyższych zadań
Zad.1
Zadanie dotyczy związku chemicznego o którym będzie mowa znacznie później, jednak ze względu na charakterystyczny przebieg przemian, zostanie przytoczony. Szczególnie często mówi się o przemian od węgliku wapnia do benzenu. Oto kolejne procesy:
CaC2 + 2H2O → Ca(OH)2 + C2H2
3C2H2 → C6H6 proces trimeryzacji
C6H6 + Cl2
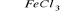
C6H5Cl + HCl substytucjaC6H5Cl + NH3 → C6H5NH2 + HCl
Zad.2
Warunki przeprowadzenia tej reakcji decydują, czy podstawieniu ulegnie rodnik alifatyczny (grupa metylowa) czy aromatyczny (pierścień benzenowy). Jeżeli taka substytucja prowadzona jest pod wpływem światła podstawienie następuje w rodniku alifatycznym, zaś obecność katalizatora kieruje substytucję do pierścienia benzenowego, w miejsce zależne od rodzaju podstawionego wcześniej podstawnika.
C6H5CH3 + Br2 ![]()
C6H5CH2Br + HBr
C6H5CH3 + Br2 ![]()
C6H4BrCH3 + HBr jako, że grupa metylowa jest podstawnikiem pierwszego rodzaju, powstały związek może być orto lub para bromotoluenem.
Porównując wzory benzenu C6H6 oraz toluenu C6H5CH3, widzimy, że różnią się grupą -CH2 czyli typową różnicą homologiczną. Związki te są więc homologami.
Zad.3
Podany w zadaniu opis procesu wskazuje, że chodzi o syntezę Kuczerowa, która pozwala z etynu otrzymać aldehyd octowy: C2H2 + H2O ![]()
CH3CHO
Zad.4
Ze względu na nienasycony charakter etynu będzie zachodziła reakcja oddycji, typowa dla takich węglowodorów:
HC≡CH + Br2 → BrCH=CHBr dibromoeten
HC≡CH + HBr → H2C=CHBr bromoeten
Zad. 5
C6H12 jest związkiem nienasyconym ale może być również cykloalkanem (cykloheksan). Izomeria może polegać na różnym usytuowaniu podwójnego wiązania.
CH3-CH=CH-CH2-CH2-CH3 heksa -2- en
CH2=CH-CH2-CH2-CH2-CH3 heksa - 1 -en
CH3-CH2-CH=CH-CH2-CH3 heksa - 3 - en
CH2 =C-CH2-CH2-CH3 2 - metylopenta - 1- en
|
CH3
Zad.6
Zadanie polega na napisaniu odpowiednich równań reakcji:
CaO + 3C
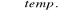
CaC2 + COCaC2 + 2H2O → Ca(OH)2 + C2H2
Zad.7
Oto równania czterech kolejnych równań reakcji
CaC2 + 2H2O → Ca(OH)2 + C2H2
C2H2 + H2 → C2H4
C2H4 + HCl → C2H5Cl
C2H5Cl + NaOH
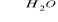
C2H5OH + NaCl
Zad. 8
Równania kolejnych równań reakcji:
3C2H2 → C6H6 reakcja trimeryzacji
C6H6 + Cl2 ![]()
C6H5Cl + HCl reakcja substytucji
C6H5Cl + NaOH ![]()
C6H5OH + NaCl reakcja substytucji
C6H5OH + Cl2 ![]()
C6H4(OH)Cl + HCl grupa -OH jest podstawnikiem pierwszego rodzaju, więc może się utworzyć orto- lub para- chlorofenol
Zad. 9
Możliwe są następujące kombinacje połączenia rodników: metylowy z metylowym, 1-propylowy z 1- propylowym i metylowy z 1 - propylowym, oto odpowiednie równania reakcji:
2CH3Cl + 2Na → 2NaCl + CH3-CH3 etan
2 C3H7Cl + 2Na → 2NaCl + C6H14 heksan
CH3Cl + C3H7Cl + 2Na → C4H10 + 2NaCl butan
15
Wyszukiwarka
Podobne podstrony:
weglowod, Chemia, Liceum, klasa II
''Włókna węglowe (''Chemia w szkole'' 6 2008 r )
weglowodory, Chemia, Gimnazjum, kl3, Weglowodory
Węglowodory, chemia, GIMNAZJUM
ściąga - węglowodory, chemia, liceum, ściągi
CHEMIA- POCHODNE WĘGLOWODORÓW, CHEMIA
pods. - węglowodory, chemia, podsumowanie wiadomości
węglowodory, chemia
cukry węglowodory, Chemia
jednofunkcyjne pochodne węglowodorów, chemia
Weglowodory, Chemia
Chemia - Weglowodory, Chemia Fizyka Matma
Węglowce(1), Chemia, Chemia nieorganiczna
08 - Węglowodory, chemia, matura podstawowa
Naturalne źródła węglowodorów, Chemia
WIELOFUNKCYJNE POCHODNE WĘGLOWODORÓW, CHEMIA MATURA, ĆWICZENIA
Weglowodany2007, chemia kosmetyczna
więcej podobnych podstron