1.Skale wielkosci, długości energii i czasu:
wielkość/długość: energia:
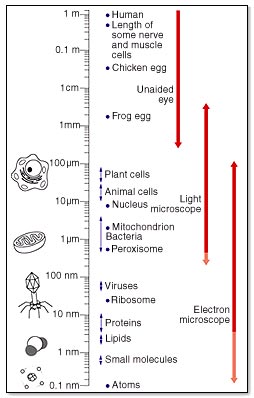
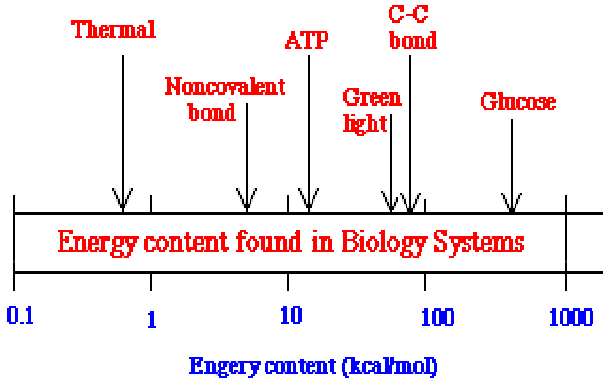
czas: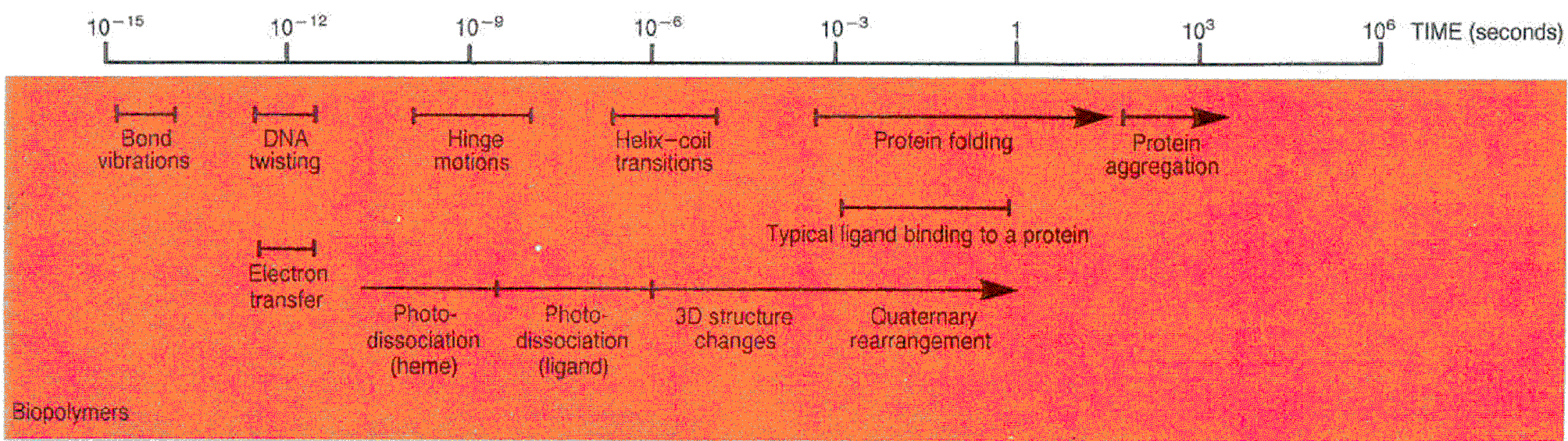
2. Materia ożywiona - filozofia budowy, sposoby prezentacji makromolekuł
Przez wieki życie było zdefiniowane w jednostce całego organizmu ... kota, ptaka, człowieka.
Życie objawia się w definicji komórek:
Najważniejszą cechą życia jest ciągła wymiana materii i energii między żywym organizmem a jego otoczeniem, z utrzymywaniem homeostazy, oraz zdolność do replikacji, powielania się, czy też rozmnażania i dziedziczenia cech. Do podtrzymywania wymiany energii z otoczeniem konieczny jest stały wkład wysiłku ze strony organizmu. Zatem życie to: zespół wzajemnie się podtrzymujących procesów metabolicznych zachodzących w organizmie żywym lub jego poszczególnych częściach. Istotną cechą życia, wywodzącą się z natury procesów metabolicznych, jest zdolność organizmów żywych do utrzymania wyższego poziomu uporządkowania, a więc niższej entropii niż otoczenie, kosztem zużycia energii.
W odróżnieniu od atomów i cząsteczek prostych badań w chemii i fizyce, nie ma dwóch identycznych komórek.
Makromolekuły można przedstawiać na modelach szkieletowych, szkieletowo kulkowych i czaszowych
3. Znaczenie stabilności makromolekuł - energia termiczna - energia aktywacji:
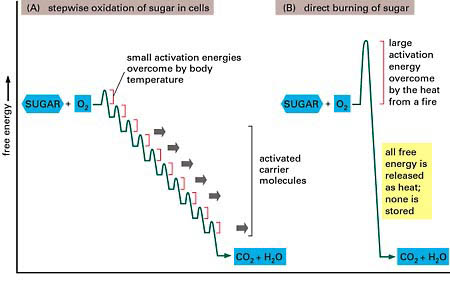
Sposób przekazywania energii jest najmniej efektywny, gdy jest uwalniana przez niekontrolowane duże skoki. Najbardziej efektywne, gdy wpływy przez przyrostowe, kontrolowanego uwalniania się z wielu małych ograniczeń.(tłumaczenie google ;P)
4. Komórka - ogólne zasady oraz przepływ istotnych dla jej funkcjonowania wielkości
(szczerze mówiąc nei wiem co tu powinno być)
5. Termodynamika podstawowe pojęcia
Podstawowe pojęcia termodynamiki:
równanie Clapeyrona (stan gazu idealnego pV=nRT),
energia wewnętrzna(całkowita energia układu będącą sumą energii oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych układu, a także energii ruchu cieplnego cząsteczek oraz wszystkich innych rodzajów energii występujących w układzie.)
energia swobodna(część energii całkowitej układu, która może być zamieniona na pracę w procesie o stałej temperaturze i ciśnieniu.)
Stan termodynamiczny to wartość wszystkich funkcji stanu (np. ciśnienie, objętość, temperatura, masa, entropia, energia wewnętrzna)
gaz doskonały(atomy nie posiadaja obętości), roztwór doskonały(roztwór, który powstając w izotermiczno-izobarycznym procesie dyfuzji nie doznaje zmiany objętości i energii wewnętrznej.)
kryształ doskonały(nie ma w nim żadnych defektów sieci krystalicznej, nie jest, zanieczyszczony żadnymi substancjami obcymi ani nie występują w nim żadne obszary innej faz, jest nieskończenie duży - tzn. nie ma powierzchni, lub przynajmniej na tyle duży, że można całkowicie pominąć w obliczeniach efekty powierzchniowe.)
6. pierwsza zasada termodynamiki
Zmiana energii wewnętrznej układu zamkniętego jest równa energii, która przepływa przez jego granice na sposób ciepła lub pracy
7.druga zasada termodynamiki
w układzie termodynamicznie izolowanym istnieje funkcja stanu zwana entropią S, której zmiana ΔS w procesie adiabatycznym spełnia nierówność
, przy czym równość zachodzi wtedy i tylko wtedy, gdy proces jest odwracalny.
W uproszczeniu można to wyrazić też tak:
"W układzie termodynamicznie izolowanym w dowolnym procesie entropia nigdy nie maleje"
8. entropia termodynamiczna funkcja stanu, określająca kierunek przebiegu procesów spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym. Entropia jest miarą stopnia nieuporządkowania układu. Ciało pozbawione niedoskonałości, zwane kryształem doskonałym, ma w temperaturze 0 bezwzględnego (0 K) entropię równą 0, gdyż jego stan może być zrealizowany tylko na jeden sposób (każda cząsteczka wykonuje drgania zerowe i zajmuje miejsce o najmniejszej energii)
9. Stan równowagi termodynamicznej to stan, w którym nie zachodzi wymiana energii między układem a otoczeniem. Dwa układy, które nie są od siebie cieplnie odizolowane, znajdują się w stanie równowagi termodynamicznej, jeżeli mają jednakową temperaturę.
Stan ustalony: stan układu fizycznego, w którym opis tego układu jest niezależny od zmiennej czasu. Należy zwrócić uwagę, iż nie oznacza to braku ruchu, przepływu ciepła itp., a jedynie niezmienność tych wielkości w czasie.
10. Entalpia swobodna Gibbsa:
G=U+pV-TS
11. Dyfuzja proces samorzutnego rozprzestrzeniania się cząsteczek lub energii w danym ośrodku (np. w gazie, cieczy lub ciele stałym), będący konsekwencją chaotycznych zderzeń cząsteczek dyfundującej substancji między sobą lub z cząsteczkami otaczającego ją ośrodka.
Pierwsze prawo Ficka stwierdza że:
strumień cząstek dyfuzji jest proporcjonalny do gradientu stężenia
gdzie:
J - strumień składnika (masa molowa składnika przepływająca przez jednostkowy przekrój w jednostce czasu),
D - współczynnik dyfuzji,
φ - stężenie [(ilość substancji) na jednostkę objętości],
x - współrzędna osi, wzdłuż której zachodzi dyfuzja.
Dyfuzja umożliwia zjawisko mieszania się substancji pozostających w fazie gazowej lub ciekłej. Siłą napędową dyfuzji przy mieszaniu jest dążenie układu do równowagi termodynamicznej przez osiągnięcie jak najwyższej entropii i jak najniższej energii swobodnej. Efektem wolnej, nieskrępowanej dyfuzji w gazach i cieczach jest wyrównywanie się stężeń wszystkich składników w całej objętości fazy. Osiągnięcie stanu równowagi nie oznacza jednak zatrzymania dyfuzji. Trwa ona nadal, tyle że dzięki dokładnemu wymieszaniu się wszystkich składników nie prowadzi już do zmian stężenia.
12. Lepkość właściwość płynów i plastycznych ciał stałych charakteryzująca ich opór wewnętrzny przeciw płynięciu. Lepkością nie jest opór przeciw płynięciu powstający na granicy płynu i ścianek naczynia. Lepkość jest jedną z najważniejszych cech płynów (cieczy i gazów).
Inne znaczenie słowa "lepkość" odnosi się do "czepności" - terminu stosowanego w dziedzinie klejów.
Zgodnie z laminarnym modelem przepływu lepkość wynika ze zdolności płynu do przekazywania pędu pomiędzy warstwami poruszającymi się z różnymi prędkościami.
Różnice w prędkościach warstw są charakteryzowane w modelu laminarnym przez szybkość ścinania. Przekazywanie pędu zachodzi dzięki pojawieniu się na granicy tych warstw naprężeń ścinających. Wspomniane warstwy są pojęciem hipotetycznym, w rzeczywistości zmiana prędkości zachodzi w sposób ciągły (zobacz: gradient), a naprężenia można określić w każdym punkcie płynu. Model laminarny lepkości zawodzi też przy przepływie turbulentnym, powstającym np. na granicy płynu i ścianek naczynia
Różne rodzaje przeływów:
.
13. Liczba Reynoldsa jedna z liczb podobieństwa stosowanych w mechanice płynów (hydrodynamice, aerodynamice i reologii). Liczba ta pozwala oszacować występujący podczas ruchu płynu stosunek sił czynnych (sił bezwładności) do sił biernych związanych z tarciem wewnętrznym w płynie przejawiającym się w postaci lepkości.
Liczba Reynoldsa zdefiniowana jest w sposób:
lub równoważnie:
gdzie:
- wymiar charakterystyczny zagadnienia (m),
14. Oddziaływania międzycząsteczkowe - inne niż wiązania chemiczne siły wiążące atomy i cząsteczki.
Do oddziaływań tych zalicza się (w kolejności od najsilniejszych do najsłabszych):
oddziaływania jon-jon (elektrostatyczne) - zachodzą między dwiema różnoimiennie naładowanymi cząsteczkami; od wiązań jonowych różni je to, że ładunek w oddziałujących ze sobą cząsteczkach nie jest skoncentrowany na jednym atomie, lecz jest zdelokalizowany na kilku-kilkunastu atomach. Siła ich oddziaływania jest proporcjonalna do 1/r2 (gdzie r - odległość między cząsteczkami). W przypadku ośrodka zawierającego inne ładunki (np. roztworu elektrolitu) efekt oddziaływania jest mniejszy. (Zobacz też: para jonowa.)
wiązania wodorowe - tworzą się, gdy atom wodoru z cząstkowym ładunkiem dodatnim jest współdzielony przez dwie cząsteczki, które posiadają atomy z cząstkowym ładunkiem ujemnym. Wiązania wodorowe, jeśli występują w obrębie jednej cząsteczki, są często traktowane jak słabe wiązanie chemiczne; jeśli jednak wiąże ono dwie lub więcej cząsteczek, można je traktować jako oddziaływanie międzycząsteczkowe.
oddziaływania trwały dipol - trwały dipol - tworzą się między cząsteczkami posiadającymi trwałe momenty dipolowe. Cząsteczki takie posiadają w jednych miejscach nadmiar ładunku ujemnego, a w innych jego niedomiar. Oddziałują one ze sobą tak jak jony - tyle, że oddziaływanie to jest słabsze, gdyż w grę wchodzą cząstkowe, a nie całkowite ładunki elektryczne, a także przyciąganiu pomiędzy ładunkami różnoimiennymi towarzyszy zawsze odpychanie pomiędzy ładunkami jednoimiennymi.
oddziaływania van der Waalsa - są to oddziaływania między trwałym dipolem i indukowanym (wzbudzonym) dipolem. W cząsteczkach, które nie posiadają trwałego momentu dipolowego, może on być wzbudzany przez cząsteczki z trwałym momentem; następnie taki wzbudzony dipol i trwały dipol oddziałują na siebie podobnie jak dwa trwałe dipole, tyle że znacznie słabiej. W cząsteczkach bez trwałego momentu dipolowego występują natomiast stochastyczne fluktuacje ich chmur elektronowych, powodujące powstawanie chwilowych momentów dipolowych. Cząsteczka posiadająca chwilowy moment dipolowy może go wzbudzić w cząsteczce sąsiadującej, wskutek czego obie cząsteczki mogą się nawzajem chwilowo przyciągać lub odpychać. Uśrednienie sił odpychających i przyciągających daje w wyniku oddziaływanie przyciągające proporcjonalne do 1/r6. Oddziaływania van der Waalsa wynikają m.in. z korelacji ruchów elektronów pomiędzy oddziałującymi atomami - dlatego w metodach obliczeniowych nieuwzględniających korelacji elektronowej sił tych praktycznie nie ma.
15. Stany konformacyjne makromolekół:
chyba chodzi np o białka zwinięte i zdenaturowane?
16. Bariera energetyczna jest - podawaną często w przeliczeniu na 1 mol substancji - wielkością (w skali mikroskopowej - bariera potencjału), którą musi pokonać układ reagujących indywiduów chemicznych, aby doszło do reakcji chemicznej.
17. Oddziaływania wewnątrzmolekularne
Struktury wielkocząsteczkowe mają bardzo wiele stopni konformacyjne swobody.
Każda reszta makrocząsteczki i część ich powierzchni wchodzą w interakcję z otoczeniem i ze sobą nawzajem. Interakcje te są tym co ustawia kryteria stabilności i dynamiczne ograniczenia struktur biologicznych. Po więcej odsyłam do stryera :)
The folding of a mcacromolecule
Wyszukiwarka
Podobne podstrony:
opracowanie pytań BIOFIZYKA
opracowane pytania z biofiz, materialy farmacja, I rok, biofizyka
opracowanie zagadnien z biofizyki
opracowanie pytań BIOFIZYKA
234, Biofizyka, Opracowanie
blok 5 od konca, biofizyka, biofizyka opracowania blokow
TEST BIOFIZYKA 2011 opracowane, biofizyka, BIOFIZYKA
Biofizyka pytania opracowane wykład 9
10a 285-297, Biofizyka, Opracowanie
biofizyka opracowania
237 i 238 Cechy dźwięku, Biofizyka, Opracowanie
Biofizyka pytania opracowane wykład 7
Biofizyka opracowanie(2), Biofizyka_opracownaie
OPRACOWANE ZAGADNIENIA NA EGZAMIN Z BIOFIZYKI 09 2010 (dla tych
Biofizyka teoria opracowana
biofizyka opracowanie 2
Biofizyka moje opracowanie
więcej podobnych podstron