Gospodarka azotowa
N w tkankach roślinnych - do 6% suchej masy.
Składnik aa, nukleotydów, bierze udział prawie we wszystkich reakcjach biochemicznych zachodzących w żywych organizmach, jego niedobór - częsty czynnik ograniczający tworzenie nowych tkanek.
Metabolizm N ściśle związany z metabolizmem C, ponieważ szkielety molekularne, do których N wbudowywany i energia potrzebna do tych procesów- z metabolizmu C.
I. Przemiany azotu w roślinach
1. Pobieranie N
N2 (którego w atmosferze jest około 78%) jest formą dla roślin niedostępną.
Głównymi formami N dostępnymi są NO3- i NH4+.
Z energetycznego punktu widzenia jony amonowe korzystniejsze - bo N już zredukowany i nie trzeba wydatkować energii na jego redukcję, jak to jest w przypadku azotanów. Ale dla roślin i tak najważniejszym źródłem N jest azotan.
Kilka słów wyjaśnień dlaczego azotan:
Istotny czynnik ułatwiający pobieranie jonów azotanowych - właściwości sorpcyjne gleby. Koloidy ilaste obecne w glebie wiążą kationy amonowe, natomiast aniony azotanowe pozostają w roztworze glebowym - są więc łatwiej dostępne.
Azotan reguluje aktywność enzymów asymilacyjnych - zatem to podwyższone stężenie tego jonu będzie prowadzić do zwiększenia aktywności enzymów włączających N, natomiast zwiększone stężenie amoniaku - nie.
Duże stężenie amoniaku może być toksyczne dla roślin.
W czasie pobierania amonu następuje znaczny spadek pH gleby, większość roślin źle to toleruje.
Poza tym w większości gleb amon jest szybko i tak utleniany do azotanu przez bakterie chemosyntetyzujące (Nitrosomonas i Nitrobacter).
Azotan pobierany jest na zasadzie transportu aktywnego, co wiąże się z wydatkowaniem energii, stąd w słabo przewietrzanych glebach i w niskiej temperaturze (niekorzystnie wpływa to na oddychanie) mogą wystąpić trudności z pobieraniem azotanów.
2. Asymilacyjna redukcja azotanów
Redukcja azotanów poprzedza ich właściwą asymilację, czyli redukcyjną aminację 2-oksokwasów (α-ketokwasów). 8 elektronowa redukcja, wymaga dużej ilości energii. Proces dwustopniowy.
Pierwszy etap - redukcja azotanu do azotynu.
Reduktaza azotanowa (NR) w cytoplazmie (roślina może mieć więcej niż jedną)
(u większości roślin jest to enzym, którego ekspresja indukowana obecnością azotanów, choć np. u roślin motylkowatych - występują także konstytutywne reduktazy)
Typowym donorem elektronów dla NR jest NADH (choć wykryto także w glonach i w korzeniach traw enzym mogący wykorzystywać NADH lub NADPH. W ogóle w korzeniach odkryto jeszcze co najmniej dwie, zupełnie inne reduktazy zdolne do redukcji azotanów, choć niektóre np. prawdopodobnie redukują azotan do NO).
NR: homotetramer zawierający po jednej cząsteczce FAD, hemu (cyt b557) i molibdenopteryny w każdej z 4 podjednostek. Jak przenoszone są elektrony przez ten łańcuch kofaktorów?
(NR - może występować też jako homodimer)
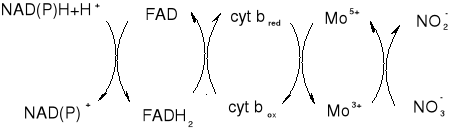
Rośliny pozbawione Mo nie są zdolne do przyswajania azotanów, bo reduktaza nie ma wszystkich kofaktorów (również hodowanie roślin na pożywce z wolframianem powoduje, że wolfram jest wbudowywany do reduktazy zamiast Mo i powstaje nieaktywny enzym)
NR jest jednym z niewielu enzymów roślinnych, których ekspresja jest regulowana egzogennym substratem. Rośliny posiadające indukowalną NR (a nie posiadające konstytutywnych) mają ten enzym tylko wtedy, gdy azotan jest obecny w podłożu. Azotan musi być także stale obecny, by poziom NR był utrzymywany na stałym poziomie, gdyż ten enzym ulega szybkiej degradacji. W wielu typach komórek kation amonowy jest represorem syntezy NR. Aktywność enzymu jest regulowana przez światło (powiązania z systemem fitochromowym (?) ja osobiście czytałam o regulacji poprzez fosforylację enzymu i jego wiązanie z innym białkiem, które zmienia jego aktywność, są także inne mechanizmy) Konieczność ścisłej regulacji NR jest ważna, ponieważ enzym ten tworzy azotyn, który jest dla komórki w większych stężeniach toksyczny (reaguje m.in. z hemem, aminokwasami, zasadami azotowymi) i musi być natychmiast przekształcany „dalej” do amonu przez kolejny enzym - reduktazę azotynową. Reduktaza azotynowa jest z kolei uzależniona od działającego łańcucha transportu elektronów (o czym później) i po ustaniu fotosyntezy - przestaje działać. Konieczne jest zatem wtedy natychmiastowe wyłączenie NR , żeby nie produkowała więcej azotynu, gdy niemożliwa jest natychmiastowa dalsza redukcja tegoż azotynu.
Wracając do samej NR- działa ona u części gatunków zarówno w pędach jak i w korzeniach a u części gatunków albo w pędach albo w korzeniach. Rośliny cienioloubne mają tendencję do redukcji azotanu w korzeniach, światłolubne - w liściach. Mogą występować różne izoformy enzymu. Stężenie NR jest w korzeniach pszenicy większe niż w pędach, ale aktywność NR w pędach 500x przewyższa aktywność enzymu z korzeni.
Drugi etap - redukcja azotynu do amonu
Reduktaza azotynowa (NiR) - kompletna redukcja azotynu do amoniaku
Jako donor elektronów do redukcji wykorzystuje ferredoksynę. Zredukowana ferredoksyna powstaje w wyniku działania fotosyntetycznego łańcucha transportu elektronów, dlatego też redukcja azotynów jest zależna od światła. W tkankach fotosyntetyzujących NiR występuje w chloroplastach.
W tkankach niefotosyntetyzujacych - w plastydach, zredukowana Fd ulega redukcji przez NADPH wytwarzany w oksydacyjnym szlaku pentozowym (u grzybów donorem elektronów zamiast Fd jest bezpośrednio NADPH).
NiR ma bardzo duże powinowactwo do azotynu i kilka a nawet kilkanaście razy większą aktywność od NR, co zapewnia szybką i wydajną redukcję produkowanego przez NR azotynu.
3. Asymilacja właściwa
Czyli włączanie do aminokwasów.
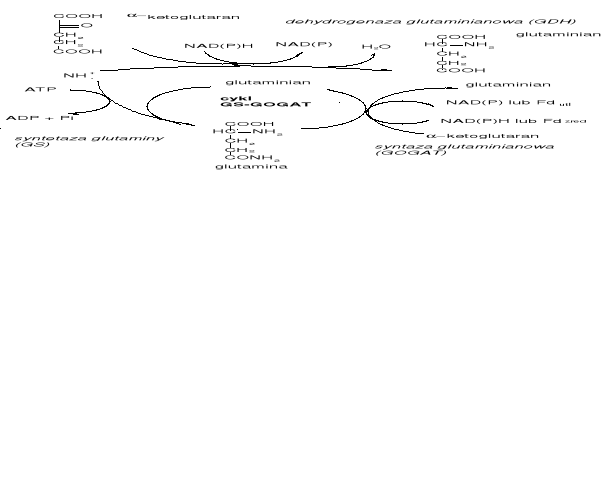
Głównym mechanizmem asymilacji azotu jest tzw. cykl GS-GOGAT - w ten sposób odbywa się przyswajanie co najmniej 90% jonów amonowych. Cykl GS-GOGAT wymaga więcej energii ale enzymy, które go przeprowadzają mają większe powinowactwo do swoich substratów, niż GDH do α-ketoglutaranu. Grupa -NH2 może być potem przenoszona z Glu na inne α-ketokwasy (pochodzące z metabolizmu węglowodanów) w reakcjach transaminacji - w ten sposób powstają inne aminokwasy.
4. Wydzielanie azotu.
Rośliny oszczędzają swój azot. Tylko w śladowych ilościach mogą wydzielać go w postaci NH3. Niewielkie ilości aa mogą być wydzielane do gleby przez korzenie. Przed zrzuceniem liści część azotu jest z nich wycofywana. Trochę azotu roślina traci w owocach.
Azot z obumarłych części roślin jest wykorzystywany przez mikroorganizmy, które z powrotem przekształcają go do związków nieorganicznych.
II. Metabolizm azotowy mikroorganizmów
1. Organizmy wiążące N2
Prokariotyczne organizmy zdolne do wiązania atmosferycznego azotu są bardzo ważnym ogniwem obiegu azotu w przyrodzie.
Wiązanie azotu atmosferycznego polega na jego redukcji, w wyniku której powstają dwie cząsteczki amoniaku. Proces ten jest silnie endoergiczny.
(Azotobacter - na 1g związanego N2 zużywa 50 g glukozy, Clostridium - bakteria beztlenowa - aż 170 g)
Bakterie brodawkowe - dostarczają roślinie amoniak lub glutaminę, otrzymują związki węgla. Roślina zapewnia im też warunki rozwoju.
Przykłady organizmów zdolnych do wiązania azotu atm.
Organizmy symbiotyczne
- Rizobia: Rhizobium, Bradyrhizobium, Azorhizobium, Sinorhizobium (symbioza z roślinami motylkowatymi: łubin, wyka, koniczyna) - są najważniejszą grupą, jeśli chodzi o ilość wiązanego N2, brodawki korzeniowe i w łodydze,
- Frankia (Actinomycetes) (symbioza z np. olchą, drzewami, krzewami rosnącymi na glebach ubogich w azot), brodawki korzeniowe
- Azospirillum (Actinomycetes) trawy tropikalne - nie tworzą brodawek korzeniowych, tylko pozostają na powierzchni korzenia
symbiotyczne sinice Anabaena (symbioza z Azolla - paproć wodna, Cycas - sagowce)
roślina tropikalna Psychotria i Klebsiella rubicarum - brodawki liściowe,
Wolnożyjące:
sinice np. Anabaena, Nostoc
niektóre inne bakterie fotosyntetyczne: Rhodobacter, Rhodopseudomonas (względne tlenowce) Chromatium, Chlorobium (bezwzględne beztlenowce)
niefotosyntetyzujące bakterie: Azotobacter (bezwzględny tlenowiec), Klebsiella, Clostridium(bezwzględny beztlenowiec)
Udział w wiązaniu azotu znacznie mniejszy od symbiotycznych.
2. Bakterie brodawkowe
Zdolność do redukcji azotu jest u nich ściśle związana z symbiozą z roślinami motylkowatymi. Przez część cyklu życiowego bakt. brod. żyją w glebie jako saprofity, zdecydowana większość z nich nie ma wtedy zdolności wiązania N2. Zdolność ta jest uzyskiwana dopiero po wniknięciu przez włośniki do kory pierwotnej korzenia rośliny motylkowej i rozpoczęciu kooperacji z gospodarzem. Do komórek korzenia bakterie dostają się przez tzw. nić infekcyjną utworzoną przez roślinę z materiału ściany komórkowej . Kiedy nić infekcyjna dotrze przez włośnik do pierwszych warstw komórek korzenia, bakterie zostają z niej uwolnione do wakuol zwanych symbiosomami. Po infekcji bakterie dzielą się intensywnie, jednocześnie pobudzając komórki gospodarza do szybkiego wzrostu - powstają brodawki. W symbiosomach bakterie ulegają znacznym zmianom morfologicznym, przekształcając się z pałeczek w nieregularnie rozgałęzione formy zwane bakteroidami. Wniknięcie bakterii rozpoczyna ciąg procesów prowadzących do wiązania N2 i eksportu. Niezbędnym warunkiem jest wspólna koordynacja ekspresji genów gospodarza i bakterii oraz wymiana sygnałów pomiędzy nimi.
A jak to się zaczyna? Korzenie roślin motylkowych wydzielają do gleby (izo)flawonoidy, które u bakterii indukują ekspresję genów nod, kontrolujących proces tworzenia brodawek. Flawonoidy wydzielane przez różne gatunki roślin imdukują geny nod u różnych grup bakterii (rośliny strefy umiarkowanej np. koniczyna, groch wydzielają luteolinę i naryngeninę indukujące geny u Rhizobium, a soja - ze strefy tropikalnej, wydziela genisteinę i daidzeinę indukujące ekspresję genów u Bradyrhizobium). Prawdopodobnie szlak biosyntezy flawonoidów ulega modyfikacjom w obecności bakterii - skład flawonoidów w korzeniach zmienia się po inokulacji Rhizobium. Geny nod kodują białka odpowiedzialne za syntezę i transport cząsteczek sygnałowych zwanych czynnikami Nod, które inicjują organogenezę brodawek Czynniki Nod są oligosacharydami lipochitynowymi (N-acetylowane chitooligosacharydy), składają się z 3-5 monoacylowanych cząsteczek N-acetyloglukozaminy połączonych wiązaniami β-1,4. Podstawniki w szkielecie cukrowym decydują o specyficzności czynnika Nod względem gospodarza oraz wpływają na jego stabilność i aktywność biologiczną. Potraktowanie korzeni roślin motylkowatych nanomolowymi stężeniami oczyszczonych czynników Nod wywołuje kilka wczesnych reakcji brodawkowania (np. deformacja włośników korzeniowych, utworzenie merystemu brodawki, podziały komórek kortykalnych) - rozpoznanie sygnału Nod wyzwala u roślin tworzenie brodawki.
Synteza Nod - w wyniku ekspresji genów, których ekspresja indukowana flawonoidami. Bakteryjne geny brodawkowania można podzielić na tzw. wspólne - com (common) nod i specyficzne względem gospodarza - hsn (host-specific nodulation) nod. Wspólne nod występują u wszystkich gatunków bakt. brod. - oznacza się je: A, B, C i D. Nod D ulega konstytutywnej ekspresji w symbiotycznych i wolnożyjących bakteriach wiążących N2 - białko Nod D jest aktywatorem transkrypcji pozostałych genów nod. Białka Nod z różnych gatunków bakterii wykazują bardzo duży stopień homologii, ale mogą oddziaływać tylko z określonymi flawonoidami. Nod D po związaniu flawonoidu ulega aktywacji - i aktywuje transkrypcję Nod A, B i C potrzebnych do syntezy czynników Nod - odpowiedzialne są one za syntezę głównego szkieletu łańcucha cukrowego , geny nod A, B, C znajdują się na dużym plazmidzie Rhizobium lub na „chromosomie” Azo- i Bradyrhizobium. Nod C - łączy monomery N-acetylo-D-glukozaminy, Nod B - odłącza grupę acetylową od nieredukującego końca cukru pozycji R3, zaś Nod A przyłącza w tym miejscu cząsteczkę kwasu tłuszczowego. Powstały łańcuch ulega dalszym modyfikacjom z udziałem białek stanowiących produkty genów hsn nod. Geny nod E i F decydują o długości łańcucha i stopniu nienasycenia kwasu tłuszczowego. Inne geny hsn kontrolują wprowadzanie do głównego łańcucha cukrowcowego specyficznych podstawników. Spora część z nich modyfikuje pozycję R1 na redukującym końcu cząsteczki. Czynniki Nod działają w niskich stężeniach (10-7-10-12 mola/dm3) i są bardzo specyficzne - stąd postuluje się obecność specyficznych receptorów u roślin. Pierwsze odpowiedzi na sygnał Nod można zaobserwować w komórkach włośników już po kilku minutach. Błona komórkowa ulega depolaryzacji, mniej więcej po 10 min pojawiają się pulsacje cytoplazmatycznego poziomu Ca2+, po nich następuje reorganizacja cytoszkieletu. W późniejszych stadiach rozwoju brodawki w odpowiedzi na zmniejszanie stężenia tlenu w jej wnętrzu aktywowane są inne klasy genów bakteryjnych: nif i fix. Inne białka kontrolują przebieg infekcji i wiązania N2.
W najwcześniejszych stadiach symbiozy, zanim dojdzie od wiązania N2 w epidermie korzeni zachodzi ekspresja wczesnych roślinnych genów nodulinowych ENOD, kodujących białka zwane wczesnymi nodulinami. Noduliny biorą udział w procesie infekcji i morfogenezie brodawek. Najwcześniej aktywowane geny kodujące peroksydazę i białka bogate w prolinę, prawdopodobnie wchodzące w skład ściany komórkowej nici infekcyjnej.. Białka kodowane genami ENOD - wiele różnych funkcji m.in. indukcja podziałów komórkowych, tworzenie zapory tlenowej brodawki zabezpieczającej nitrogenazę przez dostępem tlenu, transport Fe i Mo do bakteroidów. Jest też grupa genów jądrowych ulegających ekspresji dopiero, gdy rozwój brodawki zaawansowany - tuż przed rozpoczęciem i w trakcie wiązania N2 - tzw. późne geny nodulinowe NOD. Niektóre z powstających transkryptów oddziałują swoiście z komórkami zawierającymi bakteroidy, inne - z niezainfekowanymi. Kodują one leghemoglobinę (charakterystyczne białko brodawki) oraz enzymy (lub podjednostki) katalizujące asymilację wydzielanego przez bakterioidy amoniaku i transport powstających amidów lub ureidów. Rośliny motylkowe strefy umiarkowanej - np. koniczyna, bób - transportują głownie amidy, Gln i Asn. Motylkowate ze strefy tropikalnej - np. fasola, soja- transportują azot w formie ureidów -alantoiny, kwasu alantoinowego i cytruliny. Związki te powstają z puryn, które są syntetyzowane w komórkach zainfekowanych i utleniane w komórkach sąsiednich. Po dotarciu do pędu ureidy są przekształcane z wydzielaniem amoniaku włączanego ponownie do związków organicznych w cyklu GS-GOGAT. Najintensywniejsze wiązanie N2 - przed okresem kwitnienia gospodarza. Po kwitnieniu - natężenie wiązania słabnie, brodawki rozpadają się a bakterie wydostają się do gleby. Rośliny motylkowate najlepiej poznaną grupą roślin żyjących w symbiozie z bakteriami wiążącymi atmosferyczny azot - ze względu na ich szerokie wykorzystanie rolnicze (zielony nawóz - np. łubin, wyka, koniczyna; pasze), ale są także inne pary - roślina-bakteria (patrz wyżej, na koniec p.1).
Sinice - jeśli rosną na podłożu pozbawionym azotu. Nitkowate Anabaena, czy Nostoc tworzą w regularnych odstępach heterocysty - duże, grubościenne, wyspecjalizowane komórki pozbawione niektórych składników aparatu fotosyntetycznego - PSII) W heterocystach zachodzi wiązanie N2 z udziałem ATP i związków redukujących powstałych w wyniku fotosyntetycznego transportu elektronów. Sinice mogą być wolnożyjące, ale mogą też wchodzić w symbiozę z różnymi roślinami np. mchami, paprociami i roślinami nasiennymi. Próbowano stworzyć sztuczne układy symbiotyczne, z gatunkami roślin cennymi z rolniczego punktu widzenia, ale nie zakończyło się to powodzeniem.
3. Mechanizm wiązania azotu.
Podobny w różnych organizmach. Specjalny kompleks enzymatyczny - nitrogenaza. Składa się ona z dwóch enzymów, będących metaloproteinami. Obydwa białka udało się oczyścić i scharakteryzować.
Większe białko - zwane dinitrogenazą -lub białkiem MoFe zawiera miejsce redukcji N2. Heterotetramer - α2β2. Łączna masa cząsteczkowa 180-225 kDa w zal. od gatunku. Dwie pary nietypowych klastrów metalosiarkowych - pierwsza z tych par jest silnie związana z białkiem i występuje we wszystkich nitrogenazach - kompleks 8Fe-7S, atomy Fe związane 6 wiązaniami kowalencyjnymi z Cys białka. Druga para klastrów związana z białkiem znacznie słabiej i może ulec oderwaniu. W bakteriach wchodzących w związki symbiotyczne z roślinami np. Rhizobium i Bradyrhizobium - klastry te występują w postaci 1Mo-3Fe-3S i 4Fe-3S i są powiązane ze sobą 3ma dodatkowymi atomami S nieorganicznej. Atom Mo jest połączony z homocytrynianem. Nitrogenaza bakterii symbiotycznych zawsze zawiera Mo - zatem jest on niezbędny do symbiotycznego wiązania N2. Bakterie wolnożyjące w przypadku braku Mo, mogą go zastępować wanadem lub Fe. Powstające w ten sposób nitrogenazy alternatywne V-nitrogenaza i Fe-nitrogenaza słabiej redukują azot natomiast wytwarzają więcej H2.
Mniejsze białko - reduktaza dinitrogenazy, zwana też białkiem Fe, jest zbudowana z 2 identycznych podjednostek o masie 30-72 kDa, koordynujących symetrycznie pojedyncze centrum 4Fe-4S. Jego funkcją jest wiązanie ATP i dostarczanie elektronów dinitrogenazie.
Do działania dinitrogenazy konieczna obecność ATP i Mg2+.
Jak wygląda cykl pracy nitrogenazy?
Białko Fe przyjmuje elektrony od zredukowanej Fd lub flawodoksyny (Fld)
Następnie tworzy kompleks z dwoma Mg2+ i dwoma ATP.
W tej postaci tworzy kompleks z białkiem MoFe i przekazuje mu elektrony. Redukcja białka MoFe jest sprzężona z hydrolizą związanego ATP. Białko MoFe ma także związaną w centrum aktywnym cząsteczkę N2
W dinitrogenazie elektrony najpierw ulegają akumulacji w klastrze żelazowym, a następnie zostają przekazane na klaster żelazowo-molibdenowy. W ten sposób powstaje aktywny enzym zdolny do wiązania i redukcji N2.
4) redukcja cząsteczki N2
(dzięki obecności Fe procesy zachodzące w białku MoFe i białku Fe można badać metodami spektroskopowymi - spektroskopią EPR oraz mössbauerowską. In vitro jako czynnika redukcyjnego używa się Na2S2O4 a N2 można zastąpić acetylenem lub cyjanowodorem - obydwa związki mają wiązanie potrójne. Redukcja acetylenu do etylenu jest reakcja charakterystyczną dla nitrogenazy i służy do oceny jej aktywności zarówno in vitro jak i in vivo).
Potrzebne 8krotne „obrócenie” się cyklu pracy nitrogenazy, by zredukować 1 cząsteczkę N2. Przez ten czas redukowana cząsteczka jest przytrzymywana w centrum aktywnym.
Wyizolowana nitrogenaza równolegle z redukcją N2 katalizuje wydzielanie H2
8H+ + 8e- + N2 -> 2NH3 + H2
W nienaruszonych komórkach wydzielanie wodoru jest zazwyczaj niewielkie, gdyż powstający H2 jest natychmiast rozkładany w reakcji odwrotnej (H2 -> 2H+ + 2e-) katalizowanej przez hydrogenazy.
Hydrogenazy różnią się umiejscowieniem w komórkach i należą do 3 odrębnych klas w zależności od składu grup prostetycznych. Zawierają centra: Fe-S, Ni/Fe-S lub Ni/Fe-S/Se. Sinica Anacystis nidulans ma dwie różne hydrogenazy - jedną w tylakoidach a drugą w błonie. Zainteresowanie organizmami zdolnymi do fotosyntetycznej produkcji wodoru - bo się zastanawiają nad wykorzystaniem ich do produkcji energii. Efekty jednak na razie są raczej mierne.
Redukcja N2 nie może zachodzić w obecności tlenu. Reduktaza dinitrogenazy jest bardzo wrażliwa na tlen - inaktywuje on ją nieodwracalnie w czasie kilkudziesięciu s. Proces wiązania azotu musi się odbywać w warunkach beztlenowych. Organizmy żyjące w warunkach tlenowych np. sinice muszą sobie stworzyć mikrośrodowisko pozbawione tlenu - do tego właśnie „służą im” heterocysty. Sinice nie wytwarzające heterocyst mogą wiązać azot tylko w warunkach beztlenowych.
Anabaena żyjąca w symbiozie z Azolla na polach ryżowych - ok. 80 kg N2/ha na rok.
Niektóre sinice (np. Gleotheca) rozdzielają czasowo fotosyntezę i wiązanie azotu. Azot wiążą w nocy, gdy fotosynteza nie produkuje tlenu.
Wiele organizmów zarówno symbiotycznych, jak i niesymbiotycznych zmniejsza stężenie tlenu w komórkach bardzo intensywnie oddychając.
Komórki roślin symbiotcznych wytwarzają leghemoglobinę z dużą wydajnością wiążącą tlen (leghemoglobina wykazuje homologię i podobieństwo strukturalne do hemoglobiny. Leghemoglobina nadaje różowy kolor brodawkom zawierajacym bakteroidy. Jego stężenie w cytoplazmie zainfekowanych komórek może być rzędu milimolowego. Postulowane role: leghemoglobina - podwójna rola - kontroluje stężenie wolnego tlenu, chroniąc nitrogenazę ale też ułatwia dyfuzję tlenu z cytoplazmy do oddychających bakteroidów - uczestniczy w dostarczaniu tlenu bakteriom.
W Streptomyces thermoautotrophicus odkryto nowy mechanizm wiązania azotu. Bakterię tę odkryto w glebie okrywającej stosy żarzącego się węgla drzewnego. W wyniku utleniania CO powstaje ponadtlenek utleniany przez oksydoreduktazę ponadtlenkową zawierającą Mn. Przekazuje ona elektrony z ponadtlenku na nitrogenazę. Ta nitrogenaza zawiera klastry FeS i Mo, ale jest niewrażliwa na tlen a także niezdolna do redukcji acetylenu.
4. Przemiany związków azotu prowadzone przez mikroorganizmy glebowe.
Metabolizm azotowy mikroorganizmów (w nawiasach podawana ΔG reakcji w kJ/mol substancji, jeśli ΔG ujemna to mikroorganizmy korzystają energetycznie).
Równania sumaryczne:
Amonifikacja
2CH2NH2COOH + 3 O2 -> 4 CO2 + 2H2O + 2 NH3 (-42,0)
Nitryfikacja
Bakterie nitryfikacyjne to chemosyntetyzujące bakterie czerpiące energię z utleniania amoniaku.
2 NH3 + 3 O2 -> 2HNO2 + 2 H2O (-15,8) Nitroso-
2HNO2 + O2 -> 2HNO3 (-4,2) Nitro-
Denitryfikacja
Bakterie denitryfikacyjne to bakterie, które w warunkach beztlenowych lub ograniczonego dostępu tlenu przeprowadzają oddychanie z wykorzystaniem azotanów jako akceptorów elektronów w oddechowym łańcuchu transportu elektronów.
C6H12O6 + 6 KNO3 -> 6CO2 + 3H2O + 6KOH + 3N2O (-130,2)
5C6H12O6 + 24KNO3 -> 30 CO2 + 18H2O + 24KOH + 12N2 (-136,1)
Wiązanie azotu
N2 -> 2N (+ 38,2)
2N + 3H2 -> 2NH3 (-3,0)
Reakcje przekształcania związków azotu - w procesach pozyskiwania energii.
Azot organiczny - dostaje się do gleby w postaci szczątków roślinnych i zwierzęcych. Organiczne formy azotu w glebie - zasadniczo niedostępne dla roślin. Jedynym organicznym związkiem azotu, który rośliny mogą przyswajać w znacznych ilościach jest mocznik (rośliny mogą też pobierać z otoczenia śladowe ilości niektórych aminokwasów np. Ala, Asp, wyjątkiem są rośliny z rejonów arktycznych, które są zdolne do pobierania znaczących ilości aminokwasów, w chłodnym klimacie mineralizacja i nitryfikacja przeprowadzana przez organizmy glebowe przebiega zbyt powoli, by „zaspokoić” potrzeby roślin, stąd konieczne było wykształcenie zdolności pobierania związków nie rozłożonych).
Bakterie i grzyby rozkładają związki organiczne np. aminokwasy z wydzielaniem amoniaku (proces amonifikacji).
Amoniak może pozostać w glebie związany w postaci soli amonowych, może także zostać utleniony najpierw do azotynu a potem do azotanu w procesie nitryfikacji przez autotroficzne bakterie glebowe.
Pierwszy etap - utlenianie amoniaku do azotynu przeprowadzają bakterie z grupy Nitroso, a drugi - utlenianie azotynu do azotanu - bakterie z grupy Nitro. Nie ma bakterii zdolnych do przeprowadzania naraz obydwu etapów, stąd obydwie grupy bakterii są od siebie wzajemnie zależne (bakterie Nitro- potrzebują, by bakterie Nitroso- dostarczyły im substratu, z kolei azotyn, jak pamiętamy, jest trujący, więc bakterie Nitroso też potrzebują, by ktoś im tworzony przez nie azotyn usuwał) i występują zawsze razem - zjawisko to nazywamy parabiozą.
Azotan może być ponownie pobrany przez rośliny, ale może też być redukowany do wolnego azotu w procesie denitryfikacji. W warunkach beztlenowych np. słabo przewietrzanych glebach lub ubogich w tlen wodach działają bakterie denitryfikujące - wykorzystujące azotan jako akceptor elektronów w łańcuchu oddechowym. Takie bakterie to np. Thiobacillus denitrificans, Micrococcus denitryficans. Powstałe produkty: NH4+, NO2-, tlenki azotu i N2 - wydzielane do otoczenia.
Nitryfikacja - z jednej strony lotny amoniak przekształcany do łatwo pobieranego przez rośliny azotanu, z drugiej strony jednak intensywna nitryfikacja prowadzi do zanieczyszczania wód gruntowych azotanami. Ponadto to nitryfikacja jest głównym źródłem N2O emitowanego do atmosfery. Tworzy się on jako produkt uboczny, na skutek niekompletnego utleniania amoniaku. W atmosferze w reakcjach fotochemicznych ulega dalszemu utlenieniu w reakcjach fotochemicznych do NO i NO2, które niszczą ozon.
Denitryfikatory usuwają azot z gleby, z drugiej strony jednak zapobiegają nadmiernemu gromadzeniu się azotu w oceanach.
5. Inne
N- 4te miejsce ilościowo, do 15% masy białek
Azotan - azot na + V
Amoniak - na -III
Reduktaza azotanowa redukująca azotan do azotynu wymaga dużo energii.
Sole amonowe są nietrwałe i lotne.
Azotyn - nie pobierany z gleby, w większych stężeniach toksyczny.
Molibden w NR jest wykorzystywany ze względu na wielość możliwych stopni utlenienia i liczb koordynacyjnych.
Niedawno odkryto oprócz formy cytoplazmatycznej, formę błonową - udział w redukcji azotu niewielki, za to udział w pobieraniu przez komórki roślinne Fe - ta forma błonowa raczej redukuje Fe z 3+ do 2+. Może regulować procesy transportu różnych jonów.
Pteryny, FAD, hem - absorbują światło niebieskie,
Neurosopra crassa, konidia - reduktaza azotanowa w błonie, regulacja transkrypcji przez substrat - dodanie azotanu 5-100x wzrasta mRNA, światło działa modulująco.
U roślin - aktywność NR regulowana też hormonalnie: cytokiny - pozytywnie, ABA - negatywnie
Regulacja potranslacyjne - fosforylacja, defosforylacja (na Ser, Thr)
Proteoliza - etap regulacji przez endoproteinazy serynowe (NR stosunkowo szybko degradowana)
Są też białkowe inhibitory aktywności NR.
Dużo mniej wiadomo o reduktazie azotynowej.
Dygresja:
Fenyloalanina - substrat do syntezy związków fenolowych: barwniki roślinne - antocyjany, ligniny (polifenole), związki sygnałowe (np. w odpowiedzi na atak patogenu), fitoaleksyny.
Antocjany - objawy stresu abiotycznego - np. chłodem, brakiem substancji mineralnych, zbyt dużym naświetleniem, stresem wodnym, osmotycznym. (koniec dygresji)
Obieg azotu zależy od metabolizmu bakterii.
Niepełna nitryfikacja może prowadzić do powstawania N2O (częściej) lub NO (rzadziej), tlenki azotu są niekorzystne:
reakcja z ozonem
kwaśne deszcze
Nitryfikacja głównym źródłem N2O wydzielanego do atmosfery (dygresja - N2O - ilość w atm wzrasta z szybkością 0,2%/rok)
Niepożądany skutek przenawożenia - eutrofizacja, (głownie w lipcu). Do tego dochodzi przenawożenie związkami fosforowymi.
Wiązanie azotu: 90% - biologicznie, 10% - procesy fizykochemiczne (np. wyładowania elektryczne), przemysł.
Wiązanie azotu wymaga bardzo dużo energii i zredukowanych związków pochodzących z oddychania. Azotobacter na asymilację 1 g N zużywa 50 g glukozy a Clostridium - 170 g.
Symbiotyczne bakterie produkują np. glutaminian na eksport a gospodarz dostarcza im cukry. Wzajemna aktywacja genów bakterii i roślin. Rhizobium w glebie żyją saprofitycznie i nie mają zdolności wiązania azotu, uzyskują tę zdolność po wniknięciu do komórek gospodarza.
Czynnik nod oznaczane E do Z są specyficzne dla gospodarza lub mikroorganizmu.
Wnikanie bakterii brodawkowych - nić infekcyjna budowana jest z materiału roślinnego normalnie wykorzystywanego do syntezy ściany, po wniknięciu do komórek bakterie uwalniane do apoplastu, ale nić infekcyjne rośnie dalej i może się dalej rozgałęziać. Na końcu nici tworzone i wydzielane do wnętrza korzenia pęcherzyki infekcyjne zawierające bakterie.
Czynniki Nod aktywują roślinne geny brodawkowania ENOD - wczesne, NOD - późne (bakteryjne czynniki - Nod, roślinne NOD).
Nitrogenaza - kofaktor molibdenowy: Cys, His w miejscu aktywnym, homocytrynian, centrum Fe-S, Mo
Azotobacter hodowany na podłożu bez Mo może zamiast niego wykorzystywać wanad. Azotobacter vinelandii hodowany bez molibdenu i wanadu może syntetyzować nitrogenazę zawierającą TYLKO centra Fe-S - taka nitrogenaza produkuje więcej wodoru.
Szlaki zmiatające wolne rodniki - askorbinianowo-glutationowe.
1
Wyszukiwarka
Podobne podstrony:
Sprawozdanie - GOSPODARKA WODNA ROŚLINY, Biologia UWr, II rok, Fizjologia Roślin
Fizjologia roślin wykłady, Biologia, fizjologia roślin
fizjo - wyk+éady, Leśnictwo UP POZNAŃ 2013, Fizjologia roślin drzewiastych
Zes. 7, AR Poznań - Leśnictwo, gleboznawstwo LP, Fizjologia roślin, tylko ściągi
instr X 4, Fizjologia Roślin, Biologia podstawowa
wykład 6 fizj roślin, biologia, fizjologia roślin
wyklad 4 fizj roślin, biologia, fizjologia roślin
Pytania z Fizjologii roślin z poniedziałku 3 września
Spr gosp kom, Biologia UWr, II rok, Fizjologia Roślin
fizjologia roslin - testy1+2, UG, FIZJO ROŚLIN, FIZJO, fizjo
instr V 1, Fizjologia Roślin, Biologia podstawowa
fizjo-kiełkowanie-folie111111, Leśnictwo UP POZNAŃ 2013, Fizjologia roślin drzewiastych
zadania fizjologia roślin
Fizjologia roślin
Fizjologia roślin
fizjologia roslin, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjo roslin
Ekofizjologia roslin wyklady, Studia, II rok, II rok, III semestr, Fizjologia roślin
więcej podobnych podstron