10
Patrycja Krzaczyńska
197834
Biotechnologia
wtorek 815-1000
Ćwiczenie nr 36
Oznaczanie współczynnika podziału acetonu pomiędzy toluen i wodę metodą refraktometryczną
1. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie współczynnika podziału acetonu pomiędzy dwie fazy, wodną i organiczną.
2. Wstęp teoretyczny
Współczynnik podziału - w dostatecznie rozcieńczonych roztworach stosunek stężeń składnika w dwóch współistniejących fazach ciekłych jest stały i niezależny od stężenia.
Refraktometria - wykorzystuje pomiary współczynników załamania światła badanych roztworów, na jej podstawie wnioskuje się o stężeniu oznaczanych substancji.
Określając stężenie acetonu w toluenie wykorzystujemy zależność:
Prawo podziału Nernsta - dotyczy układu dwóch nie mieszających się cieczy, w których rozpuszczalny jest trzeci składnik. Po ustaleniu się stanu równowagi w roztworze można wyznaczyć współczynnik podziału K.
K(T) - współczynnik podziału, a3 - aktywność składnika,
- dwie nie mieszające się ciecze
Objętości oby faz(toluenowej i wodej) są takie same, a więc równowagowe stężenie acetonu w fazie wodnej wyznaczamy z zależności:
Współczynnik kierunkowy prostej, przechodzącej przez początek układu jest równy współczynnikowi podziału. Można go wyznaczyć z zależności:
Refraktometr - przyrząd optyczny do pomiaru współczynnika załamania światła n różnych ośrodków; działanie większości refraktometrów oparte jest na zużytkowaniu zjawiska załamania światła w pryzmacie wykonanym z badanej substancji ( bezpośrednio wyznacza się kąt najmniejszego odchylenia promienia świetlnego w pryzmacie) lub zjawiska całkowitego wewnętrznego odbicia. Dokładność pomiaru tymi refraktometrami jest rzędu
10-5- 10-4; większą dokładność, 10-8 osiąga się w refraktometrach interferencyjnych (np.: r. Jamina ); wartość n wyznacza się wówczas z wielkości przesunięcia prążków interferencyjnych, które powstaje po wstawieniu badanego ciała w bieg jednej z dwu interferujących z sobą wiązek światła.
3. Wyniki pomiarów
Lp. |
Roztwór wyjściowy |
Roztwory równowagowe |
|||
|
n |
(C°)T |
N |
(C)T |
(C)w |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
4. Część doświadczalna
W kolbach przygotowałam roztwory acetonu w toluenie o stężeniach i objętości podanej przez prowadzącego. Następnie odpipetowałam po 10 ml każdego roztworu do oddzielnych kolb i dodałam po 10 ml wody. Tak przygotowane mieszaniny dokładnie wytrząsałam, po czym pozostawiłam do czasu rozdzielenia faz. Później oznaczałam współczynnik załamania światła dla każdego z roztworów wyjściowych oraz dla roztworów wytrząsanych po rozwarstwieniu faz (roztwór pobierałam z górnej warstwy każdego badanego roztworu).
5. Obliczenia
a) obliczam stężenie acetonu w toluenie: początkowe
, w stanie równowagi
oraz stężenie acetonu w fazie wodnej
- dla roztworu 1
,gdzie n jest współczynnikiem załamania światła
= 0,6183 mol/dm3
= 0,4260 mol/dm3
= 0,6183 - 0,4260 = 0,1923 mol/dm3
- dla roztworu 2
= 1,4644 mol/dm3
= 0,6952 mol/dm3
= 1,4644 - 0,6952 = 0,7692 mol/dm3
- dla roztworu 3
= 2,0413 mol/dm3
= 0,9548 mol/dm3
= 2,0413 - 0,9548 = 1,0865 mol/dm3
- dla roztworu 4
= 2,6567 mol/dm3
= 1,2529 mol/dm3
= 2,6567 - 1,2529 = 1,4038 mol/dm3
- dla roztworu 5
= 3,3683mol/dm3
= 1,6087 mol/dm3
= 3,3683 - 1,6087 = 1,7596 mol/dm3
Wykres zależności stężenia acetonu w toluenie (C)T od stężenia acetonu w wodzie (C)W
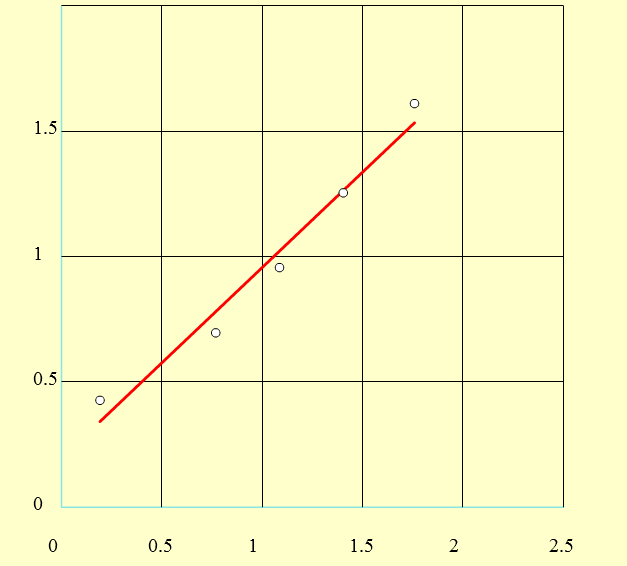
b) obliczam współczynnik kierunkowy prostej, który jest równy współczynnikowi podziału K ze wzoru:
K = 0,908
6. Wnioski
Celem ćwiczenia było oznaczenie współczynnika podziału acetonu pomiędzy toluen i wodę metodą refraktometryczną. Oznaczony współczynnik przyjmuje wartość K = 0,908.
Błędy w oznaczeniu współczynnika podziału acetonu pomiędzy toluen i wodę mogą wynikać z:
- substancje chemiczne wykorzystywane w ćwiczeniu mogły być w pewnym stopniu zanieczyszczone
- aceton mógł w niewielkim stopniu odparować, ponieważ jest bardzo lotny
- mała dokładność wykonywania eksperymentu
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 38 Patrycja, laboratorium chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ćw 36 1, laboratorium chemia fizyczna
Ćwiczenie 6 - diagram fazowy, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium, Chemia
Ćwiczenie 4 - destylacja, Technologia INZ PWR, Semestr 3, Chemia Fizyczna, Chemia fizyczna - Laborat
Ćwiczenie 9 - napiecie powieszchniowe, Technologia INZ PWR, Semestr 3, Chemia Fizyczna, Chemia fizyc
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Cwiczenie 5, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CWICZENIE9, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA, chemia fizyczna
moje cwiczenie, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
badanie równowag fazowych, Chemia fizyczna, laboratorium, Chemia fizyczna
wyznaczanie współczynników aktywności z pomiarów sem, Chemia fizyczna, laboratorium, Chemia fizyczna
wpływ ph na pęcznienie żelatyny, Chemia fizyczna, laboratorium, Chemia fizyczna
współczynnik podziału, Chemia fizyczna, laboratorium, Chemia fizyczna
więcej podobnych podstron