Rok akademicki 2004/2005
|
Chemia Fizyczna |
Data wykonania ćwiczenia:
5.04.2005 |
Kierunek studiów: Metalurgia |
Kinetyka reakcji homogeniczny |
|
Nr grupy: I |
Szczepan Tęcza Jarosław Rękas
|
Ocena:
|
Nr zespołu: XIII |
|
|
Cel ćwiczenia:
Wyznaczenie stałej szybkości i energii aktywacji reakcji hydrolizy octanu metylu.
Wykonanie pomiaru
Na początku ćwiczenia przygotowaliśmy I roztwór wyjściowy z 100 ml HCl (katalizator) i 5 ml 1M roztworu octanu metylu. Następnie dość szybko do 3 erlenmajerek z 150 ml wody destylowanej odpipetowaliśmy z I roztworu wyjśc. 5 ml tego roztworu. Każdą z tych próbek następnie z miareczkowaliśmy przy obecności fenoloftaleiny, co 5 min, zapisując wyniki zużytego NaOH w [cm3]. Roztwór ten ogrzaliśmy do wrzątku i po ochłodzeniu 4 próbkę z miareczkowaliśmy.
Podobnie zrobiliśmy dla II roztworu wyjściowego, tylko, że w temp. 40oC.
Sprawozdanie:
Zagadnienia teoretyczne:
Szybkość reakcji - zależy od stężeń substratów (które ulegają zmianom w czasie, a więc zależy również od czasu), temperatury i obecności w układzie katalizatorów reakcji.
Okres połowicznej przemiany - t 0,5 , czyli czas, po którym stężenie początkowe substratu zmniejszy się do połowy.
Teoria zderzeń mówi, iż aby zderzenie było efektywne zderzające się cząsteczki muszą mieć energię równą lub wyższą od pewnej wartości progowej, charakterystycznej dla danej reakcji , zwanej energią aktywacji reakcji chemicznej. Zderzenia takie będziemy nazywać zderzeniami aktywnymi.
Energia aktywacji - jest potrzebna do pokonania sił odpychania się chmur elektronowych cząstek substratów i takiego przeniknięcia się tych chmur, aby możliwe byłoby rozerwanie pierwotnych wiązań chemicznych i utworzenia się takich wiązań, jak w produktach reakcji.
Ln k= A - E/RT - równanie Arrheniusa
Kataliza - jt. zjawisko polegające na zmianie szybkości reakcji chemicznej pod wpływem obecności substancji zwanych katalizatorami. Katalizator przyspiesza reakcję chemiczną, a inhibitor spowalnia ją.
Tabele wyników pomiarów.
Temperatura pokojowa T1 = 293 K |
|||
T[min] |
at[cm3] |
ak-at |
K[s-1] |
0 5 10 20 |
47 47,5 48,5 51,2 |
34,5 35 34 31,3 |
- 0,000047 0,000072 0,000105 |
ak = 82,5 |
|||
Temperatura pokojowa T1 = 313 K |
|||
T[min] |
at[cm3] |
ak-at |
K[s-1] |
0 5 10 20 |
49,2 53,5 56,5 67,5 |
25,5 21,5 18,5 7,5 |
- 0,000608 0,000554 0,001030 |
ak = 75 |
|||
Opracowanie wyników pomiaru.
![]()
Na podstawie wyników miareczkowania obliczam stałe szybkości reakcji hydrolizy octanu metylu korzystając ze wzoru :
![]()
![]()
![]()
Gdzie:
k - stała szybkości reakcji [s-1]
t - czas miareczkowania [s]
t0 =0
ao -objętość roztworu miareczkującego w to [cm3]
at - objętość roztworu miareczkującego w t [cm3]
ak - objętość roztworu miareczkującego po przestygnięciu [cm3]
Obliczone stałe szybkości wpisujemy do tabel.
Następnie obliczamy średnią wartość stałej hydrolizy octanu metylu w obydwu temperaturach:
![]()
kśr (T1)= 7,5*10-5
kśr (T2)= 73,1*10-5
Poczym obliczamy błąd względny wartości k dla obliczonych wartości k
Dla T1:
Przyjmując błąd pomiaru a=0,1 cm3
![]()
gdzie c=ak -a0 , d= ak -at
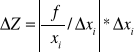
dla z= f(![]()
,![]()
,…,![]()
)
![]()
c=0,2 cm3
![]()
d=0,2cm3
![]()
t=1s
K=f(t,c,d)
![]()
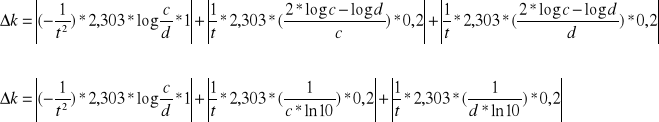
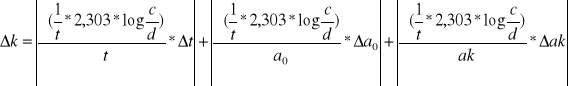
![]()
1=3,8218*10-5
![]()
2=2,0670*10-5
![]()
3=1,0225*10-5
Błędy względne:
![]()
50,9573%
![]()
27,56%
![]()
13,63%
Więc przyjmujemy:
T1 |
T2 |
||
k[s-1] |
k[%] |
k[s-1] |
k[%] |
3,8218*10-5 2,0670*10-5 1,0225*10-5 |
50,9573% 27,56% 13,63% |
5,9058*10-5 3,1987*10-5 2,9613*10-5 |
8,0790% 4,3757% 4,0510% |
Energię aktywacji obliczamy ze wzoru :
Dla : k1=7,5*10-5 , k2= 73,1*10-5 ,t1=293K, t2=313K
![]()
E = 86819,8484 J/mol
![]()
T1=1K
![]()
T2=1K
![]()
k1=![]()
![]()
k2=![]()
Obliczamy błąd względny energii aktywacji korzystając z różniczki zupełnej:
![]()
![]()
![]()
![]()
![]()
![]()
E= 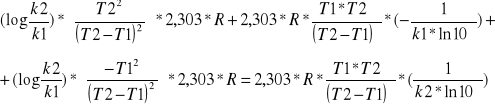
![]()
E=2.303*R* 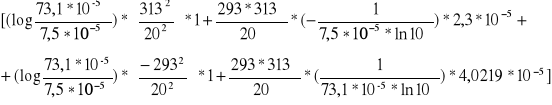
![]()
E=19,1471*[0,9888*244,9225+4585,45*(-0,1331)+0,9888*(-214,6225)+4585,45*0,0238]=9022,66
Błąd względny :
(![]()
E /E)*100%=10,3923%
![]()
![]()
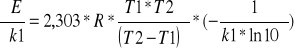
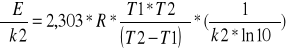
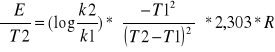
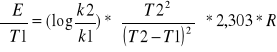
![]()
![]()
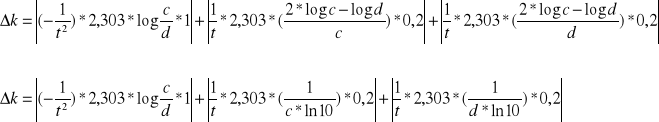
![]()
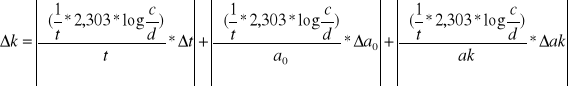
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
laboratorium3, ezoteryka, MAGIA, czarny-wilk, STUDIA ŚCISŁE
Nowoczesne powłoki Zn, ezoteryka, MAGIA, czarny-wilk, STUDIA ŚCISŁE
Czastkowe wielkosci molowe, ezoteryka, MAGIA, czarny-wilk, STUDIA ŚCISŁE
Dzordz, ezoteryka, MAGIA, czarny-wilk, STUDIA ŚCISŁE
Sprawko z lab.2, ezoteryka, MAGIA, czarny-wilk, STUDIA ŚCISŁE
Powietrze - ogień, EZOTERYKA, Magia i Ezoterka
Pierścień Atlantów, Ezoteryka, Magia i Okultyzm
MAGIA OCHRONNA, ==EZOTERYKA==, Magia
Rytual poswiecenia, ==EZOTERYKA==, Magia
Świat Astralny, Ezoteryka, Magia i Okultyzm
Ogień, EZOTERYKA, Magia i Ezoterka
Czar oczyszczajacy, ==EZOTERYKA==, Magia
Medytacja przeszłych wcieleń, ==EZOTERYKA==, Magia
Oko Horusa, Ezoteryka, Magia i Okultyzm
Znaczenie aury i jej kolorów, Ezoteryka, Magia i Okultyzm
Narzędzia magii, ==EZOTERYKA==, Magia
więcej podobnych podstron