Homeostaza - zilustruj wykresami
Homeostaza to zdolność organizmu do utrzymania stałości środowiska wewnętrznego mimo zmian zachodzących w środowisku zewnętrznym. Organizm ludzki wymienia z otoczeniem materię i energię
w sposób kontrolowany tak, aby zachować względną stałość środowiska wewnętrznego. Claude Bernard stwierdził, że zachowanie stałości środowiska wewnętrznego jest warunkiem swobodnego i niezależnego życia. Aby utrzymać stan homeostazy organizm wybiórczo reaguje na bodźce zewnętrzne - reakcja na wszystkie bodźce zewnętrzne prowadziłaby do zbyt intensywnego napływu informacji i zachwiania stanu równowagi (homeostazy).
Analiza wykresów:
Odcinek II wykresu odpowiada homeostazie (reakcje organizmu są niemalże niezależne od bodźców zewnętrznych) - organizm zdrowy. Odcinki I i III wykresu odpowiadają odwracalnemu zachwianiu homeostazy (bodźce zewnętrzne zaczynają wpływać na reakcje organizmu) - choroba organizmu. Odcinki poza wyznaczonymi polami wykresu odpowiadają nieodwracalnemu zachwianiu homeostazy - śmierć organizmu.
Obszar H wykresu odpowiada stanowi równowagi homeostazy - organizm zdrowy. Jeżeli obszar H wkroczy do obszaru S - H zostaje odwracalnie zachwiana homeostaza - choroba organizmu. Jeżeli obszar
H przekroczy granice obszaru S - H zostaje nieodwracalnie zachwiana homeostaza - śmierć organizmu.
Wyjaśnij mechanizm powstawania potencjału czynnościowego
Gdy napięcie depolaryzacyjne przekracza pewną wartość krytyczną, zwaną progową (20 - 40 mV), pojawia się potencjał czynnościowy. Bezwzględna wartość ujemnego potencjału wnętrza komórki gwałtownie spada do zera - błona ulega depolaryzacji, po czym przepolaryzowuje na znak dodatni, żeby po osiągnięciu wartości maksymalnej (ok. +40 mV) szybko spaść nawet poniżej wartości spoczynkowej i dopiero wrócić do wyjściowej. Gwałtowna zmiana potencjału przy pobudzeniu komórki nerwowej jest wynikiem szybkiego wzrostu przepuszczalności błony dla kationów, przede wszystkim sodu, a następnie podobnie szybkiego zmniejszenia tej przepuszczalności. W pierwszej fazie jony sodowe gwałtownie dyfundują do wnętrza komórki neutralizując jej potencjał ujemny, a następnie zmieniają ten potencjał na dodatni względem płynu międzykomórkowego, na skutek wytworzenia własnego potencjału dyfuzyjnego. Mniej więcej od chwili osiągnięcia maksimum potencjału dodatniego błony kom. zaczyna się zmniejszać jej przepuszczalność dla jonów Na+, natomiast wzrasta przepuszczalność dla K+. Po ustaleniu się przepuszczalności błony na poziomie normalnym potencjał spoczynkowy stabilizuje się również na poziomie - 90 mV.
Potencjał błony komórkowej, potencjał spoczynkowy
Na granicy zetknięcia roztworów elektrolitów o różnych stężeniach tworzy się różnica potencjałów elektrycznych zwana potem potencjałem dyfuzyjnym. Jest ona wynikiem różnych szybkości dyfundujących jonów dodatnich i ujemnych. Jeżeli elektrolity o różnych stężeniach przedzieli się błoną nieprzepuszczającą, błona będzie naładowana ładunkami przeciwnego znaku po obu stronach. Różnica potencjałów ΔV zwana potencjałem błonowym określa stan równowagi, któremu odpowiada określone ciśnienie osmotyczne. Wzór Nernsta:
gdzie:
R - stała gazowa równa 8,314 J·K-1 mol-1
T - temperatura wyrażona w kelwinach
z - liczba elektronów wymienianych w reakcji połówkowej
a - aktywność molowa indywiduów chemicznych biorących udział w reakcji elektrodowej
F - stała Faradaya równa 96485 C·mol-1
cutl - stężenie formy utlenionej jonu
cred - stężenie formy zredukowanej jonu
Do obliczeń potencjałów bioelektrycznych związanych z błoną komórkową stosuje się wzór Goldmana:
gdzie:
P - przepuszczalność wewnątrz/na zewnątrz dla jonów
Potencjał energetyczny wnętrza komórki jest różny od potencjału jej środowiska zewnętrznego. Można to wykazać doświadczalne za pomocą mikroelektrod, z których jedną wkłuwa się do wnętrza komórki, a drugą umieszcza na jej powierzchni. Różnica potencjałów zmierzona woltomierzem o bardzo dużym oporze wewnętrznym wynosi około 50-100 mV w zależności od rodzaju komórki. Mechanizm potencjału spoczynkowego wynika z ujemnego potencjału Donnana, różnej przepuszczalności błony dla jonów (potencjał dyfuzyjny) i aktywnego transportu jonów. Potencjał spoczynkowy jest uzależniony od jonów potasu, sodu i chloru. Ponieważ stężenia jonów sodu i potasu na zewnątrz i wewnątrz komórki są odpowiednio bliskie siebie, a jonów chloru równe, to największy wpływ wywierają jony potasu, co do których błona ma największą przepuszczalność. U podstaw zmiennej przepuszczalności błony komórkowej leżą molekularne zmiany w strukturze kanałów jonowych, które są zbudowane z białek będących strukturalnymi białkami błony.
Równowaga Donnana
Przez błony komórkowe mogą przenikać elektrolity o niskich masach cząsteczkowych, lecz błony te są nieprzepuszczalne dla elektrolitów makrocząsteczkowych. W szczególności przez błony te może przechodzić wiele soli nieorganicznych, lecz nie mogą przenikać przez nie białka. Jeżeli jony wchodzące w skład soli nie są transportowane przez błonę aktywnie, ich rozkład o obu stronach
w obecności zdysocjowanych makrocząsteczek jest określany przez warunki równowagi Donnana:
- roztwory po obu stronach błony muszą być elektrycznie obojętne
- potencjał elektrochemiczny elektrolitu przenikającego w obu przedziałach musi być jednakowy.
Błona ładuje się przy określonej różnicy potencjałów ΔV, ruch jonów zostaje wówczas zatrzymany
i ustala się stan równowagi (przy określonym stężeniu jonów po obu stronach błony). Potencjał błonowy wyraża się wzorem:
Różnica potencjału Donnana w stanie równowagi w roztworach rozcieńczonych wynosi kilka mV,
a w stężonych kilkanaście mV, a osiągnięcie równowagi oznacza śmierć komórki.
Warstwa podwójna Helmholtza
Podwójna warstwa elektryczna - w fizykochemii koloidów i elektrochemii, to określenie modelu struktury pojawiającej się na granicy dwóch faz. Podwójna warstwa elektryczna ma fundamentalne znaczenie w opisie złożonych i powszechnie spotykanych struktur materii. Jest powodem stabilności wielu układów koloidalnych, na przykład mleka. Na powierzchni ciała zanurzonego
w elektrolicie jest zaadsorbowana warstwa jonów. Ta warstwa przylega ściśle do powierzchni
i tworzy tak zwany ładunek powierzchniowy. Dalej od powierzchni jest warstwa dyfuzyjna ("rozmyta") jonów o ładunku przeciwnym do ładunku powierzchniowego. Całkowita algebraiczna suma ładunku elektrycznego jest zerowa. Nierównomierne rozmieszczenie ładunku powoduje różnicę potencjału elektrycznego na granicy międzyfazowej. Warstwa podwójna możne być także utworzona przez orientacje dipoli na powierzchni, albo poprzez dysocjację powierzchniowych grup funkcyjnych. Ciało zanurzone w elektrolicie może być ciałem stałym, kroplą cieczy lub pęcherzykiem gazu. Typowo warstwa podwójna ma grubość rzędu nanometrów i zależy od siły jonowej elektrolitu.
Uniport, Symport i Antyport
Są to rodzaje transportu aktywnego poprzez błonę komórkową.
Uniport- transport jednej substancji w jednym kierunku, np. kanał sodowy, wapniowy.
Symport - transport dwóch substancji w tę samą stronę, np. transport glukozy do wnętrza erytrocytów wraz z kationami sodu.
Antyport - transport dwóch różnych substancji w dwie przeciwne strony, np. pompa sodowo-potasowa.
Transport bierny
Ze względu na mozaikową strukturę błon biologicznych możliwy jest transport substancji małocząsteczkowych przez błony, którego siłą napędową jest gradient potencjału chemicznego (gradient stężenia). Jednakże, nawet tak małocząsteczkowe substancje jak jony przedostają się tylko przez określone miejsca błony - kanały, które mogą stanowić przeszkodę dla dyfundujących jonów. Co więcej, przeszkoda ta może się zmieniać w zależności od stanu funkcjonalnego komórki, poprzez np. zmianę ładunków elektrycznych związanych z białkiem tworzącym ścianę kanału.
Energia cząsteczek (oscylacyjna i rotacyjna)
Energia cząsteczki przedstawiona może być jako suma trzech składników:
E = Eel + Eosc + Erot
Eel - energia elektronowa - związana z poziomami energetycznymi elektronów cząsteczki, kilka eV
Eosc - energia oscylacyjna- związana z ruchami drgającymi atomów wchodzących w skład cząsteczki, dziesiętne części eV
Erot - energia rotacji cząsteczek - związana z ruchem obrotowym cząsteczki, setne części eV
• Wszystkie te energie są skwantowane
• Przejścia pomiędzy stanami kwantowymi mogą być związane z absorpcją lub emisją promieniowania.
• Obserwujemy widma elektronowe, oscylacyjne i rotacyjne.
Przy przejściu cząsteczki ze stanu E” do E' nastąpi emisja (E”>E') lub absorpcja (E”<E') kwantu energii.
Widmo absorpcji - liniowe i pasmowe.
Ciało ogrzane do wysokiej temperatury, poddane wyładowaniu elektrycznemu lub naświetleniu promieniowaniem o odpowiedniej długości fali - samorzutnie emituje promieniowanie elektromagnetyczne. Widmo spektroskopowe to zarejestrowany obraz promieniowania rozłożonego na poszczególne długości fal, częstotliwości lub energie. Jeżeli promieniowanie to zawiera się w zakresie ok. 380 - 780 nm, wtedy obserwujemy je w postaci światła widzialnego
i możemy je badać za pomocą spektrometru optycznego. Widmo promieniowania wysyłanego przez ciało nazywamy widmem emisyjnym. Ciała stałe podgrzane do wysokiej temperatury wysyłają fale elektromagnetyczne o rożnych długościach, czyli emitują widmo ciągłe.
Rys. 1a. Widmo ciągłe
Jeżeli świecący gaz składa się z oddzielnych, nieoddziałujących ze sobą atomów, to jego widmo nazywamy atomowym lub liniowym (składającym się z oddzielnych linii).
Rys.1b. Liniowe widmo emisyjne wodoru
Jeżeli ciało jest gazem składającym się z wieloatomowych cząsteczek lub cieczą to jego widmo jest widmem pasmowym.
Przepuszczając przez badane ciało promieniowanie o widmie ciągłym otrzymujemy widmo absorpcyjne, w którym obserwujemy ciemne linie odpowiadające długościom fal promieniowania pochłoniętego przez to ciało.
Rys.1b. Widmo absorpcyjne wodoru
Widmo atomu wodoru w obszarze widzialnym przedstawione na Rys. 1b, po raz pierwszy zostało zaobserwowane przez Balmera w 1885 roku. Wszystkie obserwowane linie tworzą tzw. serię Balmera a długości fal zgodne są ze wzorem:
gdzie R jest stałą wyznaczoną doświadczalnie, tzw. stałą Rydberga,. R = 10967758 [m-1].
Wkrótce odkryto następne serie. Wszystkie serie występujące w widmie atomu wodoru można zapisać za pomocą wzoru:
Typy przejść elektronowych i reguły rządzące (schemat Jabłońskiego).
Diagram Jabłońskiego stanowi schematyczne przedstawienie energii stanów elektronowych cząsteczki oraz poziomów oscylacyjnych w każdym z tych stanów (Rys. 4.). Poziomy oscylacyjne danego stanu elektronowego przedstawione są w postaci „drabinki”, leżą jeden nad drugim, jednak względne położenia „szczebli” nie są związane z odległościami międzyjądrowymi
w poszczególnych stanach i nie odpowiadają rzeczywistym odległościom poziomów energetycznych, wynikającym z krzywej energii potencjalnej cząsteczki. Pionowe usytuowanie oscylacyjnych stanów podstawowych każdego stanu elektronowego jest prawidłowe, ale pozostałe stany oscylacyjne zostały ukazane tylko schematycznie. Atomy i cząsteczki, a zwłaszcza cząsteczki wieloatomowe, po zaabsorbowaniu kwantu promieniowania i przejściu w stan wzbudzony, nie trwają w nim zbyt długo, a nadmiar uzyskanej energii emitują w postaci kwantów światła lub przekazują do otoczenia w sposób bez promienisty. Przechodzą przez poszczególne stadia
i powracają do stany wyjściowego, czyli podstawowego. Wszelkie mechanizmy procesów fotofizycznych zachodzących w cząsteczkach można wygodnie analizować na podstawie diagramu poziomów energetycznych, takich jak diagram Jabłońskiego. Pokazuje on rozmaite przejścia pomiędzy stanami energetycznymi cząsteczki z podstawowego stanu singletowego S0. Strzałki proste reprezentują elektronowe przejścia promieniste, poziomymi strzałkami falowanymi przedstawione są przejście bez promieniste, natomiast pionowymi procesy relaksacji oscylacyjnej, czyli utraty nadmiaru energii oscylacyjnej w danym stanie elektronowym. Charakterystyczną cechą diagramu Jabłońskiego jest obecność metastabilnego poziomu tripletowego T1, który zostaje obsadzony w cząsteczce przez bez promieniste przejścia elektronów z poziomu S1. Promieniste przejścia elektronowe z poziomu T1 do S1 powodowane są emisją promieniowania fosforescencyjnego, o większej długości fali niż promieniowanie fluorescencyjne emitowane przy przejściu z poziomu S1do S0 .
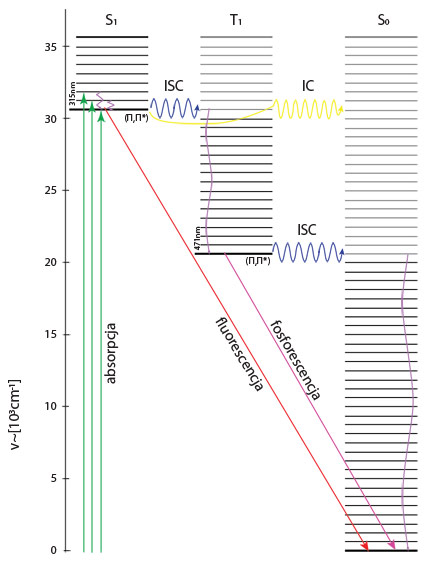
Diagram Jabłońskiego
Istota fluorescencji i fosforescencji (przykłady zastosowania sond fluorescencyjnych w biologii i medycynie).
Cząsteczka wzbudzona traci część energii jako ciepło
Emitowane promieniowanie ma niższą energię i jest przesunięte w kierunku fal dłuższych
Wykładniczy zanik fluorescencji a natężenie światła fluorescencji po czasie t od chwili przerwania wzbudzenia to:
Rozpatrzymy teraz inne ciekawe zjawisko wynikające z teorii kwantowej. Spotykamy się z nim dość często w naszym codziennym życiu. Być może masz zegarek, którego cyferblat w ciemnym pomieszczeniu świeci się. Efekt ten nazywa się fosforescencją. Naukowcy obserwowali ten efekt na długo przed powstaniem kwantowego modelu atomu, jednak to właśnie dopiero ten model pozwolił wyjaśnić zjawisko fosforescencji. Najpierw jednak zajmiemy się innym podobnym efektem - fluorescencją.
Jak już wiesz atom może zaabsorbować kwant energii przechodząc do stanu wzbudzonego. Elektron takiego atomu przechodzi na wyższy poziom energetyczny. Wzbudzony atom może wyemitować kwant energii, czemu towarzyszy przejście elektronu z powrotem
z poziomu wyższego na niższy. Jeżeli na przykład atomy jakiejś substancji oświetlimy światłem ultrafioletowym, to elektrony tych atomów znajdą się w stosunkowo wysokich stanach energetyczne. (światło ultrafioletowe to fale elektromagnetyczne o nieco większych częstotliwościach od widzialnego światła fioletowego,
a więc jego fotony przenoszą większą energię od fotonów światła widzialnego). Po krótkiej chwili elektrony powinny powrócić na pierwotny poziom emitując foton
o odpowiedniej energii. Jednak elektrony atomów niektórych pierwiastków nie przeskakują bezpośrednio na poziom najniższy. Przeskakują najpierw na jakąś pośrednią orbitę i z niej dopiero na najniższą. Emitowane są więc dwa fotony, każdy o energii mniejszej od energii jednego fotonu promieniowania ultrafioletowego zaabsorbowanego na początku. Fotony te odpowiadają więc falom elektromagnetycznym o niższej częstotliwości, a więc mogą one być fotonami światła widzialnego. Podsumujmy. Jeżeli oświetlimy atomy niektórych substancji światłem ultrafioletowym (niewidocznym dla ludzkiego oka), to zaczynają one emitować światło widzialne. Zjawisko to nazywamy fluorescencją.
Podobnym efektem jest efekt fosforescencji. Różnica polega na tym, iż elektrony nie przeskakują natychmiast do stanu niższego, lecz przez jakiś czas mogą pozostawać w stanie wzbudzonym. Czas pozostawania elektronu w stanie wzbudzonym nie jest ściśle określony, lecz dany pewnym prawdopodobieństwem. Jeżeli mamy próbkę zawierającą dużo atomów takiej substancji (na przykład cyferblat zegarka), to poszczególne z nich emitują fotony po upływie różnego czasu od momentu wzbudzenia. I tak niektóre atomy znajdą się ponownie w stanie podstawowym zaraz po wzbudzeniu, a inne dopiero po upływie kilku, kilkunastu minut bądź nawet kilku dniach. Jeżeli usuniemy źródło wzbudzające atomy (na przykład umieścimy próbkę w zaciemnionym pokoju) to będzie ona emitowała światło jeszcze przez jakiś czas, aż do momentu, gdy wszystkie jej atomy znajdą się w stanie podstawowym (oczywiście od pewnej chwili światło to będzie miało zbyt małą jasność abyśmy mogli je obserwować). Na tej właśnie zasadzie działa cyferblat samoczynnie świecącego w ciemności zegarka. Tak więc zjawisko fluorescencji i fosforescencji różnią się jedynie czasem trwania.
Innym wykorzystaniem fluorescencji są używane do oświetlania pomieszczeń świetlówki. Świetlówka składa się ze szczelnej rury wypełnionej atomami pewnego gazu. W rurze poruszają się z dużymi prędkościami elektrony przyśpieszane przyłożonym do niej napięciem. Elektrony zderzają się z atomami gazu wzbudzając je. Wzbudzone atomy emitują fotony światła ultrafioletowego. Rurę okrywa specjalna powłoka wykonana z materiału, który pod wpływem światła UV (ultrafioletowego) zaczyna emitować światło widzialne.
Przenoszenie informacji
Przenoszenie informacji odbywa sie w różnych układach - w telegrafii, w radiofonii, układzie nerwowym itd. Na drodze od źródła informacji do adresata sygnał przechodzi przez różne części układu, co schematycznie przedstawiono na poniższym rysunku:
W czasie funkcjonowania linii przekaźnikowej mogą tez o sobie dąć żnąc szumy informacyjne, zakłócające przekaz informacji. Jeśli informacja jest przekazywana tak jak na powyższym rysunku
w jedna stronę, bez odpowiedzi - mówimy o jednokierunkowym przenoszeniu informacji. Jeśli jednak odbiorca stanie sie nadawca odpowiedzi - sytuacja ulega zmianie i wtedy mamy
do czynienia z dwukierunkowym przeniesieniem informacji. W teorii informacji spotykamy sie
z ważnym pojęciem, jakim jest sprzężenie zwrotne, angielski feedback. Sprzężeniem zwrotnym nazywamy takie oddziaływanie sygnałów stanu końcowego (wyjściowego) procesu (systemu, układu), na jego sygnały referencyjne (wejściowe), które ma za zadanie otrzymywanie przez układ (proces, system) informacji o własnym działaniu (o wartości wyjściowej). Matematycznym, jednoznacznym opisem bloku gałęzi zwrotnej jest transmitancja. Informacja ta jest modyfikowana przez transmitancje bloku gałęzi zwrotnej lub tez nie (w szczególnym, idealnym przypadku). Wyróżnia sie sprzężenie zwrotne dodatnie, DSZ - gdy sygnał z gałęzi zwrotnej dodaje sie
do wartości referencyjnej w węźle sumacyjnym oraz sprzężenie zwrotne ujemne, USZ - gdy sygnał z gałęzi zwrotnej odejmuje sie w węźle sumacyjnym od wartości referencyjnej.
Sprzężenie zwrotne ujemne stanowi fundamentalny mechanizm samoregulacyjny.
Z cybernetycznego punktu widzenia ma ono za zadanie utrzymanie wartości jakiegoś parametru na zadanym poziomie. Zachodzi ono wtedy, gdy jakiekolwiek zaburzenia powodujące odchylenie wartości parametru od zadanej wartości w którakolwiek stronę indukują działania prowadzące do zmiany wartości parametru w stronę przeciwna (stad nazwa "ujemne"), a wiec do niwelacji (kompensacji) efektu tego odchylenia. Mówiąc obrazowo: wartość parametru sprzężonego ujemnie zachowuje sie jak niewielka kulka na dnie półkulistego zagłębienia: każde wytracenie jej
z równowagi powoduje powtórne staczanie sie w kierunku najniższego punktu, pośrodku zagłębienia. W przypadku sprzężenia zwrotnego ujemnego wartość parametru oscyluje wiec wokół wartości zadanej. Sprzężenie zwrotne dodatnie polega na tym, ze w sytuacji zakłócenia jakiegoś parametru w układzie, układ ten dąży do zmiany wartości parametru w kierunku zgodnym
(stąd - "dodatnie") z kierunkiem, w którym nastąpiło odchylenie od "zadanej" wartości. Sprzężenie zwrotne dodatnie powoduje zatem narastanie odchylenia. Mówiąc obrazowo: wartość parametru sprzężonego dodatnio zachowuje sie jak niewielka kulka na szczycie półkulistego wzniesienia: każde wytracenie jej z równowagi powoduje coraz szybsze staczanie sie w kierunku, w którym nastąpiło wytracenie, Az do wypadnięcia kulki poza układ (o ile nie zadziała odrębny bodziec hamujący). W sprzężeniu zwrotnym dodatnim wartość parametru odchyla sie wiec od wartości "zadanej" tym szybciej, im dalej juz sie od niej znajduje. Schemat blokowy układu samoczynnie sie regulującego:
Przykładowy schemat blokowy układu termoregulacji:
Przekazywanie informacji (przy użyciu sygnałów, za pomocą określonego kodu) prowadzi do powstawania sprzężeń miedzy źródłem informacji a odbiornikiem wzdłuż drogi nazywanej kanałem łączności. Prędkość przesyłania informacji:
S (x) - entropia bezwarunkowa źródła (przed wysłaniem informacji)
S (x/y) - entropia warunkowa źródła (to co pozostało w źródle po wysłaniu informacji)
Przykłady prędkości przesyłania informacji:
Czytania - 45 bitów/s
Pisanie - 16 bitów/s
Wyliczanie - 3 bity/s
Sterowanie a regulacja
Sterowanie:
Dwa układy sa ze sobą połączone jednokierunkowo. Nie ma powiązania miedzy układem
sterowanym a sterującym. Jest to układ otwarty - skutek działania nie ma wpływu na
przyczynę. Nie ma możliwości modyfikowania informacji pod wpływem układu sterowanego.
Regulacja:
Istnieje powiązanie miedzy układem regulującym i układem regulowanym. Jest to układ
zamknięty, w którym istnieje zależność miedzy wejściem i wyjściem układu (zależność
miedzy parametrem, który wchodzi a parametrem, który wychodzi). Powiązanie to nazywamy
sprzężeniem zwrotnym.
Sprzężenie zwrotne:
a) dodatnie - gdy sygnał wychodzący z układu regulowanego ulega wzmocnieniu. Następują
reakcje kaskadowe. Przykłady: rozpad pierwiastków promieniotwórczych, kaskada krzepnięcia
krwi.
b) ujemne - stabilizuje układ, sprzyja powrotowi do stanu równowagi. Przykład: regulacja
stężenia glukozy we krwi.
Transport aktywny
Transport substancji wymaga zadziałania bodźców termodynamicznych. Jeśli transport
odbywa sie zgodnie z istniejącymi bodźcami bez nakładu energii zostaje on sklasyfikowany
jako transport bierny. W jego wyniku entropia układu rośnie - zanika bodziec
termodynamiczny, co w rezultacie prowadzi do śmierci komórki, Musza zatem istnieć
sposoby podtrzymania bodźców , to znaczy sposoby transportu substancji w kierunku
przeciwnym nisz kierunek narzucony przez istniejące bodźce. Procesy takie wymagają
nakładów energetycznych i pośrednictwa wyspecjalizowanych struktur cząsteczkowych -
białek transportujących. Proces transportu wbrew istniejącym bodźcom nazywamy
transportem aktywnym. Jeśli źródłem energii niezbędnej dla transportu jest hydroliza ATP,
transport aktywny klasyfikowany jest jako transport aktywny pierwszego rodzaju. Jeśli
natomiast do aktywnego transportu wykorzystywany jako nośnik zostanie strumień jonów
biernie transportowanych to transport taki sklasyfikowany jest jako transport aktywny
drugiego rodzaju.
System transportu aktywnego wymaga zaangażowania nośników - białek transportujacych
wykazujących specyficzność w stosunku do określonych substancji. Związanie przez białko
przenoszące transportowanej substancji powoduje zmianę konformacji nośnika w taki sposób,
Se początkowo wiążące miejsce na nośniku znajduje sie po jednej stronie błony, a następnie
po zmianie konformacji po jej drugiej stronie. Ponadto, powinowactwo chemiczne miejsca
wiążącego na nośniku dla wiązanej substancji jest inne, gdy miejsce to ma kontakt ze
środowiskiem wewnątrzkomórkowym i inne gdy ma ono ze środowiskiem
zewnątrzkomórkowym. Kierunek transportu aktywnego odbywa sie z obszaru gdzie
powinowactwo chemiczne nośnika do przenoszonej molekuły jest wyższe do obszaru, gdzie
jest ono niższe. Rola energii w tym procesie jest utrzymywanie różnicy powinowactwa
chemicznego nośnika po obu stronach błony.
np. pompa sodowo potasowa ( transport I rodzaju)
Opracowanie bloku V
11
Wyszukiwarka
Podobne podstrony:
8377
8377
8377
8377
8377
8377
LC7232 8377
więcej podobnych podstron