I Pracownia Zakładu Fizyki PL
Nazwisko Staniszewski Paweł i imię |
Wydział ZiM 3,5 Grupa |
|||||||
Data 07,12,98 wyk. ćwicz |
Numer ćwicz 7.1 |
Temat Wyznaczanie równoważników elektrochemicznych, ćwiczenia metali stałej Faraday`a i ładunku elementarnego. |
||||||
Zaliczenie
|
Ocena |
Data |
Podpis
|
|||||
Zestawienie wyników:
J = 1A
t = 1800s
m1 = 0,2886 kg
m2 = 0,2892 kg
Podstawy teoretyczne:
W wodnym roztworze siarczanu miedzi, pod wpływem wody cząsteczki CuSO4 rozpada się na jony Cu2+ i SO42-. Pole elektryczne wytworzone między katodą i anodą powoduje wędrówkę jonów do odpowiednich elektrod. Kationy Cu2+ dążą do katody, gdzie ulegają zobojętnieniu i osadzają się w postaci cienkiej warstwy miedzi. zachodzi wtedy reakcja:
Cu+2 + 2e → Cu
Równocześnie aniony SO2-4 dążą do anody. Reszty kwasowe i grupy wodorotlenkowe nie występują w stanie wolnym, reagują więc z materiałem anody lub też cząsteczkami rozpuszczalnika.
Jeśli jednym ze składników materiału anody będzie miedź, wówczas zajdzie reakcja:
SO2-4 + Cu → CuSO4 + 2e
Utworzona w ten sposób cząsteczka CuSO4 przechodzi do roztworu i ulega znowu dysocjacji. W ten sposób roztwór siarczanu miedzi regeneruje się, na skutek czego stężenie roztworu, mimo osiadania jonów na elektrodach, nie ulega zmianie.
Równoważnik chemiczny wyliczamy z I prawa Faraday`a i jest równy liczbowo masie substancji wydzielonej w procesie elektrolizy na jednej z elektrod podczas przepływu ładunku jednostkowego (q).
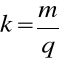
Ładunek (q), można wyrazić przez natężenie prądu i czas trwania elektrolizy (q= i * t) , a więc ostatecznie wzór na równoważnik chemiczny ma postać:
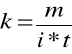
Stała Faraday`a ma postać:
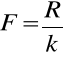
gdzie równoważnik chemiczny (R) jest równy ilorazowi masy atomowej (A)przez wartościowość (Z)
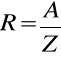
Natomiast wartość ładunku elementarnego jest ilorazem stałej Faraday`a (F) przez liczbę Avogadra (NA)
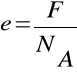
Wykonanie ćwiczeni:
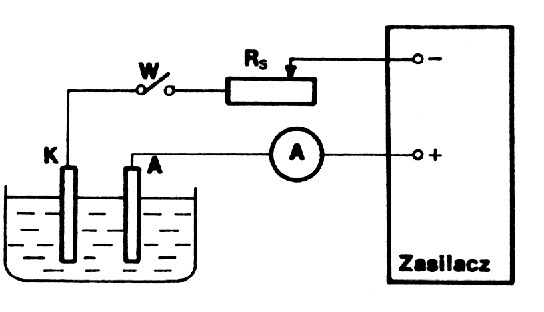
Schemat połączeń przedstawia rysunek.
Elektrody oczyszczamy odpowiednio papierem ściernym, spłukujemy wodą destylowaną i osuszamy. Następnie do woltametru wstawiamy katodę próbną , wlewamy elektrolit, włączamy wyłącznik W
i opornikiem RS regulujemy natężenie prądu w obwodzie. Wartość natężenia ustalamy na 1A. Po tych czynnościach wstępnych ważymy elektrodę pomiarową (m1) i wstawiamy w miejsce elektrody próbnej. Zamykamy obwód włącznikiem W, włączając jednocześnie sekundomierz. Czas trwania elektrolizy 30min (1800s). Po zakończeniu elektrolizy, katodę opłukujemy wodą zakwaszoną kwasem siarkowym, osuszamy i ponownie ważymy (m2).
Opracowanie wyników:
Równoważnik chemiczny wyliczamy ze wzoru:
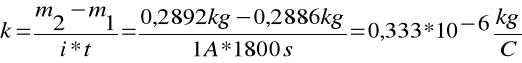
Stałą Faraday`a :
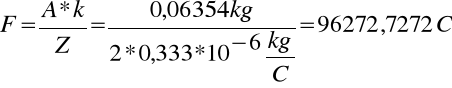
a ładunek elementarny wynosi:
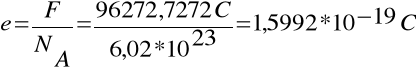
Dyskusja błędu metodą różniczkową:
Błąd względny maksymalny wyliczamy logarytmując, a następnie różniczkując równanie 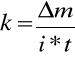
, gdzie ∆m = m2 - m1
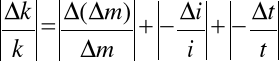
gdzie
∆(∆m) = 2*10-5kg
∆m = 0,0006 kg
∆i = (1 * 1,5)A/100 +1,5/75 = 0,015A + 0,02A = 0,035A
∆t = 3 * 0,2s = 0,6s
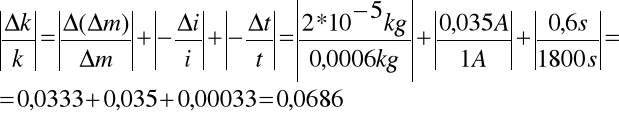
Błąd względny maksymalny wynosi:
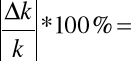
6,86%
Wnioski:
Ćwiczenie nie nastręcza wiele kłopotów w czasie jego wykonania. Duży wpływ na błąd ma niedokładność wagi technicznej ,na której ważono elektrodę, oraz błąd wskazania amperomierza.
4
3
Wyszukiwarka
Podobne podstrony:
6257
6257
6257
6257
6257
6257
6257
6257
6257
6257
6257 1989
więcej podobnych podstron