Elektrodializa w przemyśle i ochronie środowiska
Marian TUREK
Politechnika Śląska, Wydział Chemiczny, 44-100 Gliwice, ul. B. Krzywoustego 6
Streszczenie: Elektrodializa jest techniką membranową, w której przepływające roztwory oddzielone są membranami jononowymiennymi. Po przyłożeniu pola elektrycznego, prostopadłego do kierunku przepływu roztworów, kationy migrują w stronę katody, przenikając przez membrany kationowymienne; zatrzymywane są natomiast na membranach anionowymiennych. Aniony zaś migrują w stronę anody, przechodząc przez membrany anionowymienne. Naprzemienne ułożenie membran kationo- i anionowymiennych pozwala na jednoczesne usuwanie substancji jonowych z jednego roztworu (diluatu) i ich zatężanie w sąsiednim (koncentracie). Omówiono zasadę elektrodializy, podstawowe wskaźniki określające jej efektywność, ograniczenia, możliwości rozwoju i przykłady zastosowania.
Słowa kluczowe: elektrodializa, membrany jonowymienne, selektywność, wydajność prądowa
Elektrodializa stanowi membranową technikę rozdziału składników roztworów ciekłych, w której wykorzystuje się transport jonów przez membrany zachodzący pod wpływem zewnętrznego pola elektrycznego. Przez membranę łatwo przenikają jony elektrolitów, natomiast cząstki koloidalne o większych rozmiarach zatrzymywane są na powierzchni membran. W wyniku przepływu prądu elektrycznego następuje zróżnicowanie składów roztworów w komorach elektrodializera. Przenoszenie elektrolitu zachodzi przy tym od roztworu rozcieńczanego do zatężanego.
W elektrodializie konwencjonalnej stosowany jest wielokomorowy moduł (elektrodializer, stos membranowy) zawierający ułożone naprzemian membrany aniono- i kationowymienne, rozdzielone przekładkami dystansującymi, oraz jedną parę elektrod. Zasadę elektrodializy, na przykładzie odsalania roztworu chlorku sodu, przedstawiono na rys. 1.
Rys. 1. Zasada elektrodializy; MK - membrana kationowymienna, MA - membrana anionowymienna
Efektywność odsalania i zatężania wodnych roztworów soli nieorganicznych, najważniejszego z zastosowań elektrodializy, określana jest kilkoma wskaźnikami: selektywnością procesu, wydajnością prądową i kosztami jednostkowymi. Selektywność elektrodializy determinowana jest głównie przez właściwości stosowanych membran jonowymiennych. Ilościową miarą selektywności membrany, S, jest liczba przenoszenia przeciwjonu, czyli jonu o znaku przeciwnym do znaku jonogennych grup funkcyjnych obecnych w polimerowej matrycy membrany jonowymiennej []:
![]()
![]()
lub
![]()
gdzie: ![]()
- pozorna liczba przenoszenia przeciwjonu w membranie, ![]()
- liczba przenoszenia przeciwjonu w roztworze.
Pozorna liczba przenoszenia, ![]()
, oznacza udział przeciwjonów w przenoszeniu ładunku przez membranę w odniesieniu do wody przenoszonej elektroosmotycznie. Jej wartość jest mniejsza niż rzeczywista liczba przenoszenia przeciwjonów, kiedy układem odniesienia jest membrana, daje jednak bardziej miarodajną ocenę selektywności membrany w zastosowaniach praktycznych. Pozorną liczbę przenoszenia wyznacza się zwykle na podstawie pomiarów siły elektromotorycznej stężeniowego ogniwa membranowego w warunkach izotermiczno-izobarycznych [1].
Membrana jonowymienna składa się z sieci polimerowej ze związanymi z nią grupami jonowymi (jony stałe). Dodatnie bądź ujemne grupy jonowe membrany neutralizowane są przez ruchliwe jony obecne w roztworze, zwane przeciwjonami []. W membranach kationowymiennych grupami unieruchomionymi w matrycy są najczęściej grupy sulfonowe, -SO3H, o właściwościach silnie kwaśnych lub grupy karboksylowe, -COOH, o właściwościach słabo kwaśnych. W membranach anionowymiennych grupy jonowymienne stanowią silnie zasadowe IV-rzędowe grupy amoniowe; grupy aminowe niższej rzędowości nadają membranom właściwości słabo zasadowe. Grupy zasadowe są z natury słabiej związane z matrycą i dlatego membrany anionowymienne są mniej stabilne od membran kationowymiennych [].
Po zanurzeniu membrany w roztworze elektrolitu przyjmuje ona odpowiednio: ujemny ładunek w przypadku membran kationowymiennych i dodatni w przypadku membran anionowymiennych. Przykładowe dane dostępnych na rynku membran jonowymiennych przedstawiono w tabeli 1.
Tabela 1. Charakterystyka membran jonowymiennych NEOSEPTA [,]
Typ membrany |
CMX |
CMS |
AMX |
ACS |
|
silnie kwaśna kationowymienna |
silnie kwaśna kationowymienna |
silnie zasadowa anionowymienna |
silnie zasadowa anionowymienna |
|
standardowa |
selektywna dla kationów jednododatnich forma Na+ |
standardowa |
selektywna dla anionów jednoujemnych forma Cl- |
Grubość, mm |
0,14 -0,20 |
0,14 - 0,17 |
0,12 - 0,18 |
0,12 - 0,20 |
Oporność1, |
2,0 - 3,5 |
1,5 - 3,5 |
2,0 - 3,5 |
3,0 - 6,0 |
|
0,70 |
> 0,90 |
< 0,02 |
< 0,02 |
|
0,28 |
> 0,10 |
< 0,02 |
< 0,02 |
|
< 0,02 |
< 0,02 |
> 0,98 |
> 0,98 |
|
< 0,02 |
<0,02 |
> 0,98 |
< 0,005 |
Siła rozerwania MPa/cm2 |
0,35 |
0,13 |
0,30 |
0,20 |
Zawartość wody g H2O/g suchej membrany |
0,25 - 0,35 |
0,35 - 0,45 |
0,25 - 0,30 |
0,20 - 0,30 |
1 opór elektryczny mierzony w 0,5 M NaCl
W przypadku separacji składników mieszanin ważna jest efektywność membrany w różnicowaniu ich strumieni przez membranę. W szczególnym przypadku membran, tzw. monojonoselektywnych, liczba przenoszenia kationu dwudodatniego jest znacznie mniejsza niż jednododatniego (podobnie w przypadku anionów). Membrany takie stosowane są głównie do elektrodialitycznego zatężania wodnych roztworów zasolonych, np. wody morskiej, w celu otrzymania solanki o zmniejszonym, w stosunku do chlorku sodu, stężeniu jonów wapnia i magnezu oraz siarczanu. W praktyce stwierdza się jednak, że strumień kationów wapnia i magnezu, w stosunku do strumienia sodu, jest większy niż spodziewany na podstawie danych producenta membran, dotyczących liczb przenoszenia. Zachowanie kationów wapnia i magnezu można tłumaczyć konwekcyjnym przenoszeniem przez membranę, wywołanym przez strumień kationów sodu. Wartość strumienia konwekcyjnego można określić posługując się rozszerzonym równaniem Nernsta-Plancka []:
![]()
gdzie: Ji - strumień jonu “i”, Di,p - wsp. dyfuzji jonu “i” w membranie, Ci - stężenie jonu “i”, x - wymiar równoległy do kierunku przepływu, Ki,c - konwekcyjny współczynnik sprzężenia, ψ - potencjał elektryczny, zi - wartościowość jonu, F - stała Faradaya, R - stała gazowa, T - temperatura, Jj strumień jonu „j”.
W przypadku odsalania roztworów wodnych w celu otrzymania wody spożywczej czy też półproduktu do dalszej, głębokiej demineralizacji, celowa jest praca instalacji elektrodializy przy możliwie dużej wartości gęstości prądu, aby zmniejszyć udział kosztów inwestycyjnych, proporcjonalnych do powierzchni zainstalowanych membran, gdyż one są, w tym przypadku, głównym składnikiem kosztów jednostkowych.
Ponieważ liczba przenoszenia jonów w membranie jest większa niż w roztworze prowadzi to do spadku stężenia przeciwjonów w warstwie granicznej (ang. boundary layer) na powierzchni membrany po stronie diluatu i wzrost stężenia jonów na powierzchni membrany po stronie koncentratu. Zjawisko to zwane jest polaryzacją stężeniową. Rozkład stężenia elektrolitu przy membranie jonowymiennej w procesie elektrodializy przedstawiono na rys. 1.
Rys. 2. Rozkład stężenia elektrolitu przy membranie jonowymiennej w procesie elektrodializy
Ze wzrostem gęstości prądu stężenie przy powierzchni membrany, ![]()
, maleje, zapewniając wzrost gradientu stężenia a tym samym zwiększenie udziału transportu dyfuzyjnego w całkowitym przenoszenia jonów. Gęstość prądu, i, określona jest równaniem []:
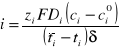
gdzie: zi- wartościowość jonu „i”, F - stała Faradaya, ci - stężenie jonu „i” w roztworze, δ - grubość warstwy polaryzacyjnej.
Gdy stężenie przy powierzchni membrany osiągnie wartość zero, dalszy wzrost gradientu stężenia staje się niemożliwy. Transport dyfuzyjny staje się czynnikiem limitującym, a gęstość prądu osiąga swą wartość graniczną, ![]()
:
![]()
Przekroczenie wartości granicznej gęstości prądu prowadzi do niedoboru jonów w najbliższym sąsiedztwie membrany, a transport dyfuzyjny staje się niewystarczający by zapewnić dostarczanie jonów do powierzchni membrany, wskutek czego zostaje osiągnięty potencjał rozkładu wody i tworzące się jony H3O+ i OH- zaczynają brać udział w przenoszeniu prądu elektrycznego. Konieczna jest więc praca instalacji elektrodializy przy gęstości prądu wyraźnie mniejszej od jej wartości granicznej (zazwyczaj 70-80% jej wartości []). Zjawiska polaryzacji stężeniowej nie można uniknąć; można natomiast łagodzić jej skutki poprzez zastosowanie przekładki dystansującej zapewniającej dobrą wymianę masy.
Wydajność prądowa, Wp, określa, jaka część prądu przepływającego przez elektrodializer wykorzystana jest do transportu jonów z diluatu do koncentratu. Definiowana jest, jako stosunek liczby moli substancji, która została przetransportowana z roztworu odsalanego przez membranę jonowymienną (nexp), do liczby moli (nteor) obliczonej z prawa Faradaya.
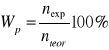
Uwzględniając liczbę par membran elektrodializera, otrzymujemy:
![]()
gdzie: x - liczba par membran elektrodializera, I - natężenie prądu, Δt - czas szarży.
Teoretyczna wartość wydajności prądowej równa jest selektywności membran, określonej liczbą przenoszenia. W praktyce, ze względu na występowanie zjawisk ubocznych, głównie tzw. dyfuzji wstecznej, jej wartość jest mniejsza [3].
Podczas wykładu omówione zostaną następujące kwestie:
1. Klasyczna elektrodializa i przykłady jej stosowania do odsalania wód słonawych, oraz usuwania jonów metali ciężkich ze ścieków przemysłowych, a także badania nad wykorzystaniem elektrodializy do utylizacji retentatu z instalacji osmozy odwróconej, na przykład do produkcji solanki dla potrzeb przemysłu chloro-alkalicznego.
2. Ograniczenia oraz problemy elektrodializy: wzrost oporu elektrycznego w miarę odsalania diluatu, zjawisko polaryzacji stężeniowej, graniczna gęstość prądu oraz problem blokowania membran jonowymiennych, w tym osadami substancji nieorganicznych, a także sposoby ograniczenia tych zjawisk.
3. Elektrodializa odwracalna, w której co pewien czas następuje zmiana polaryzacji elektrod, powodująca oderwanie narosłej na powierzchni membrany warstwy osadu i przywrócenie właściwości „świeżej” membrany.
4. Elektrodializa z zastosowaniem membran bipolarnych stosowana, m.in., do produkcji kwasów i zasad z soli oraz odzysk kwasów przy pomocy elektro-elektrodializy.
5. Elektrodejonizacja - modyfikacja elektrodializy, w której komory elektrodializera wypełnione są żywicą jonowymienną regenerowaną in situ przez powstające z rozkładu wody jony hydroksylowe i oksoniowe; jej wciąż rosnące znaczenie w produkcji wody ultra-czystej na potrzeby laboratoryjne oraz przemysłowe.
6. Elektrodializa odwrotna - metoda wytwarzania energii elektrycznej, wykorzystująca entalpię mieszania roztworów o różnym zasoleniu w ogniwie stężeniowym z przenoszeniem.
7. Pokrewna elektrodializie metoda odsalania - “membrane capacitive deionization”.
8. Przykłady zastosowań elektrodializy w systemach zintegrowanych.
9. Możliwości poprawy efektywności i poszerzenia zakresu praktycznego stosowania elektrodializy.
LITERATURA
[]. Koter S., Wyznaczanie selektywności membran jonowymiennych metodą potencjometryczną, w: Podręcznik do ćwiczeń laboratoryjnych pod redakcją A. Narębskiej, Membrany i membranowe techniki rozdziału, Wyd. UMK, Toruń 1996.
[]. Narębska A. (Red.) Membrany i Membranowe Techniki Rozdziału, Wydawnictwo UMK, Toruń 1997, ISBN 83-231-0937-0.
[]. Selecki A., Gawroński R., Podstawy projektowania wybranych procesów rozdzielania mieszanin, WNT, Warszawa 1992.
[]. www.astom-corp.jp/en/en-main2-neosepta.html (02.04.2012).
[]. NEOSEPTA Ion-Exchange Membranes, prospekt firmy Tokuyama Corp.
[]. Strathmann H., Ion-exchange membrane separation processes, Membrane Science and Technology Series 9, Elsevier 2004.
[]. Krol J.J., Wessling M., Strathmann H., Concentration polarization with monopolar ion-exchange membranes: current-voltage curves, and water dissociation, J. Membr. Sci., 162 (1999) 145-154
[]. Meller F. H., Electrodialysis & electrodialysis reversal (EDR) technology, Ionics Incorporated, 1984
Wyszukiwarka
Podobne podstrony:
CHEMIA FIZYCZNA- Elektrochemia sc, Ochrona Środowiska pliki uczelniane, Chemia
Baszczuk,ekologia w produkcji przemysłowej, ochrona środowiska w prawie międzynarodowym
Baszczuk,ekologia w produkcji przemysłowej, ochrona środowiska w prawie międzynarodowym
AK autoref, Praca magisterska, membrany
Charakterystyka cyklu życia energii elektrycznej pozyskiwanej z gazu pf, Ochrona Środowiska pliki uc
Charakterystyka cyklu życia energii elektrycznej pozyskiwanej z gazu, Ochrona Środowiska pliki uczel
karta przekazania odpadu WZÓR, Ochrona środowiska, ekologia przemyslowa, GR 7 c, Filtry olejowe 16
KARTA EWIDENCJI ODPADU ODPADU, Ochrona środowiska, ekologia przemyslowa, GR 7 c, Filtry olejowe 16 0
KARTA EWIDENCJI ODPADU TEKTURA 08, Ochrona środowiska, ekologia przemyslowa, GR 7 c, Odpad tektura p
Oczyszczanie sciekow przemyslowych na wybranym przykladzie, ochrona środowiska UTP bydgoszcz
Zaliczanie ptp, Ochrona Środowiska pliki uczelniane, Podstawy technologii przemysłowej
19.01.2015 PRACA INŻYNIERSKA MIODYŃSKA, Studia- ochrona środowiska
Praca ochrona środowiska
Praca inżynierska, Studia, Ochrona środowiska
prawo ochrony środowiska, 13 strefa przemysłowa
więcej podobnych podstron