ĆWICZENIE 6
SPORZĄDZANIE ROZTWORÓW O OKREŚLONYM STĘŻENIU
ODCZYNNIKI
Na2CO3 (s)
KMnO4 (s)
stężony H2SO4
CH3COONa(s)
SPRZĘT LABORATORYJNY
- Kolby miarowe 500 cm3, 10 cm3, 50 cm3
- Zlewki 25 cm3
- Cylinder 100 cm3
- Pipety o pojemności 10 cm3, 25 cm3
- Erlenmajerka 250 cm3
- Bagietka
- Lejek szklany
- Mikropipetka
CEL ĆWICZENIA
Poznanie techniki sporządzania roztworów
Prawidłowe użycie naczyń miarowych
Nauka ważenia
Nauka oznaczania stężenia roztworu na podstawie pomiaru absorbancji
WSTĘP TEORETYCZNY:
ROZTWORY
Roztworem nazywamy jednofazowy układ złożony z rozpuszczalnika i substancji rozpuszczonej. Rozróżniamy roztwory stałe, ciekłe i gazowe. Roztwory ciekłe można otrzymać przez rozpuszczenie gazu lub ciała stałego w cieczy, zwanej rozpuszczalnikiem, przez zmieszanie dwu cieczy lub przez reakcję chemiczną, której produkt pozostaje w fazie ciekłej.
Roztwór rzeczywisty jest to roztwór, w którym substancja rozpuszczona występuje w stanie rozproszenia molekularnego tzn. w postaci pojedynczych atomów, jonów lub cząsteczek o wymiarach mniejszych od 1 nm.
Roztwory dzielimy na roztwory wodne (rozpuszczalnikiem jest woda) i niewodne (rozpuszczalniki organiczne).
Proces rozpuszczania ciał stałych zależy od budowy substancji rozpuszczonej i rozpuszczalnika. Podczas rozpuszczania muszą zostać pokonane siły przyciągania między elementami sieci krystalicznej oraz siły spójności działające między cząsteczkami rozpuszczalnika. Obydwa te procesy wymagają nakładu energii, która może być pobierana z otoczenia lub wytwarzana podczas ostatniego etapu rozpuszczania - solwatacji.
Solwatacja polega na przyłączaniu się polarnych cząsteczek rozpuszczalnika do jonów lub cząsteczek substancji rozpuszczonej. Solwatacja w roztworach wodnych nosi nazwę hydratacji.
Jest to proces egzotermiczny. Solwatacja jonów przez cząsteczki rozpuszczalnika ułatwia rozpuszczanie, ponieważ wiąże jony wyrwane z sieci krystalicznej.
Rys. 1. Mechanizm rozpuszczania kryształu jonowego w wodzie
Ciecze polarne są dobrymi rozpuszczalnikami związków polarnych, ciecze niepolarne zaś dobrymi rozpuszczalnikami związków niepolarnych. Najprościej sformułowana zasada brzmi; podobne rozpuszcza podobne.
Rozpuszczanie jest procesem odwracalnym, a więc można odzyskać substancję rozpuszczoną przez usunięcie rozpuszczalnika (odparowanie rozpuszczalnika). Rozpuszczalność substancji stałych wzrasta z temperaturą. Podczas ochładzania roztworu nasyconego nadmiar substancji rozpuszczonej krystalizuje.
Rozpuszczalność - rozpuszczalnością substancji nazywamy maksymalną liczbę gramów substancji, jaka w danych warunkach temperatury i ciśnienia rozpuszcza się w 100 gramach rozpuszczalnika tworząc roztwór nasycony.
Roztwór przesycony - roztwór, w którym stężenie jest większe niż rozpuszczalność danego składnika.
Roztwór nasycony - jest to roztwór o stężeniu odpowiadającym rozpuszczalności danego składnika, czyli roztwór zawierający maksymalną ilość substancji rozpuszczonej.
Roztwór nienasycony - roztwór o stężeniu mniejszym niż rozpuszczalność danego składnika.
W roztworach przesyconych panuje równowaga pozorna. Substancja rozpuszczona nie krystalizuje z roztworu przesyconego tylko dlatego, że brak jest zarodków krystalizacji. Wprowadzenie zarodka krystalizacji lub intensywne mieszanie roztworu powoduje gwałtowne wydzielenie osadu. Równowaga pozorna (w roztworach przesyconych) może występować w obszarze między linią ciągłą a i linią przerywaną b na rysunku 2. Linią przerywaną zaznaczono krzywą maksymalnego przesycenia.
Rys.2. Zależność rozpuszczalności od temperatury
W odróżnieniu od rozpuszczania czysto fizycznego, procesy przeprowadzania do roztworu substancji stałej na drodze procesu chemicznego (np. rozpuszczanie Na w wodzie) nazywamy roztwarzaniem.
SPOSOBY WYRAŻANIA STĘŻEŃ
Stężenie roztworu - jest to stosunek ilości substancji rozpuszczonej do ilości rozpuszczalnika lub roztworu.
Stężenie molowe - jest to stosunek ilości moli substancji rozpuszczonej (n) do objętości roztworu (V).
![]()
Stężenie procentowe (w procentach masowych) podaje liczbę jednostek masowych substancji zawartych w 100 jednostkach masowych roztworu
![]()
![]()
ms - masa substancji rozpuszczonej, [g], [kg],
mr - masa roztworu, [g], [kg],
Ułamek wagowy - stosunek masy substancji rozpuszczonej do masy roztworu
![]()
Ułamek molowy xi - oznacza stosunek ilości moli (atomów) substancji „i” do całkowitej ilości moli (atomów) tworzących roztwór
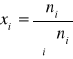
Stężenie normalne - określa liczbę gramorównoważników (wali) substancji rozpuszczonej, zawartej w 1 dm3 roztworu
![]()
nG - liczba gramorównoważników substancji rozpuszczonej, [wal],
Vr - objętość roztworu, [dm3],
ms - masa substancji rozpuszczonej, [g],
Gs - gramorównoważnik substancji rozpuszczonej, [g/wal].
WYZNACZANIE STĘŻENIA ROZTWORÓW NA PODSTAWIE PRAWA LAMBERTA - BEERA
Pochłanianie światła w rozcieńczonych roztworach substancji barwnych opisuje prawo Lamberta - Beera, które wiąże osłabienie natężenia przechodzącego strumienia światła z drogą optyczną wiązki, stężeniem i rodzajem substancji barwnej.
Stosunek natężenia promieniowania przepuszczonego I do padającego Io dla danej częstości nazywany jest transmitancją T próbki przy tej częstości:
![]()
Natężenie promieniowania przechodzącego przez próbkę zmienia się z długością drogi optycznej (grubości próbki, l) oraz stężeniem molowym substancji absorbującej, c, zgodnie z prawem Lamberta - Beera:
![]()
ε - molowy współczynnik absorpcji (współczynnik ekstynkcji) 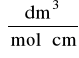
Molowy współczynnik absorpcji zależy od częstości promieniowania padającego i przyjmuje największe wartości dla tych częstości, przy których absorpcja jest najbardziej intensywna. Absorbancja związana jest z transmitancją zależnością:
![]()
lub ![]()
Stąd prawo Lamberta - Beera może przyjąć postać:
A = ε c l
WYKONANIE ĆWICZENIA
A). SPORZĄDZANIE 0,1 N ROZTWORU WĘGLANU SODU
Obliczyć ilość gramów węglanu sodu Na2CO3 potrzebną do sporządzenia 100 cm3 0,1 N roztworu. Obliczoną ilość drobno sproszkowanego Na2CO3 odważyć na wadze w naczyńku wagowym i wsypać do dokładnie umytej kolby miarowej (100 cm3) przez czysty suchy lejek. Przylepione do powierzchni lejka oraz naczyńka wagowego resztki węglanu sodu spłukać wodą destylowaną z tryskawki. Dolać wody destylowanej do połowy objętości kolby i mieszać zawartość wykonując ruchy okrężne. Po całkowitym rozpuszczeniu osadu dopełnić kolbę wodą do kreski.
Ponieważ odważenie dokładnie takiej ilości węglanu jak wynika z obliczeń jest żmudne i czasochłonne (do każdego dosypywania lub osypywania należy bezwarunkowo zdejmować z szalki naczyńko wagowe), należy odważyć w przybliżeniu ilość odpowiadającą obliczonej a później obliczyć uzyskaną normalność roztworu.
B). SPORZĄDZANIE ROZTWORU KMnO4
Odważyć na wadze około 0,14 g nadmanganianu potasu i rozpuścić na zimno w wodzie destylowanej, w kolbie miarowej o pojemności 500 cm3. Po dokładnym wymieszaniu roztworu odmierzyć pipetą 10 cm3 roztworu i przelać do kolbki na 50 cm3. Kolbkę uzupełnić do kreski wodą destylowaną i po zatkaniu dobrze wymieszać. Obliczyć stężenie molowe otrzymanego roztworu.
Wyznaczyć stężenie molowe otrzymanego roztworu spektrofotometrycznie przy długości fali analitycznej λ = 528 nm. Współczynnik ekstynkcji ε528 = 2,4⋅ 10-4 [cm-1mol-1dm3].
C). SPORZĄDZANIE I BADANIE WŁAŚCIWOŚCI PRZESYCONEGO ROZTWORU OCTANU SODU
W trzech czystych probówkach rozpuścić na gorąco po 5 g octanu sodu w 2 cm3 wody. Należy zwrócić uwagę na to, aby rozpuściły się dokładnie wszystkie kryształki związku. Probówki zatkać koreczkami z waty i możliwie bez wstrząsów umieścić w statywie aż do ostygnięcia. W pierwszej probówce zapoczątkować krystalizację wrzucając mały kryształek octanu sodu, a w drugiej - delikatnie pocierając wewnętrzną ściankę probówki pręcikiem szklanym. W trzeciej kontrolnej probówce krystalizacja nie powinna nastąpić. Jakie zjawisko fizyczne można zaobserwować, jeżeli trzymać w dłoni probówkę, w której następuje krystalizacja?
D). SPORZĄDZANIE 1 M ROZTWORU KWASU SIARKOWEGO
UWAGA: ZGŁOSIĆ GOTOWOŚĆ PRZYSTĄPIENIA DO ĆWICZENIA
PROWADZĄCEMU !!!
Obliczyć, jaką ilość stężonego kwasu siarkowego należy odmierzyć do przyrządzenia 250 cm3 1 M roztworu. Odmierzyć obliczoną ilość kwasu za pomocą pipety i stale mieszając wlewać porcjami do erlenmajerki (250 cm3), zawierającej 100 cm3 wody celem wstępnego rozcieńczenia. W przypadku rozgrzania się erlenmajerki ostudzić ją przez zanurzenie w zimnej wodzie, a następnie przelać ilościowo do kolby miarowej (250 cm3). Erlenmajerkę należy kilkakrotnie przepłukać małymi porcjami wody dołączając je następnie do roztworu w kolbie miarowej. Następnie należy dopełnić kolbę wodą destylowaną do kreski. Jeżeli roztwór w kolbie ogrzał się, należy po ochłodzeniu uzupełnić objętość roztworu wodą. Rozcieńczając stężony kwas siarkowy należy pamiętać o tym, że nie wolno wlewać wody do stężonego kwasu, gdyż ze względu na dużą egzotermiczność reakcji rozcieńczania grozi to wyrzuceniem części płynu z naczynia i niebezpiecznym oparzeniem eksperymentatora. Nie należy także przelewać z powrotem stężonego kwasu do butelki, jeżeli nalano go zbyt wiele do cylindra miarowego. W takim przypadku należy nadmiar odczynnika wylać do zlewki. Po przelaniu odmierzonej ilości kwasu z cylindra do kolby miarowej nie należy pozostałości w cylindrze spłukiwać do kolby miarowej.
OPRACOWANIE WYNIKÓW
Wyniki opracować zgodnie ze wzorem sprawozdania i wytycznymi prowadzącego.
Literatura
A. Rokosz, Ćwiczenia z chemii ogólnej i nieorganicznej, PWN, Warszawa 1974.
I. Baryłka, K. Skudlarski, Podstawy chemii, PWN, Warszawa 1986.
L. Pajdowski, Chemia ogólna, PWN, Warszawa 1993.
A. Śliwa, Obliczenia chemiczne, PWN, Warszawa 1987.
7
Wyszukiwarka
Podobne podstrony:
8868
8868
8868
8868
8868
8868
8868
8868
więcej podobnych podstron