ĆWICZENIE 5
PRZEWODNICTWO ROZTWORÓW
ODCZYNNIKI
- 0,2 HCl
- 0,1 M HCl
- 0,1 M CH3COOH
- 0,1 M NaOH
- 0,05 M NaOH
- 0,1 M HgCl2
- NaCl(s)
- glukoza
- H2O destylowana
- H2O wodociągowa
- aceton
- heksan
- fenoloftaleina
APARATURA
- zasilacz
- miliamperomierz
- czujnik konduktometryczny
- konduktometr
- elektrody węglowe
- biureta o pojemności 25 cm3
- zlewki o pojemności 25 cm3
- mieszadło magnetyczne
CEL ĆWICZENIA
Nauka pomiaru przewodnictwa i wyciągania z jego wartości odpowiednich wniosków odnośnie charakteru badanej substancji i zachodzących reakcji (elektrolity, nieelektrolity, elektrolity mocne, elektrolity słabe).
Nabycie umiejętności wyznaczania punktu równoważnikowego poprzez pomiar zmian przewodnictwa roztworu w trakcie miareczkowania.
WSTĘP TEORETYCZNY
Przepływ ładunków elektrycznych przez materię pod wpływem pola elektrycznego
nazywamy przewodnictwem materii.
Prąd elektryczny może być przenoszony przez:
Elektrony - tak przewodzą metale (przewodniki pierwszego rodzaju).
Jony - dotyczy stopionych soli i roztworów elektrolitów (przewodniki drugiego rodzaju).
Biorąc pod uwagę możliwość przepływu prądu przez roztwory dzieli się je na:
Elektrolity - substancje, które rozpuszczając się tworzą roztwór zawierający jony, co umożliwia przewodzenie elektryczności. Nośnikami ładunku są dodatnio (kationy) i ujemnie (aniony) naładowane jony
a). elektrolit mocny to związek, którego roztwór zawiera głównie jony (kwasy: HBr, HCl, HI, HNO3, HClO4, H2SO4; zasady: wodorotlenki litowców i wapniowców; sole z wyjątkiem niektórych soli rtęci, kadmu i cynku).
b). elektrolit słaby to związek, którego roztwór zawiera głównie cząsteczki i niewiele jonów.
2. Nieelektrolity - substancje, których roztwory nie zawierają jonów, nie przewodzą,
więc elektryczności.
Rozpad cząsteczek elektrolitów na jony zachodzący w wyniku ich oddziaływania z cząsteczkami rozpuszczalnika (np. wody) nazywa się dysocjacją:
![]()
Nie wszystkie elektrolity ulegają całkowitemu rozpadowi na jony. Liczbę określającą, jaka część elektrolitu ulega dysocjacji, nazywamy stopniem dysocjacji ![]()
.
![]()
![]()
- liczba moli cząstek zdysocjowanych
![]()
- całkowita liczba moli
Elektrolity mocne ulegają całkowitej lub niemal całkowitej dysocjacji (ich stopień dysocjacji wynosi 1 lub jest bliski jedności). Elektrolity słabe tylko w małej części ulegają dysocjacji (![]()
<< 1).
Stopień dysocjacji nie jest dokładną miarą mocy elektrolitu, gdyż zmienia się wraz ze stężeniem elektrolitów, mianowicie rośnie wraz z rozcieńczeniem i ta zależność od stężenia nie jest liniowa. Właściwą miarą mocy słabych elektrolitów, praktycznie niezależną od stężenia jest stała dysocjacji.
Dla reakcji
![]()
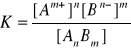
Zależność pomiędzy stałą dysocjacji, stopniem dysocjacji a stężeniem elektrolitu określa prawo rozcieńczeń Ostwalda:
![]()
Roztwory elektrolitów różnią się wyraźnie swoimi właściwościami od roztworów nieelektrolitów. Obecność jonów, cząstek naładowanych elektrycznie, powoduje, że roztwory elektrolitów przewodzą prąd elektryczny. Podczas przepływu prądu przez roztwór elektrolitu zachodzą w nim reakcje chemiczne, których produkty wydzielają się na elektrodach. Opisane zjawisko nosi nazwę elektrolizy. Przewodność elektrolitów zmienia się w szerokim zakresie w miarę przechodzenia od elektrolitów słabych, tworzących niewielką liczbę jonów w roztworze, do całkowicie lub niemal całkowicie dysocjowanych mocnych elektrolitów. Pomiary przewodności dostarczają wielu cennych informacji o zachowaniu się jonów w roztworze. Między innymi na ich podstawie można obliczyć stopień dysocjacji. Inną cechą charakterystyczną dla elektrolitów jest to, że wykazują one większe obniżenie prężności pary, większe podwyższenie temperatury wrzenia oraz większe obniżenie temperatury krzepnięcia w odniesieniu do czystego rozpuszczalnika w porównaniu z nieelektrolitami.
Przewodzenie prądu elektrycznego przez przewodniki podlega prawu Ohma, zgodnie z którym, natężenie prądu płynącego przez przewodnik jest wprost proporcjonalne do różnicy potencjałów między końcami przewodnika, a odwrotnie proporcjonalne do jego oporu R.
![]()
![]()
- opór właściwy
Przewodnictwo (λ) jest odwrotnością oporu.
Elektrolity charakteryzują się przewodnictwem właściwym i molowym.
Przewodnictwo właściwe λo (przewodność) stanowi odwrotność oporu właściwego ![]()
:
![]()
Przewodnictwo właściwe elektrolitu stanowi przewodność 1 cm3 tego elektrolitu, zawartego między elektrodami o powierzchni 1 cm2 każda, odległymi o 1 cm.
![]()
[cm-1Ω-1]
R - opór elektrolitu [Ω]
l - odległość elektrod [cm]
P - powierzchnia elektrod [cm2]
Przewodnictwo molowe λv - przewodnictwo warstwy elektrolitu o grubości 1 cm i takiej objętości, aby zawierała ona 1 mol substancji.
Związek pomiędzy przewodnictwem molowym i właściwym wyraża następujący wzór:
![]()
[cm2Ω-1mol-1]
Przewodnictwo molowe zależy od rodzaju elektrolitu (mocny, słaby), jego stężenia i temperatury. Wzrasta z rozcieńczeniem dążąc do granicznego przewodnictwa molowego.
Ogólnie rzecz biorąc przewodnictwo elektrolitów zależy od:
liczby jonów (stężenia)
liczby ładunków elementarnych przenoszonych przez każdy jon
prędkości poruszania się lub ruchliwości jonu (zależy od rodzaju jonu, natężenia przyłożonego pola i lepkości rozpuszczalnika)
Prędkość wędrówki jonu w polu elektrycznym zależy od natężenia tego pola. Do najbardziej ruchliwych należą jon wodorowy oraz wodorotlenowy.
Pomiary przewodnictwa muszą być wykonywane przy użyciu prądu zmiennego. Prąd stały powoduje rozkład elektrolityczny roztworu i zmiany stężenia w obszarze przyelektrodowym.
Miareczkowanie konduktometryczne opiera się na zmianach przewodnictwa wywołanych przez dodanie odczynnika miareczkującego. Podczas dodawania odczynnika z biurety zmienia się rodzaj i stężenie jonów w roztworze, co powoduje zmiany przewodnictwa. Pozwala to na oznaczenie punktu równoważnikowego. Podczas miareczkowania roztworu mocnej zasady mocnym kwasem przewodnictwo początkowo maleje, gdyż zmniejsza się stężenie jonów przewodzących osiągając w PR wartość minimalną. Po zobojętnieniu całej ilości zasady przewodnictwo znowu rośnie, gdyż ponownie zwiększa się stężenie elektrolitu.
Rysunek 1 przedstawia krzywą miareczkowania konduktometrycznego.
WYKONANIE ĆWICZENIA
Pomiary przewodnictwa
Zbudować układ pomiarowy według poniższego schematu:
Do zlewek wprowadzić kolejno po 25 cm3 następujących substancji:
a). 0,1 M HCl
b). 0,1 M CH3COOH
c). 0,1 M NaOH
d). 0,1 M HgCl2
e). H2O destylowaną
f). H2O wodociągową
g). aceton
h). heksan
3. Do każdej zlewki kolejno wprowadzić parę elektrod węglowych. Przy każdej zmianie roztworu należy elektrody wypłukać wodą destylowaną i osuszyć bibułą. Elektrody należy zanurzać na jednakową głębokość. Zanotować wskazania miliamperomierza.
4. Do suchej zlewki wsypać sól kuchenną tak, aby przykryła elektrody na głębokość 1 cm i zbadać przewodnictwo. Następnie dodawać powoli wodę destylowaną i obserwować wskazania miliamperomierza. Analogiczną próbę przeprowadzić z glukozą.
Miareczkowanie konduktometryczne:
Miareczkowanie 0,05 M roztworu NaOH 0,2 M roztworem HCl:
1). Zestawić układ pomiarowy zgodnie z powyższym schematem
2). W zlewce o pojemności 150 cm3 umieścić 80 cm3 0,1 M roztworu NaOH i dodać kilka kropli fenoloftaleiny i uruchomić mieszanie
3). Zanotować przewodnictwo roztworu
3). Dodawać z biurety 0,2 M roztwór HCl porcjami po 1,5 cm3
4). Po każdorazowym dodaniu kwasu odczekać 30 s i zanotować wskazania konduktometru i barwę roztworu.
5). Pomiary prowadzić do momentu zużycia całego roztworu z biurety
OPRACOWANIE WYNIKÓW
Wyniki opracować zgodnie ze wzorem sprawozdania i wytycznymi prowadzącego.
Literatura:
L. Jones, P. Atkins, Chemia ogólna: cząsteczki, materia, reakcje, PWN, Warszawa 2006.
L. Pajdowski, Chemia ogólna, PWN, Warszawa 1993.
T. Drapała, Chemii ogólna i nieorganiczna, PWN, Warszawa 1975.
J.A. Szymura, R. Gogolin, Wybrane zagadnienia z chemii ogólnej i nieorganicznej, Wydawnictwo Uczelniane ATR, Bydgoszcz 2001.
E. Uhlemann, Ćwiczenia laboratoryjne z chemii ogólnej i nieorganicznej, PWN, Warszawa 1977.
6
Wyszukiwarka
Podobne podstrony:
2979
2979 001
2979
2979
2979
2979 001 (2)
więcej podobnych podstron