Aldehydy można otrzymać w reakcji:
utleniania I rzędowego alkoholu
utleniania II rzędowego alkoholu
przyłączając wodę do acetylenu (etylu)w obecności soli rtęci dwuwartościowej Hg2+
Alkany powstaja w reakcji :
związku Grignarda z wodą
redukcji wodorem chlorowcopochodnych weglowodorów nasyconych\
stapiania soli kwasów karboksylowych ze stałymi wodorotlenkami
Amidy kwasowe mozna otrzymać w reakcji :
halogenku kwasowego z amoniakiem
ogrzewając sole amonowe kwasów karboksylowych
hydrolizując nitryle kwasowe
Aminokwasy wchodzą w skład
węglowodanów
tłuszczów
białek
Anilina zwana także aminobenzenem lub fenyloaminą należy do grupy:
amin aromatycznych pierwszorzędowych
amin aromatycznych drugorzędowych
amin alifatycznych
Asocjacja to:
Kompensacja jonów
Azeotrop dodatni ma w steżeniu azeotropowym:
minimalną prężność pary
minimalna temperaturę wrzenia
maksymalna prężność pary
Baryt jest:
siarczanem baru
siarczkiem baru
siarczanem wapnia
Białka zbudowane są:
hydroksykwasów
aminokwasów
aldehydo- i ketonokwasów
Butadient posiada nastepująca ilość możliwych izomerów:
cztery
jeden
dwa
Całkowita polaryzacja danej substancji:
wyraża się zależnością: Pc=Pdip+Pa+Pe
jest zdolnością jonów do odkształcania pod wpływem jonów sąsiednich
wyraża się zależnością Pc=Pa+Po
Charakterystyczną reakcja dla alkenów jest
reakcja eliminacji cząsteczek
reakcja powstawania wdorow innymi atomami
reakcja przyłączenia cząsteczek
Chlor wystepuje w
sylwinie
knolicie
karnalicie
Chlor występuje w:
sylwinie
karnalicie
Ciepło rozpuszczania zależy od :
natury substancji rozpuszczonej i rodzaju rozpuszczalnika
natury substancji rozpuszczonej i rodzaju oraz ilości rozpusczalnika
tylko rodzaju i ilości rozpuszczalnika
Ciepło tworzenia jest to efekt cieplny:
syntezy jednego mola związku z pierwiastków w stanie standardowym
syntezy jednego mola związku z pierwiastków w stanie krytycznym
analizy jednego mola związku z pierwiastków w stanie standardowym
Cykl Carnota jest:
cyklem składającym się z dwu odwracalnych przemian izotermicznych i dwu odwracalnych przemian adiabatycznych
cyklem składającym się z dwu nieodwracalnych przemian izotermicznych i dwu odwracalnych przemian adiabatycznych
doskonałym cyklem termodynamicznym
Cykl Carnota jest:
procesem politropowym
rzeczywistym cyklem termodynamicznym
doskonałym cyklem termodynamicznym
Cyklosiarka jest odmianą alotropową siarki zwaną siarką
rombową
jednoskośną
siarką α
Cząstki mogą przenosić:
oddziaływania grawitacyjne
oddziaływania elektrostatyczne pomiędzy cząstkami a ładunkiem
słabe i silne oddziaływania jądrowe
Defekt masy jest równy:
energii wydzielonej podczas rozkładu jądra atomowego
energii wydzielonej podczas syntezy jądra atomowego
różnicy miedzy liczba masową a masą atomową
Dla paramagnetyków:
k= J/H
k= -J/H
k= J/F
Dla procesów przebiegających przy stałym ciśnieniu wartość entalpii wyraża się
dH>dQ
dH=dQ
dH<dQ
Dla procesów przebiegających przy stałym ciśnieniu wartość entalpii wyraża się:
dH=dQ+Vdp
dH=dQ
dH<dQ
Długość Plancka wynosi:
10-35m
Do estrów zalicza się
produkty reakcji kwasów karboksylowych z alkoholami
produkty reakcji alkoholi z kwasami nieorganicznymi
produkty reakcji alkoholi z kwasami aromatycznymi
Do izotopów wodoru zaliczany jest:
prot
tryt
ortowodór
Do izotopów wodoru zaliczany jest:
tryt
prot
deuter
Efektywny moment magnetyczny mierzony jest w:
siemensach
Faradayach
magnetonach Bohra
Elektronowolt jest miarą:
energii kinetycznej jaką nabywa jeden elektron w polu różnicy potencjałów równej jeden wolt
energii równej 1,602·10-19J
energii potencjalnej jaką może mięć jeden elektron w polu o różnicy potencjałów jeden wolt
Elektroujemność+- jest to cecha charakteryzujaca zdolność atomu w cząsteczce do
odpychania elektronów
przyciągania elektronów
deformacja jąder atomowych
Energia jonizacji jest to energia niezbędna do:
usunięcia elektronu z atomu pierwiastka
wprowadzenia elektronu do atomu pierwiastka
przesunięcia elektronu w strukturze tego samego atomu.
Energia swobodna wyraża się zależnością:
F=U-TS
G=U-TS
G=H+TS
Energia wewnętrzna zależy od:
energii otoczenia
parametrów stanu
ilości i natury substancji
Energia wiązania jest cechą:
addytywną
nieaddytywną
rozproszoną
Entalpia jest określana jako:
funkcja ciepła Gibbsa
energia właściwa
potencjał energetyczny
Entalpia w procesach izobarycznych jest określana jako:
potencjał termodynamiczny
funkcja cieplna Gibbsa
potencjał energetyczny
Estry sa to związki chemiczne powstające w reakcji między:
alkinami i kwasami
alkenami i kwasami
alkoholami i kwasami
Etenu nie można otrzymać w reakcji przedstawionej równaniem
C3H7-CH2Br+KOH = CH2=CH2 +KBr+HO
CL-CH2-CH2 -CL+Zn = CH2=CH2 +ZnCL
CH3-CH3+CL2 = CH2=CH2+2HCL
Etery sa to zwiazki chemiczne o wzorze ogólnym:
R-CO-R
R-O-R
R-COO-R
Fenolany powstaja w reakcji fenolu z
NaOH
NaCl
Na
Fizyczna masa atomowa to:
1/12 masa atomu węgla C12
równa jest [u] w skali chemicznej
jest 1,000275 razy większa od [u] w skali chemicznej
Fluoryt ma wzór chemiczny
Na3AlF6
Ca5(PO4)3F
CaF2
Fotony są:
cząstkami o zerowej masie spoczynkowej
cząstkami o energii dążącej do hv
Funkcjami stanu są:
f(p,V,T)=0
f(p,U,T)=0
R=(n2-1/n2+2)(M/d)
Funkcjami stanu są:
refrakcja molowa
refrakcja właściwa
lepkość dynamiczna
Gliceryna jest związkiem chemicznym typu
hydroksykwasu
glikolu
alkoholu
Gramorównowaznik kwasu siarkowego wynosi :
98g
49g
32g
Grupa sulfonowa -SO3H związana z pierścieniem aromatycznym kieruje następny podstawnik wprowadzany do pierścienia aromatycznego w pozycję:
para
orto i para
meta
HBrO3 jest kwasem:
bromawym
bromowym
nadbromowym
HClO nosi nazwę kwasu:
podchlorawego
podchlorowego
chlorowego
Hybrydyzacja cząsteczek to proces tworzenia nowych jednakowych i ukierunkowanych w przestrzeni orbitali atomowych z kombinacji orbitali:
s,p
s,p,d
I prawo elektrolizy Faradaya wyraża się wzorem:
m=kIt
m=kQ
I zasada termodynamiki ma następujące równanie:
U=Q+A
dU=dQ+dA
dU=dH+dA
Iloczyn jonowy wody wyraża sie zależnością:
pH=log[H+]
pH=-log[H+]
pH=-ln[H+]
Ilości poszczególnych nuklidów promieniotwórczych są wprost proporcjonalne do okresów półtrwania to prawo:
równowagi promieniotwórczej
Fermiego
Izobary są to:
atomy pierwiastków różniących się liczbą atomową ale mających te samą liczbę masową
atomy tego samego pierwiastka różniące się ilością pozytonów
atomy tego samego pierwiastka różniące się ilością neutronów
Izotopy mające szczególną trwałość zawierają liczby magiczne:
protonów lub neutronów
elektronów
kwarków
Jednostka lepkości dynamicznej jest:
paskalosekunda
niutonosekunda na metr kwadratowy
metr kwadratwy na sekundę
Jednostka momentu dipolowego jest :
[D]
[C m]
[m]
Jednostką lepkości kinematycznej jest:
m2/s
mm2/s
Jednostką lepkości kinetycznej jest:
paskalosekunda
niutonosekunda na metr kwadratowy
metr kwadratowy na sekundę
Jednostką momentu dipolowego jest:
D
C m
Jeżeli dwa atomy łącząc się tworzą cząsteczkę związku to stosunek mas tych atomów:
ma wartość stała
wyraża się prostymi liczbami całkowitymi
nosi nazwę ułamka molowego
Jeżeli jednym rodzajem pracy jest praca zmiany objętosci układu to I zasadę termodynamiki można zapisać:
dU=dQ-pdV
dU=dH-pdV
dU=dQ+pdV
Każdy związek chemiczny ma stały skład ilościowy to prawo
stosunków stałych
Kolektywny model jądra atomowego zawiera
elementy modelu powłokowego
elementy modelu kropelkowego Bohra i modelu kropelkowego
Ktory z wymienionych zwiazkow nie jest alkoholem
CH3-CH2-OH
C5H5-OH
C5H5-CH2-OH
Kwarki od długości światła widzialnego są
mniejsze
Kwarki stanową element budowy
protonów i neutronów
Kwarki stanowią
element budowy tylko elektronów
w ilości 3 kwarków element budowy protonów i neutronów
w ilości 6 kwarków element budowy protonów i neutronów
Kwasy tlenowe otrzymywane są poprzez:
działanie wodą na bezwodniki kwasowe
działanie odpowiednich tlenków na wodę
Kwasy tlenowe są otrzymywane poprzez :
dziłanie tlenem na odpowiednie sole
działanie wodą na bezwodniki kwasowe
działanie odpowiednich tlenków na wode
Lepkość jest:
miarą tarcia wewnętrznego substancji
tarciem wewnętrzym w cieczach i gazach
siłą oddzaływania wzajemnego warstw cieczy
Lepkość kinematyczna jest :
odwrotnościa lepkości dynamicznej
lepkością względną
stosunkiem lepkości dynamicznej do gęstości
Liczba atomowa efektywna jest
liczba ladunkow dodatnich w jadrze
liczba charakteryzujaca atomy metali w zwiazkach kompleksowych
liczba Sidgwicka
Liczba atomowa jest to:
liczba dodatnich ładunków w jądrze
liczba Sidwicka
suma elektronów i protonów
Liczba falowa jest to:
odwrotność długości fali
wartość częstotliwości fali wzbudznej
liczba długości fali mieszcząca się w jednostce długości
Liczba masowa stanowi :
liczbę nukleonów w jądrze atomu
liczbe ładunków w jądrze atomu
sumę elektronów i protonów
Liczba moli substancji rozpuszczonej w 1kg rozpuszczalnika nosi nazwę:
molowości roztworu
molalności roztworu
normalności roztworu
Liczba oktanowa jest:
miarą skłonności paliw do spalania detonacyjnego
miara odporności paliw na spalanie detonacyjne
miara skłonności paliw do samozapłonu
Liczby magiczne określają:
trwałych izotopów
Liozole są to koloidalne zwane:
emulsoidami
zdyspergowanymi czastkami cieczy w cieczach
suspensoidami
Ładunek jednego mola elektronów jest równy:
1F
96494 C
1,602·10-19[C] 602296·10-23
Magnetyczna liczba kwantowa zawiera się pomiędzy
-1 do 1
Maksymalny stopień utleniania nie może przekraczać:
liczby elektronów walencyjnych
Metoda Clausa słuzy do otrzymania:
selenu
siarki
fosforu
Mezonami wszystkich typów są cząsteczki o nazwach
bozony
miony, piony, kaony
mezony typu k i μ
Mezonami wszystkich typów są cząstki o nazwach:
mezony typu mi pi K
Mezony mają masę zawartą w przedziale pomiędzy
elektronem a protonem
Molowe ciepło przemiany polimorficznej wyraża się:
c)
Molowym ciepłem parowania jest ilość ciepła pobrana przez układ podczas przeprowadzenia pod ciśnieniem pary nayconej 1 mola cieczy w 1 mol pary nasyconej w sposób
izotermiczny i izochoryczny
izobaryczny i izochoryczny
izobaryczny i izotermiczny
Moment dipolowy jest:
skalerem
sumą ładunków
wektorem
Moment dipolowy jest:
wektorem
iloczynem bezwzględnej wartości ładunku i odległości
iloczynem wartości ładunku i odległości
Mydła sa to:
sole wyższych kwasów tluszczowych i gliceryny
sole wyższych kwasów tluszczowych
sole kwasów jednokarboksylowych
Negaton to:
antycząstka dla pozytonu
elektron
Neutrino ma:
niemal nieograniczoną przenikalność przez materię
znikomo małą masę
Nitrozwiązki aromatyczne powstają w reakcji węglowodoru aromatycznego z :
kwasem siarkowym
kwasem azotowym
mieszaniną kwasu azotowego i siarkowego
Nitrozwiązki aromatyczne powstają w reakcji węglowodoru aromatycznego z:
mieszaniną kwasów azotowego i siarkowego
Objętość atomowa jest to
objętość jednego gramorównoważnika pierwiastka
objętość jednego mola pierwiastka w stanie stałym
objetosc jednej gramoczasteczki pierwiastka w stanie stalym
Objętość atomowa jest to:
objętość jednego mola pierwiastka w stanie stałym
objętość 1 gramocząsteczki pierwiastka w stanie stałym
Odmianami wodoru czasteczkowego sa
ortowodor
parawodor
dueter
Odmianami wodoru cząsteczkowego są:
ortowodór
parawodór
Oziębianie towarzyszące rozprężaniu się gazów bez wykonywania pracy stanowi:
dodatni efekt Joule'a-Thompsona
ujemny efekt Joule'a-Thompsona
efekt Tynadalla
Ozon ma charakter:
paramagnetyczny
ferromagnetyczny
diamagnetyczny
Parachory cieczy są:
funkcjmi stanu i wielkosciami addytywnymi
funkcjami stanu o wielkościach nieaddytywnych
wektorami
Pełne ciepło rozpuszczania jest to efekt cieplny:
rozpuszczania jednego mola substancji w nieskończenie wielkiej ilości rozpuszczalnika
rozpuszczenia jednego mola substancji w dużej ilości roztworu o określonym stężeniu
rozpuszczenia jednego mola substancji w takiej ilości rozpuszczalnika aby powstał roztwór nasycony
Pierwiaski wewnętrznoprzejściowe są to pierwiastki których atomy lub jony mają niecałkowicie wypełnioną powłokę:
d
f
p
Pierwiastki o różnych liczbach protonów i jednakowej liczbie neutronów noszą nazwę:
izotonów
Pierwiastki zewnetrznoprzejsciowe sa to pierwiastki, ktorych atomy lub jony maja niecalkowicie wypelniona podwloke
d
f
p
Pierwsza energia jonizacji jest to:
najmniejsza energia usunięcia pierwszego elektronu z atomu obojętnego pierwiastka w stanie gazowym
najmniejsza energia usunięcia pierwszego elektronu z atomu obojętnego pierwiastka
wprowadzenia elektronu do atomu pierwiastka
Pierwsza zasada termodynamiki ma następujące równanie:
U=Q-A
dU=dH+Dq
dU=dQ+dA
Pierwsze prawo elektrolizy Faradaya wyraża się wzorem:
m=kit
m=kQ
m=uit
Piryt jest związkiem:
siarki i ołowiu
siarki i żelaza(FeS2)
siarki i cynku
Plazmą nazywany jest:
czwarty stan materii
Po raz pierwszy założenia teorii atomistycznej zostały sformułowane przez:
Prousta
Daltona
Demokryta
Pojęcie aktywności roztworu odpowiada efektywnemu stężeniu przy którym roztwór doskonały:
osiaga właściwosci termodynamiczne danego roztworu doskonałego
osiaga właściwosci termodynamiczne danego roztworu rzeczywistego
osiaga właściwości roztworu spełniającego prawo Raoulta
Polaryzacja jonowa polega na:
deformacji jonów
symetryzacji ładunów
połączeniach jonowych
Potencjał jonizacyjny jest to:
energia potrzebna do przyłączenia elektronu
największa energia niezbędna do oderwania elektronu z pojedynczego atomu
najmniejsza energia niezbędna do oderwania elektronu z pojedynczego atomu
Potencjał jonowy jest to:
iloczyn ładunków
stosunek ładunku do promienia kationu
stosunek polaryzowalności do ładunku anionu
Potencjał termodynamiczny Gibbsa wyraża się zależnością:
G=F+pV
G=U-TS+pV
G=H-TS
Prawdopodobienstwo okreslenia pozycji elektronu jako rozwiazanie równania falowego stanowia funkcje porządne, które:
przypominają wartości skończone
są ciągłe
są jednoznaczne
Prawdopodobieństwo napotkania cząstki w przestrzeni wyraża się:
W= ρdv
W= -ρdv
W= ρdv+σx
Prawo Kirchoffa wyraża się zależnością:
dHt =dH0298 +Cp(T-298)
dH =dQ/dT
dQ/dT=-dC
Prawo Moseleya określa że właściwości pierwiastków są periodyczną funkcją:
ich liczb atomowych
zależy od liczby i sposobu rozmieszczenia elektronów
Prawo przesunięć jest:
regułą Fajansa i Sodego
Prawo równowagi chemicznej jest prawem:
stałości energii
działania mas
Guldberga i Waagego
Prawo stosunków objętościowych dotyczy:
gazów
jest to prawo Gay-Lusacca
Prawo stosunków stałych nosi nazwę:
prawa Praousta
Prawo stosunków wielokrotnych dotyczy:
dwu pierwiastków tworzących kilka związków
Prawo stosunków wielokrotnych określa, że:
każdy związek chemiczny ma stały skład ilościowy
stosunek mas substratów w reakcji ma wartość stałą
jest prawem Daltona
Prawo Wenniego wyraża się wzorem
c=k*p
k=p/x
Prawo zachowania materii określone jest formułami:
suma (m+E/c2)=const
Predkość wypływu cieczy z kapilary w stałej temperaturze określana jest wzorem:
Stokesa
Baczyńskiego
Poiseuille'a
Proces katenacji polega na:
tworzeniu pierścieni wieloatomowych
tworzeniu pierścieni sześcioatomowych
tworzeniu łańcuchów wieloatomowych
Proces pirolizy mieści sie w grupie procesów:
krakowania katalitycznego
krakowania termicznego
hydrokrakowania
Procesy adiabatyczne sa to procesy :
adiabatycznego sprężania
adiabatycznego rozprężania
adiabatycznego sprężania i rozprężania
Procesy adiabatyczne w gazach doskonałych są procesami:
opisywanymi równaniem Poissona
zachodzącymi przy dQ=0
opisywanymi równaniem pVγ=const.
Procesy izochoryczne zachodzą przy:
V=const. i dU=dQ
V=const. i dU>dQ
V=const. i dU<dQ
Procesy politropowe sa procesami :
adiabatycznymi
posrednimi między izotermicznymi a adiabatycznymi
zachodzącymi dla wykładników politropy zawartych Cp/Cv a wartością 1.
Procesy politropowe są procesami:
adiabatycznymi
izotermicznymi
zachodzącymi dla wykładników politropy zawartych pomiędzy cp/cv a wartością 1.
Produktem reakcji uwodnienia propynu wobec soli rtęci dwuwartościowej jest
propanal
propanol
propanon-2
Proton ma masę:
1,007805 u w skali węglowej
Przemianami nieodwracalnymi wg II zasady termodynamiki są
rozprężenie się gazu do próżni
krzepnięcie cieczy przechłodzonej
Reakcja dysporcjonowania są to reakcje w których pierwiastek spełnia funkcję:
reduktora
częściowo reduktora i częściowo utleniacza
utleniacza
Reakcja fluoru z wodorem przebiega:
wybuchowo dopiero w podwyższonej temperaturze
wybuchowo nawet w ciemności
wybuchowo, ale w obecności katalizatora
Reakcja sulfonowania polega na działaniu na węglowodory aromatyczne
stężonym kwasem
mieszanina nitrująca
stężonym kwasem siarkowym
Reakcje autokatalityczne są to reakcje w których katalizatorem jest:
substrat reakcji
Reakcje dysproporcjonowania są to reakcje, w których pierwiastek spełnia funkcję:
częściowo reduktora i częściowo utleniacza
Reakcji dysproporcjonowania w czasie ogrzewania ulegają :
bromiany i chlorany
brominy
podchloryny i podbrominy
Reakcji przyłączania (addycji) ulegają:
związki, w których występuje wiązanie wielokrotne pomiędzy atomami węgla
Refrakcja molowa przyjmuje wartość zgodnie z wzorem:
(n2-1)/(n2-2) M/d=R
(n2-1)/(n2+2) M/d=R
(n2-1)/(ε-2) M/d=R
Reguła Hunda mówi,że liczba nie sparowanych elektronów w stanie podstawowym na każdym orbitalu dla danego pod poziomu w atomie powinna być:
możliwie mała
jak największa
równa liczbie protonów
Rekcja sulfonowania polega na działaniu na węglowodory aromatyczne:
stężonym kwasem siarkowym.
Rekcji przylaczenia ( addycji ) ulegaja:
Związki, w których występuje wiązanie wielokrotne miedzy atomami węgla.
Rodziny promieniotwórcze stanowią szeregi:
trzy naturalne jeden sztuczny
torowy neptunowy uranowy i aktynowy
Roztwory buforowe są to :
wodne roztwory słabego kwasu i ich soli mocnych zasad
wodne roztwory słabych zasad i ich soli mocnych kwasów
wodne roztwory mocnych kwasów i ich soli słabych zasad
Rozwotry koloidalne charakteryzują się rozmiarem cząstek rozproszonych w granicach
10-20-10-15cm
10-4-10-2cm
10-710-4cm
Równania reakcj redox bilansować można metodami:
równań połówkowych
za pomocą stopni utleniania
Równanie adiabaty gazu doskonałego ma postać:
pV=const
pV^γ=const
pV=const
Równanie rozpadu promieniotwórczego ma postać:
N=N0e-λt
N= N0et
N= N0eλt
Równanie stanów gazów rzeczywistych ma postać:
(p-pi)(V-b)=RT
(p+a/V/2)(V-b)=RT
(p+pi)(V-b)=RT
Równanie stanu doskonałego ma postać:
pV=const.
pVT=nRT
pV= nRT
Równanie stanu gazów rzeczywistych ma postać:
(p+p1)(V-b)=RT
(p+a/V2)(V-b)=RT
(p+p1)(V-b)=nRT
Równomierny rozkład energii kinetycznej na wszystkie stopnie swobody cząstek ciała nosi nazwę:
zasady ekwipartycji energii
prawa równomiernego podziału energii
zasady transportu energii
Równowaznik chemiczny jest to liczba jednostek wagowych pierwiastka chemicznego która łączy się lub zastepuje:
1g H2
8g O2
1g H2 i 8g O2
Równoważnik chemiczny jest to liczba jednostek wagowych pierwiastka chemicznego, która:
przereaguje w danej reakcji z jednym molem atomów lub jonów wodoru
przereaguje w danej reakcji z jednym molem atomów wodoru
wymieni jeden mol elektronów w reakcji utleniania i redukcji
Selen szklisty jest:
selenem metalicznym
selenem szarym
selenem bezpostaciowym
Siała Baltzmanna wyraża się zależnością:
k=R/N0
Siły dyspersyjne noszą nazwę sił:
Debye'a
Keesoma
Londona
Siły indukcyjne noszą nazwę sił:
Debye'a
Keesoma
Van der Waalsa
Siły orientacyjne są siłami
Van der Waalsa
międzycząsteczkowymi
typu elektrostatycznego pomiędzy trwałymi dipolami
Skale mas atomowych i cząsteczkowych określił:
Avogadro
Skład i temperatura wrzenia mieszaniny azeotropowej ulega zmianie wraz ze zmianą:
temperatury otoczenia
ciśnienia
objętości
Spinem nazywany jest:
kręt cząstki elementarnej
moment obrotowy cząstki elementarnej
moment spinowy
Spintaryskop to:
licznik scyntylacyjny
Stalagmometr jest to przyrząd do wyznaczania
kąta zwilżania
zwilżalności
napięcia powierzchniowego
Stała asocjacji jest:
odwrotnością stałej dysocjacji
Stała Boltzmana wyraża sie zależnością
k=3/2R
k=R/N0
k=2/3 RN
Stała gazowa o wartości 8,3143 wyrażana jest w jednostkach
J/(mol deg)
J/ kg
kGm/deg
Stała Plancka to:
najmniejszy element materii
częstość drgań
elementarny kwant działania
Stwierdzenie „Efekt cieplny reakcji nie zależy od jej drogi a wyznaczony jest tylko stanami początkowym i końcowym” nosi nazwę:
prawa Kirchoffa
prawa Hessa
prawa Faradaya
Stwierdzenie, że ciepło rozkładu związku na składniki prostsze jest równe ciepłu tworzenia związku z tych składników nosi nazwę:
prawo Kirchoffa
prawo Hessa
reguły Lawisiera i Laplacea
Syntezę Wurtza przedstawia równanie
C3H8+C3H8 = C8H16
2C3H-CL+2Na = C5H14+2NaCL
C3H8+CL = C3H7CL+2HCL
Szybkość reakcji chemicznej w danym momencie określa zależność:
V=tgα
V= dc/dt
V=kp
Szybkość rozpadu promieniotwórczego wyrażona jest wzorem
-dN/dt=lambda N
Teza,że”wartość entropii każdego ciała w temperaturze zera bezwzględnego jest równa zero” nosi nazwę:
III zasady termodynamiki
postulatu Nernsta
równania entropii
Tłuszcze są estrami:
glikoli i kwasów karboksylowych
gliceryny i wyższych kwasów karboksylowych
alkoholi i kwasów mineralnych
Ujemna wartość standardowego potencjału termodynamicznego Gibbsa oznacza że substraty:
mają tendencję do samorzutnego przejścia w produkty
Ułamek molowy jest to:
jednostka stężenia substancji
stosunek liczby moli jednego składnika do sumy liczby moli w roztworze
stosunek liczby moli jednego składnika do liczby moli drugiego składnika
Uwodnienie jonów wodorowych w roztworach wodnych nosi nazwę:
hydratacja
W procesach politropowych wykładnik politropy wynosi:
γ<cp /cv
cp /cv<γ<1
γ<1
W procesach samorzutnych:
ΔH=0
ΔH>0
ΔH<0
W reakcjach przyłączenia do niesymetrycznych alkenów cząstek HX zgodnie z regułą Markownikowa powstają pochodne:
III rzędowe
I rzędowe
II rzędowe
W reakcje wodnego roztworu KOH z chlorkiem propylu CH3-CH2-CH2CL powstaje
propen
propanol-1
propyn
W reakcji aloholanow z halogenkami kwasowymi powstaje
ester
keton
eter
W reakcji wodnego roztworu KOH z chlorkiem propylu CH3-CH2 -CH2Cl powstaje:
propanol-1
W roztworach rozcieńczonych podwyższenie temperatury wrzenia jest:
wprost proporcjonalne do stężenia
odwrotnie proporcjonalne do stężenia
wprost proporcjonalne
W skali laboratoryjnej siarkowodór otrzymywany jest w wyniku
działania kwasem siarkowym na siarczek żelaza
działania kwasem solnym na siarczek żelaza
działania kwasem solnym na siarczek ołowiu
W stałej temperaturze prężność gazu jest odwrotnie proporcjonalna do jego objętości -jest to prawo:
Henry'ego
Boyle'a-Mariotte'a
Daltona
Wartość entropii w procesach odwracalnych
zależy od drogi procesu
nie zależy od rodzaju procesu
nie zależy od drogi procesu
Wiązanie atomowe nosi nazwę wiązania:
homeopolarnego
kowalencyjnego
prawdziwie chemicznego
Wiązanie koordynacyjne ma charakter wiązania:
protonowego
donorowo-akceptorowego
wodorowego
Wiązanie atomowe nosi nazwę wiązania:
heteropolarnego
kowalencyjnego
prawdziwie chemicznego
Wiązanie atomowe nosi nazwę wiązania:
kowalencyjnego
homeopolarnego
może być także wiązaniem podwójnym
Wiązanie atomowe nosi nazwę wiązania:
kowalencyjnego
prawdziwie chemicznego
homeopolarnego
Wiązanie koordynacyjne ma charakter wiązania:
donorowo-akceptorowego
protonowego
wodorowego
Wiązanie niezlokalizowane występować może w:
związkach nienasyconych o sprzężonych wiązaniach podwójnych
Wodorotlenek nosi nazwę:
wapna palonego
mleka wapiennego
wapna gaszonego
Wodorotlenek wapnia nosi nazwę:
wapna gaszonego
Wodór atomowy jest wodorem powstającym:
w wyniku dysocjacji H2
w wyniku rozpadu wodoru aktywnego
w wyniku dysocjacji deuteru
Wskaż nietoksyczny alkohol
etanol
etanol-1,2-diol
propanol-1,2,3-triol
Wskaż nietoksyczne alkohole:
gliceryna
propano-1,2,3-triol
Wskaż równanie reakcji substytucji (podstawiania):
C6H6+CI2 = C6H5Cl + HCI
Współczynnik dyfuzji wyraża się w jednostkach:
m2/s
m3/s
mm2/s
Współczynnik polaryzacji charakteryzuje:
zdolność jonu do odkształcenia pod wpływem pola jonów sąsiednich
zdolność do migracji jonu pod wpływem pola
zdolność do łączenia się jonów
Wychwyt K polega na:
wychwyceniu elektronu z poziomu K
wychwyceniu elektronu z poziomu K lub L
jednoczesnym wydzieleniu neutronu lub neutrino
Wyrażenie Σm=const. Stanowi zapis:
prawa zachowania masy
prawa zachowania materii
prawa Einsteina
Wskaż równanie reakcji substytucji ( podstawienia ) C3H5+HCL = C3H7C
C6H6+CL2 = C6H5CL+HCL
C2H5OH = C2H4+H2O
Zjawisko przechodzenia osadu z powrotem w stan układu koloidalnego nosi nazwę
koagulacji
elektroforezy
peptyzacji
Związki, w których występują wiązanie wielokrotne pomiędzy atomami
węgla:
związki nienasycone o wiązaniu potrójnym wegiel-azot lub podwójnym wegiel-tlen
alkany podczas chlorowania
Związki o charakterze soli metalicznych powstające przez zastąpienie w amoniaku jednego atomu wodoru przez atom metalu noszą nazwę:
amidków
aminokwasów
azydków
Zad 1.
Próbka zawierająca 1 mol wody ulega izotermicznemu odwracalnemu skropleniu w temp 100 stopni Celsjusza. Standardowa entalpia parowania w tej temperaturze wynosi 40656. Oblicz pracę wykonaną w trakcie procesu oraz zmianę energii wewnętrznej.
Rozwiązanie
Q=nCvT A= -Q ΔU=0
Zad 2.
Prędkość cząstki o m=1 g znana jest z dokładnością 1x10-6 m2/s. Oblicz minimalna nieoznaczalność położenia tej cząstki wzdłuż linii lotu.
Rozwiązanie
ΔxΔv≥ħ/2Πm Δx= ħ/2ΠmΔv ħ=h/2 h- stała Plancka
Zad 3.
Oblicz moc promieniowania emitowaną przez wycinek powierzchni 2x3m w temp. 1500K.
Rozwiązanie
ε =σ T4A A=2x3m σ= stała Boltzmana
Zad 4.
Zmieszano dwa roztwory etanolu: 150 cm3 96% roztworu etanolu o d1=0,804 g/ cm3 i 350 cm3 roztworu etanolu o d2=0,939 g/ cm3, w którym ułamek molowy wynosi xH2O=0,974. Podać skład roztworu po zmieszaniu (w ułamkach molowych).
Dane: Vr=150 cm3
Cp=96% Szukane: xS=?
d=0,804 g/ cm3 x'S=?
V'r=350 cm3 xH2O
d'=0,939 g/ cm3 x'H2O
xO=0,974
Rozwiązanie
Roztwór I
Cp=ms/mr 100%
mr= d Vr=120,6 g
ms= (Cp d Vr) / 100%=115,776g
MS=46 g/mol
n=2,5 mol
nH2O= mH2O/ MH2O
mH2O= mr - ms= 4,8 g
nH2O=0,27 mol
nr=2,77 mol
Roztwór II
xO=0,974 (=n'H2O/ n'S )
m'r=328,65 g
M'S=64 g/mol
n'r=5,1 mol
n'H2O=4,97 mol
xSO=1- xO= 0,026 = n'S / n'r
n'S=0,13 mol
Nr=7.87 mol
nS=2,5 mol
n'S=0,13 mol
nH2O=0,27 mol
n'H2O=4,97 mol
xS=0,32
x'S=0,02
xH2O=0,03
x'H2O=0,63
Zad. 5
Standardowa entalpia spalania ΔH0 ciekłego fenolu w temp. 298 K wynosi 3054 kJ/mol a jego standardowa entropia molowa ΔS0 144 J/K mol. Oblicz standardowa entalpie swobodna ΔG0 tworzenia fenolu w temp. 290 K.
ΔG0=ΔH0-TΔS0,
Dane:ΔH0, ΔS0, T ΔG0≈3011kJ/mol
Zad. 6
Cząsteczkowa objętość molowa propanonu-1 i trichloro metanu w mieszaninie o ułamku molowym 0,4693 wynosi odpowiednio 74,166 cm3/mol i 80,235 cm3/mol. Jaka objętość zajmie roztwór o masie 1 kg?
Rozwiązanie:
Mprop =58 g/mol
Mtri =119,5 g/mol
I
xtri = ntri / ( ntri + nprop)=0,4693
ntri=0,4693 ntri +0,4693 nprop
ntri=0,88 nprop
xprop =1 - xtri =0,5307= nprop / ( ntri + nprop)
nprop =0,5307 nprop +0,5307 ntri
ntri=0,88 nprop
II
58 g/mol nprop+ 119,5 g/mol ntri =1000g
58 g/mol nprop+ 119,5 g/mol 0,88 nprop =1000g
163,16 g/mol nprop=1000 g
nprop=6,1 mol
ntri =5,4 mol
74,166 cm3 - 1mol
Vprop - 6,1 mol
Vprop= 452,4 cm3
80,235 cm3 - 1 mol
Vtri - 5,4 mol
Vtri= 433,3 cm3
V= Vtri + Vprop = 885,7 cm3
Zad. 7
Oblicz standardową energie wewnętrzną tworzenia ciekłego octanu metylu wiedząc, że jego standardowa entalpia wynosi -442 kJ/mol.
Rozwiązanie:
ΔH=ΔU+pdV
ΔH=ΔU ponieważ dV=0 bo ciecz jest nie ściśliwa.
ΔH=ΔU= -442 kJ/mol
Zad. 8
Oblicz długość fali elektronów przyspieszonych ze stanu początkowego różnicą potencjałów wynoszącą 40 kV
W=E, W=Ue, ![]()
, ![]()
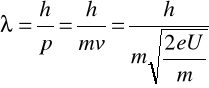
Wyszukiwarka
Podobne podstrony:
Chemia - sciagi, 2 semestr
chemia, Ściągi
sprawozdanie chemia 3, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania od Seweryna
ĆWICZENIE 9, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
chemia, ściągi
Właściwości tlenu wystepowanie azotu chemia, Ściągi, Chemia
zagadnieniaSEM1a, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 1
ściąga chemia, Studia PG, Semestr 02, Chemia, Koło
ZagadnieniaSEM2, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 2
Treści laboratorium, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratorium
Chemia tabelki - ściąga, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratori
Sciagi, Studia, Semestr VI, geodezja inżynieryjna, inz egzamin, inzynieryjna
CHEMIA ANALITYCZNA 2, Uczelnia, Semestr III
ZAGADNIENIA TEORETYCZNE ĆW.1-3, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW. 4-6, Studia TOŚ, chemia analityczna-labor. semestr III
chemia, Ściągi
więcej podobnych podstron